Похожие презентации:
Химическая кинетика
1.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЛекция 3
ХИМИЧЕСКАЯ КИНЕТИКА
2. Содержание
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСодержание
Общие понятия
Скорость реакций в гомогенных и гетерогенных
системах
Энергия активации
Влияние различных факторов
на скорость
химических реакций
Влияние концентрации. Кинетические уравнения
Влияние давления
Влияние температуры
Влияние катализаторов
Модуль I. Лекция 3. Химическая кинетика
3. Основные понятия химической кинетики
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОсновные понятия химической
кинетики
Химическая кинетика изучает скорости и механизмы химических
процессов, а также факторы, влияющие на них
Скорость реакции равна числу элементарных актов
взаимодействия, происходящих за единицу времени в единице
реакционного пространства
Элементарный акт - каждое непосредственное взаимодействие
частиц, приводящее к изменению их химического строения
Элементарная стадия химического превращения - сумма всех
однотипных элементарных актов
Механизм химической реакции - совокупность элементарных
стадий, из которых складывается данная реакция
Модуль I. Лекция 3. Химическая кинетика
4.
5.
6.
7. Молекулярность реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАМолекулярность реакции
определяется числом молекул, одновременным
взаимодействием между которыми осуществляется
элементарный химический акт
Мономолекулярная реакция:
N2O5 = NO + NO2 + O2
Бимолекулярная реакция:
2Н = Н2,
Тримолекулярная реакция:
Cl2 + 2NO = 2NOCl
Реакции с молекулярностью выше трех неизвестны
Модуль I. Лекция 3. Химическая кинетика
8. Скорость реакции в гомогенных системах
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСкорость реакции
в гомогенных системах
гом
гом
Δ
ΔC
VΔ
Δ
– средняя скорость реакции в интервале
времени Δ , моль /( л с )
Δ – изменение количества вещества, моль
V – объем системы, л
С – концентрация вещества, моль/л
Модуль I. Лекция 3. Химическая кинетика
9. Cкорость реакции по различным реагентам
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАCкорость реакции
по различным реагентам
Средняя скорость реакции
2NO(г) + O2 (г) = 2NO2 (г)
по оксиду азота (II)
по кислороду
CNO 2 CO2
Модуль I. Лекция 3. Химическая кинетика
NO
NO
Δ CNO
Δ
O2
Δ CO 2
Δ
2 CO2
2 O2
Δ
10. Определение средней скорости реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОпределение средней скорости
реакции
С
гом
С0
∆С
C1 C0
1 0
С1
Δ
0
0
Модуль I. Лекция 3. Химическая кинетика
α
1
11. Мгновенная скорость реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАМгновенная скорость реакции
(скорость в данный момент времени)
равна первой производной от концентрации реагента по
времени
гом
С
dC
dC/d tg
С0
гом
С1
0
d
0
1
Модуль I. Лекция 3. Химическая кинетика
α
C1 C0
1 0
12. Скорость реакции в гетерогенных системах
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСкорость реакции
в гетерогенных системах
В гетерогенной системе взаимодействие компонентов
происходит на поверхности раздела фаз
гетер
Δ
SΔ
гетер
d 1
d S
S - площадь поверхности раздела фаз, м2
Размерность скорости реакции в гетерогенных
системах моль/(м2 с).
Модуль I. Лекция 3. Химическая кинетика
13. Энергия активации
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЭнергия активации
Химическое взаимодействие осуществляется при
столкновении частиц, которые обладают избытком
энергии, достаточным для преодоления сил
взаимного отталкивания их электронных оболочек
При эффективном соударении частицы переходят в
неустойчивое промежуточное состояние нестабильный активированный комплекс, с более
высоким уровнем энергии, чем средний уровень
энергии частиц системы
Энергия активации (Еа) - минимальная избыточная
энергия частиц по сравнению со средним уровнем,
необходимая для протекания реакции
Модуль I. Лекция 3. Химическая кинетика
14. Энергетическая диаграмма взаимодействия А2+В2=2АВ
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЭнергетическая диаграмма
взаимодействия А2+В2=2АВ
Схема образования активированного комплекса:
А
А
А
А
А
+
В
А
+
В
В
В
В
В
Изменение энергии системы в ходе химической реакции:
А
Е
В
А2, В2
А
В
Еа
∆Н
АВ
Ход реакции
Модуль I. Лекция 3. Химическая кинетика
15.
16. Влияние концентрации на скорость химической реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВлияние концентрации
на скорость химической реакции
Закон действующих масс:
скорость элементарной химической реакции пропорциональна
произведению концентраций реагирующих веществ, возведенных
в степени, равные стехиометрическим коэффициентам
Элементарные реакции - реакции, протекающие в одну стадию
Кинетические уравнения элементарных реакций:
Кинетическое уравнение - математическая зависимость скорости
реакции от концентрации
бимолекулярной A + B = C
kC A CB
тримолекулярной 2A + B = D
kC2ACB
k – константа скорости
СА, СВ – концентрации веществ, моль/л
Модуль I. Лекция 3. Химическая кинетика
17.
18.
19.
20.
21.
22.
23.
24. Особенности гетерогенных реакций
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОсобенности гетерогенных реакций
Стадии гетерогенных реакций :
подвод вещества к реакционной поверхности
химическое взаимодействие
отвод продукта реакции от поверхности
Для реакции C + O2 = CO2
лимитирующая стадия - подвод вещества
Скорость реакции CaCO3 + 2HCl = CaCl2 + H2O + CO2
определяется скоростью химического взаимодействия
I стадия:
CaCO3 + H+ = Ca2+ + HCO3-
II стадия:
kC
HCO3- + H+ = H2O + CO2
Н
Модуль I. Лекция 3. Химическая кинетика
I стадия лимитирующая
25. Влияние давления на скорость химической реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВлияние давления на скорость
химической реакции
Влияние давления существенно для реакций с участием
газообразных веществ, так как концентрация реагентов
меняется пропорционально давлению (T = const)
Пример. Реакции 2NO(г) + 2H2(г) = N2(г) + 2Н2О(г)
соответствует кинетическое уравнение
2
kCNO
CH
2
При увеличении давления в 3 раза константа скорости не
изменяется, а концентрации реагирующих веществ
увеличиваются в 3 раза
2
2 k(3CNO )2 3CH 27kCNO
CH 27 1
2
скорость увеличивается в 27 раз
Модуль I. Лекция 3. Химическая кинетика
2
26. Правило Вант-Гоффа
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАПравило Вант-Гоффа
При повышении температуры на каждые 100 скорость
большинства реакций увеличивается в 2 4 раза:
1
T2 T1 (T2 -T1)/10
и
2 - скорость реакции при температурах
Т1 и Т2 (Т2 > Т1)
- температурный коэффициент
скорости, равный 2 4
Например, при повышении температуры с 20 до 400С
скорость реакции (γ = 2) увеличивается в 4 раза:
Т2 4010 20 2
2
2 4
Т1
Модуль I. Лекция 3. Химическая кинетика
27.
28. Влияние температуры на скорость химической реакции Распределение частиц по энергиям при температурах Т1 и Т2 (распределение
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВлияние температуры на скорость
химической реакции
Распределение частиц по энергиям при температурах Т1 и Т2
(распределение Максвелла-Больцмана):
Нагревание
Увеличение количества
активных частиц
E Ea
Увеличение количества
эффективных соударений
Увеличение скорости реакции
Модуль I. Лекция 3. Химическая кинетика
29. Зависимость константы скорости от температуры
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗависимость константы скорости
от температуры
Уравнение Аррениуса
-
k Ae
Eа
RT
Еа - энергия активации, кДж/моль
R - универсальная газовая постоянная, равная
8,31∙10-3 кДж /(моль К )
Т - абсолютная температура, К
А - коэффициент пропорциональности, отражающий
вероятность столкновения активных частиц;
величина постоянная для данной реакции
Модуль I. Лекция 3. Химическая кинетика
30. Влияние катализаторов на скорость химической реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВлияние катализаторов
на скорость химической реакции
Катализаторы - вещества, увеличивающие скорость реакции и
остающиеся в конце реакции химически неизменными
Катализаторы применяют для изменения скорости
термодинамически возможных процессов ( G<0)
Ингибиторы - вещества, снижающие скорость реакции
Автокатализ – увеличение скорости реакции под действием одного
из продуктов
Выделяют гомогенный и гетерогенный катализ
Промоторы – вещества, добавки которых к катализатору усиливают
эффективность его действия
2SO2(г) + О2(г)= 2SO3(г)
катализатор NO(г) гомогенный катализ
Модуль I. Лекция 3. Химическая кинетика
катализатор V2O5(к) или Pt(к) гетерогенный катализ
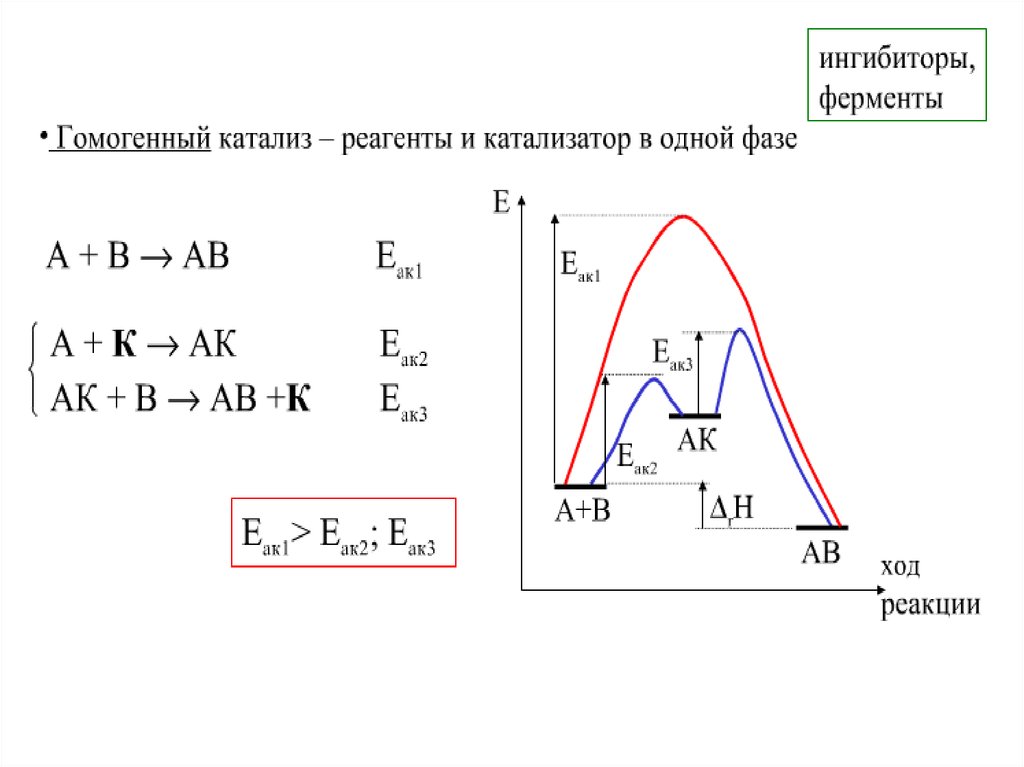
31. Влияние катализатора
A B1
Eкат
Е1акт
B AK
A K
A+B
A+B+K
2
AK
Hисх
Е2акт
AB
AB+K
Hпрод
32.
33.
34.
35. Заключение
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗаключение
Химическая кинетика изучает скорости и механизмы химических процессов,
а также факторы, влияющие на них
Скорость реакции - изменение количества любого из реагирующих веществ
или продуктов реакции за единицу времени в единице реакционного
пространства
Энергия активации - минимальная избыточная энергия частиц по
сравнению со средним уровнем, необходимая для протекания реакции
Скорость реакции зависит от C, p, T и катализатора:
– зависимость скорости от концентраций реагирующих веществ
выражается экспериментально получаемым кинетическим уравнением;
– изменение давления в системе приводит к пропорциональному
изменению концентраций газообразных реагентов и соответствующему
изменению скорости
– в соответствии с правилом Вант-Гоффа при повышении температуры на
каждые 10о скорость большинства реакций увеличивается в 2 4 раза
– катализаторы - вещества, увеличивающие скорость реакции за счет
снижения энергии активации
Модуль I. Лекция 3. Химическая кинетика
36. Рекомендуемая литература
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.:
Высш. шк., 1994
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия,
2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк.,
2007
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы
неорганической химии. Под ред. Ю. Д. Третьякова. - М.:
Академия, 2004
Стромберг А.Г., Семченко Д.П. Физическая химия. - М.: Высш.
шк., 2003
Гаршин А.П. Неорганическая химия в схемах, рисунках,
таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Модуль I. Лекция 3. Химическая кинетика



































 Химия
Химия








