Похожие презентации:
Атом құрылысы
1. Атом құрылысы
АТОМ ҚҰРЫЛЫСЫМАХМУТ АДИЛЬЖАН
ТЕМИРЖАНОВ АДИЛЬ
ЯФ-11
2.
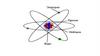
Атом (көне грекше: ἄτομος - Химиялықэлементтерді құрайтын, олардың өзіне
тән ерекшеліктерін сақтайтын ең
кішкене бөлшек.
3.
Атом бүтіндей алғанда зарядсыз, бейтарап бөлшек. Ол ортасында өзінен радиусы 104 -105 есекіші көлемді алып жатқан оң зарядты ядродан және оны айнала қозғалып жүрген теріс
зарядты электрондардан тұрады. Атом өзінің сыртқы бір немесе бірнеше электрондарын
жоғалтқанда оң, ал сырттан электрон қосып алғанда теріс ионға айналады. Атомның сызықтық
өлшемдері ~ 10-8 см, көлденең қимасының ауданы ~10-16 см2, көлемі ~10-24 см3.
4.
• Атомның массасы, негізінен оның ядросының массасына тең және ол массалық санға(А), яғни протондар мен нейтрондардың жалпы санына (нуклондардың жалпы санына)
пропорционал болып ұлғаяды. Өйткені атомдағы электронның массасы (0.91*10-20 г)
бір протонның немесе нейтронның массасынан (1.67*10-24 г) 1.840 есе аз. Сондықтан
атомның ауырлық орталығы ядроға дәлдей келеді. Атом массасы ядро массасымен
ондағы электрондар массаларының дәл қосындысына тең емес. Олардың арасындағы
айырым атомның байланыс энергиясын анықтайды. Атомның ішкі энергиясының тек
дискретті (үздікті) мәндері болады. Оның ең төменгі деңгейі атомның негізгі күйі
E1 (ол ең тұрақты, шексіз ұзақ өмір сүретін күйі), ал жоғарғы энергия деңгейлері
қозған күйлер Еі (і=2, 3, …) деп аталады, (ол аз өмір сүреді). Қозған күйден ~10-8 сек.
ішінде атом негізгі күйге ауысып отырады. Осындай ауысу кезінде атомға осы екі
деңгейінің айырымына тең (hν=Eν-E1, мұндағы h – Планк тұрақтысы, ν – ұшып шыққан
сәуле квантының жиілігі) сырттан энергия берілуі не шығарылуы шарт. Атом
энергиясының дискретті квантталуы оның құрамындағы бөлшектердің толқындық
қасиетінің болуынан.
5. АТОМНЫҢ ҚҰРЫЛЫСЫ
АТОМНЫҢ ҚҰРЫЛЫСЫ
Периодтық жүйе периодтық заңның
құрылымдық кескіні. Ол 7 периодтан 8 топтан
тұратын кесте.
Периодтар үлкен және кіші болып бөлінеді.
Алғашқы үш период кіші периодтар, олар бір
қатардан ғана тұрады, ал үлкен периодтар екі
қатардан тұрады.
Бір периодта орналасқан элементтердің
энергетикалық деңгейлерінің саны бірдей
болғанымен, олардың ядро зарядтарының
артуына байланысты ядроның электронды
тарту күші артады, сондықтан атом радиустары
солдан оңға карай кемиді.
Периодтарда солдан оңға қарай сыртқы
қабаттағы электрондар саны біртіндеп
артады, бұл металдық қасиеттің біртіндеп
әлсіреп, бейметалдық қасиеттің артуына
әкеп соғады.
6. АТОМДАҒЫ ЭЛЕКТРОНДАРДЫҢ КҮЙІ
Атом өте ұсақ бөлшек болғандықтан, ондағы электронның қозғалысы
микродүниенің қозғалу заңдылықтарына бағынады. Электрондар ядро
сыртындағы кеңістікті біртіндеп толтырады, электрондардың орналасу
заңдылықтарын білу элементтің физикалық және химиялық қасиеттерін
анықтау үшін қажет. Электрон ядроны одан белгілі бір қашықтықта (энергия
қорының шамасына қарай) айналып жүру мүмкіндігі ең жоғары кеңістіктің
бөлігі орбиталь - электрондық бұлт деп аталады. Қозғалыстағы электрон
бұлтының пішіні әр түрлі болады: шар тәрізді, олар s әрпімен белгіленеді. рэлектрондар гантель тәрізді, олардан басқа d - деңгейшелері де болады.






 Химия
Химия