Похожие презентации:
Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05)
1.
ALMA MATERТРЕБУЕТ!!!
Устав ВГМУ
... присутствие
на лекциях и
занятиях в
халате!!!
1
2. Второе начала термодинамики и его применимость к биосистемам. Химическое равновесие
Лекция №5Лектор:
кандидат химических наук, доцент
Иванова Надежда Семёновна
3.
3I
закон
термодинамики
позволяет
определить реакции, но не даёт ответа на
вопрос о её направлении. Ответ на этот
вопрос даёт II закон термодинамики,
который выделяет теплоту в особый вид
энергии и вводит понятие энтропии.
4. Второе начало термодинамики
4Второе начало термодинамики
Энтропия (S) мера рассеянной
или обесцененной энергии.
“Теплота сама по себе не может
перейти от более холодного тела
к более теплому” [Р.Клаузиус
(1850)]
“В природе невозможен процесс,
единственным результатом
которого была бы механическая
работа, совершенная за счет
охлаждения теплового
резервуара” [У.Томсон (1851)]
Рудольф Юлиус Эмануэль
Клаузиус (1822-1888)
5. Второе начало термодинамики
5Второе начало термодинамики
Q
S
T
Q
В самопроизвольном процессе
В равновесном процессе
S
T
Q
S
T
Для изолированной системы, где Q = 0:
В самопроизвольном процессе S > 0
В равновесном процессе
S = 0
В общем случае в изолированной системе
S 0
6. Статистическая природа S
6Статистическая природа S
S = kБ lnW
W – число различных состояний системы,
доступное ей при данных условиях, или
термодинамическая
вероятность
макросостояния системы.
kБ = R/NА = 1,38 10-16 [эрг/град] –
постоянная Больцмана
В 1872 г. Л.Больцман предложил
статистическую формулировку второго
закона термодинамики:
«Изолированная
система
эволюционирует преимущественно в
направлении
большей
термодинамическоой вероятности»
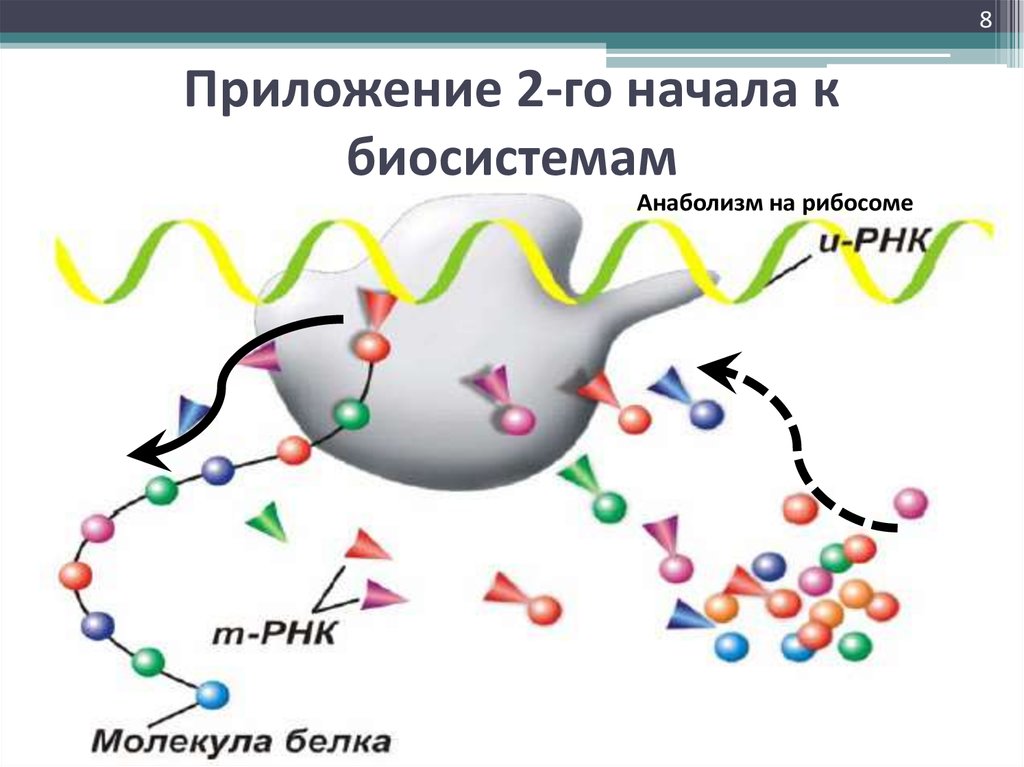
7. Приложение 2-го начала к биосистемам
7Приложение 2-го начала к
биосистемам
Катаболизм в лизосоме
Лизосома
8. Приложение 2-го начала к биосистемам
8Приложение 2-го начала к
биосистемам
Анаболизм на рибосоме
9. Уравнение Гиббса…
9Уравнение Гиббса…
… является объединённым
выражением I и II начал
термодинамики.
Для данной температуры
G = H T S
При G < 0 реакция возможна;
При G > 0 реакция невозможна;
При G = 0 система находится в
равновесии
Джозайя Уиллард Гиббс
(1839-1903)
10. Соотношение энтальпийного и энтропийного факторов
10Соотношение энтальпийного и
энтропийного факторов
Знак H
Знак S
Знак G
Возмож-ть
самопроизв.
реакции
+
+
Нет
+
Да
Зависит от
соотношения
H и T S
11. Реакции обмена
11Реакции обмена
Экзэргонические реакции обмена, идущие с
выделением энергии ( G<0).
Эндэргонические реакции обмена, идущие с
потреблением энергии ( G>0).
Сопряжение – процесс передачи энергии от
экзэргонических к эндэргоническим реакциям, а две
реакции, одна из которых без другой идти не может,
называются сопряжёнными.
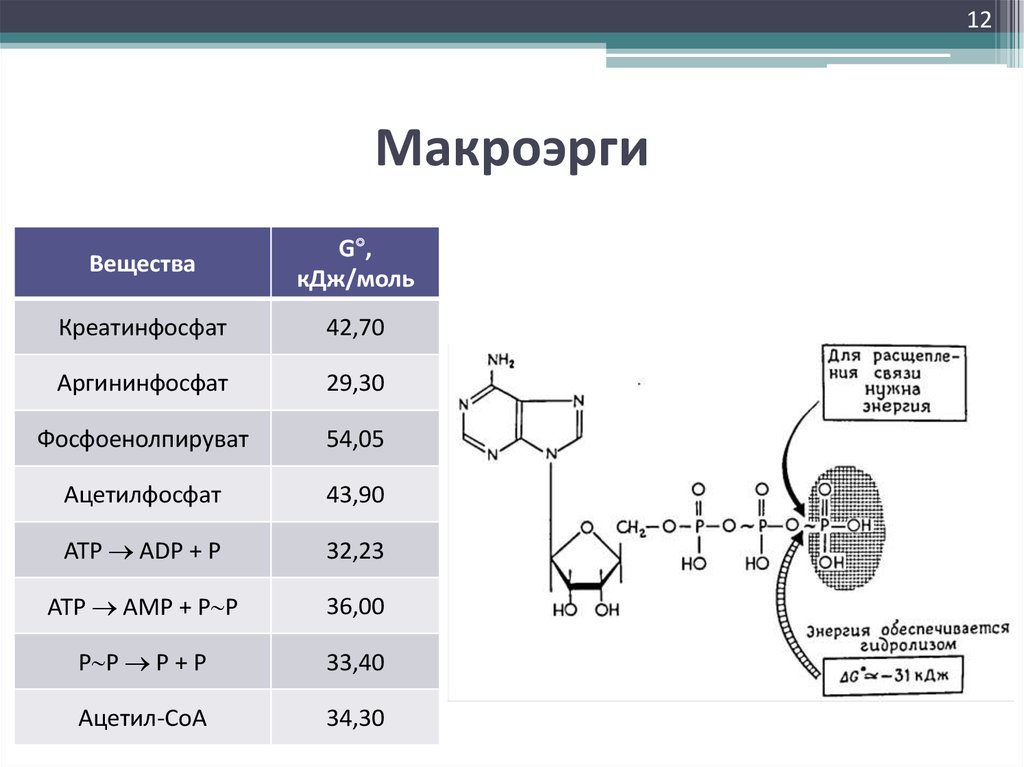
12. Макроэрги
12Макроэрги
Вещества
G ,
кДж/моль
Креатинфосфат
42,70
Аргининфосфат
29,30
Фосфоенолпируват
54,05
Ацетилфосфат
43,90
ATP ADP + P
32,23
ATP AMP + Р Р
36,00
Р Р Р + Р
33,40
Ацетил-СоА
34,30
13. Критерии равновесия
13Критерии равновесия
Для обратимой реакции:
aA + bB xX + yY
при постоянном давлении и температуре:
H = T S, тогда G = 0.
С точки зрения кинетики состояние равновесия
характеризуется величиной константы равновесия:
X Y
Kp
a
b
A B
x
y
(при Т=const)
14. Уравнение изотермы химической реакции
14Уравнение изотермы химической
реакции
Для процесса в общем виде:
c c
G G RT ln
c c
x
X
a
A
y
Y
b
B
В положении равновесия:
G = 0
G = RTlnKр
Якоб Хендрик Вант-Гофф
(1852-1911)
15. Соотношение Пс и Кр
15Соотношение Пс и Кр
c c
Пс
c c
x
X
a
A
y
Y
b
B
Пс Кр
G 0
Пс Кр
G 0
Пс = Кр
G = 0
16. Уравнение изобары химической реакции
16Уравнение изобары химической
реакции
Kp2 H 1 1 Ограничение: Т должна
быть небольшой.
ln
Kp1
R T1 T2
Н 0
Н 0
Н = 0
Kp2
ln
0
Kp1
Kp2
ln
0
Kp1
17. Влияние давления на смещение равновесия
17Влияние давления на смещение
равновесия
n = (x + y) (a + b)
n изменение числа моль газов в реакции.
n 0
n 0
n = 0
18. Принцип подвижного равновесия
18Принцип подвижного равновесия
При изменении одного из
условий химического равновесия
оно смещается в сторону той
реакции,
которая
уменьшает
произведённое изменение.
Принцип адаптивных
перестроек
Любая живая система при
воздействии
на
неё
перестраивается
так,
чтобы
уменьшить это воздействие.
Анри-Луи Ле Шателье
(1850-1936)

















 Химия
Химия








