Похожие презентации:
Строение тел. Агрегатные состояния вещества и фазовые переходы. Законы термодинамики
1.
Лекция 8.Строение тел .Агрегатные состояния вещества и
фазовые переходы.
Законы термодинамики.
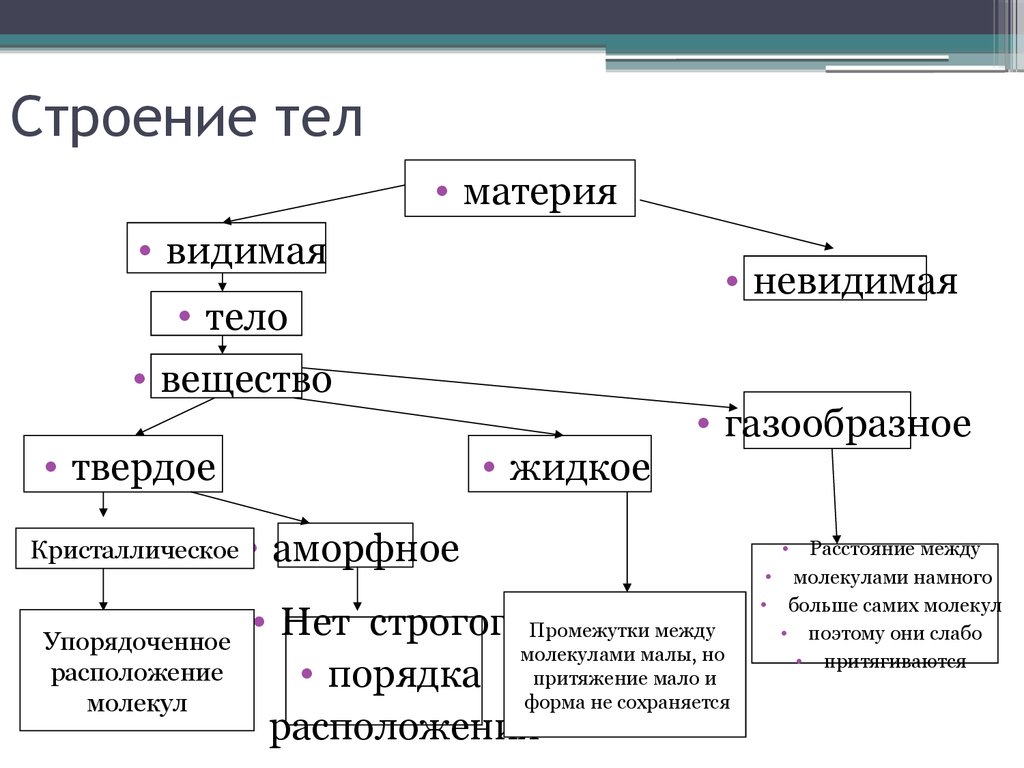
2. Строение тел
• материя• видимая
• невидимая
• тело
• вещество
• твердое
• жидкое
Кристаллическое
Упорядоченное
расположение
молекул
• газообразное
аморфное
• Нет строгогоПромежутки между
молекулами малы, но
• порядка притяжение мало и
форма не сохраняется
• расположения
Расстояние между
• молекулами намного
• больше самих молекул
• поэтому они слабо
• притягиваются
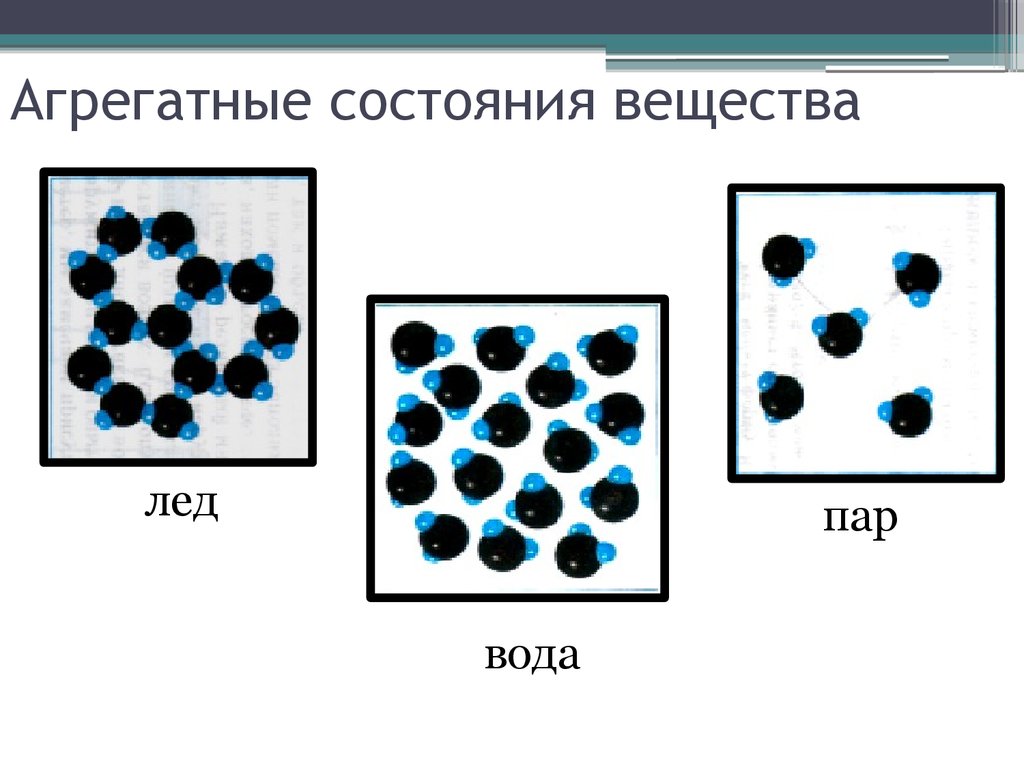
3. Агрегатные состояния вещества
ледпар
вода
4.
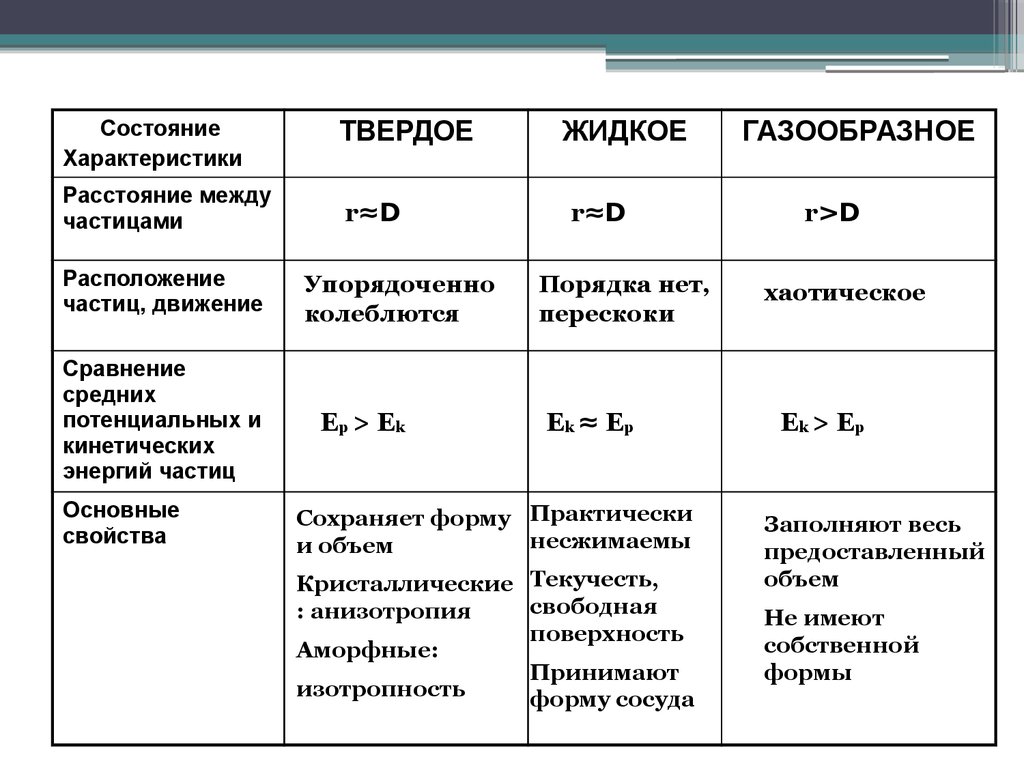
СостояниеХарактеристики
Расстояние между
частицами
Расположение
частиц, движение
Сравнение
средних
потенциальных и
кинетических
энергий частиц
Основные
свойства
ТВЕРДОЕ
r≈D
Упорядоченно
колеблются
Ep > E k
ЖИДКОЕ
r≈D
Порядка нет,
перескоки
Ek ≈ Ep
Сохраняет форму Практически
несжимаемы
и объем
Кристаллические Текучесть,
свободная
: анизотропия
поверхность
Аморфные:
Принимают
изотропность
форму сосуда
ГАЗООБРАЗНОЕ
r>D
хаотическое
Ek > Ep
Заполняют весь
предоставленный
объем
Не имеют
собственной
формы
5. Характеристика
• Совокупность однородных частей, на которые распадаетсясистема, называют фазами.
• Фаза – это термодинамическое равновесное состояние
вещества, отличающееся по физическим свойствам от
других возможных равновесных состояний того же вещества.
• Агрегатные состояния – это состояния одного и того
же вещества, переходы между которыми сопровождаются
скачкообразным изменением его физических свойств.
Вещество может быть в трех агрегатных состояниях:
твердом, жидком и газообразном (иногда называют еще
четвертое состояние – плазму
• Переход вещества из одной фазы в другую - фазовый
переход - всегда связан с качественными изменениями
свойств вещества.
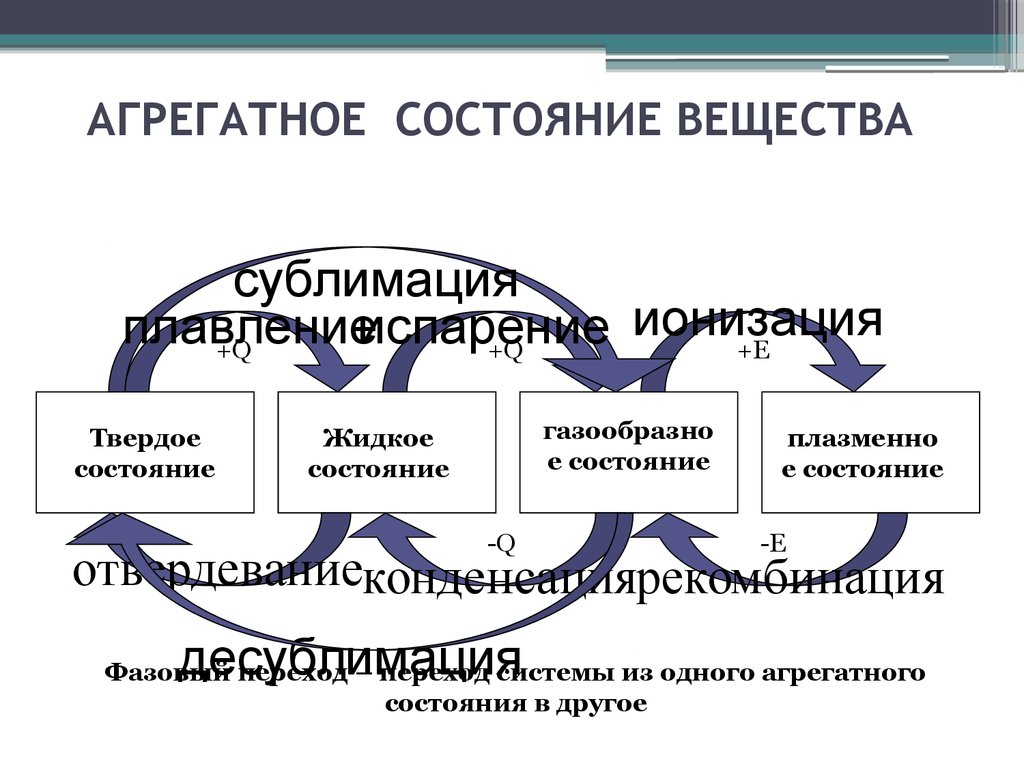
6. АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВА
сублимацияионизация
плавление
испарение
+Q
+Q
+E
Твердое
состояние
газообразно
е состояние
Жидкое
состояние
-Q
плазменно
е состояние
-E
отвердеваниеконденсациярекомбинация
десублимация
Фазовый переход – переход системы из одного агрегатного
состояния в другое
7. Термодинамика
• Плазма - это электронейтральная совокупностьнейтральных и заряженных частиц
(трехкомпонентная: атомы, ионы, электроны)
• Термодинамика- раздел физики , изучающий
возможности использования внутренней энергии тел
для совершения механической работы.
• Открытой- называют систему, которая может
обмениваться с окружающей средой и веществом, и
энергией.
8. Термодинамическая система
• Термодинамическая система (или просто система) –часть пространства, которая составляет предмет
исследований химической термодинамики. Система
должна иметь реальную(или виртуальную) границу и
содержать большое число молекул.
• То, что находится вне системы , называется
окружающей средой.
• Система называется закрытой(изолированной) , если
между ней и окружающей средой возможны все типы
взаимодействий, кроме обмена веществом
9. Внутренняя энергия
Внутренняя энергия-это энергия физическойсистемы, зависящая от её внутреннего состояния.
Внутренняя энергия макроскопического тела
равна сумме кинетических энергий
беспорядочного движения всех молекул (или
атомов) тела и потенциальных энергий
взаимодействий всех молекул друг с другом
(но не с молекулами других тел).
Внутренняя энергия термодинамической системы
- это сумма внутренних энергий тел, входящих в
систему
10. Внутренняя энергия состоит из:
• Кинетическая энергия непрерывного хаотическогодвижения частиц тела.
• Потенциальная энергия молекул (атомов),
обусловленная силами межмолекулярного
взаимодействия.
• Энергия электронов в атомах
• Внутриядерная энергия.
11. Количество теплоты
• Количество теплоты – это энергия полученная или отданная телом в процессетеплопередачи(теплообмена).
• Теплообмен-процесс передачи энергии от одного тела к другому без совершения
работы.
• Обозначение :Q-количество теплоты[Дж]
• Удельная теплоемкость вещества – величина равная энергии, необходимой для
нагревания тела массой 1 кг на 1 К.
Äæ
• Обозначение: с- удельная теплоемкость вещества [
]
êã Ê
• Удельная теплота плавления вещества – величина равная энергии, необходимой для
того, чтобы тело массой 1 кг, взятое при температуре плавления полностью
расплавилось.
Äæ
• Обозначение : - теплота плавления вещества [
]
êã
• Удельная теплота парообразования вещества – величина равная энергии,
необходимой для того, чтобы жидкость массой 1 кг, взятая при температуре кипения
полностью перешла в газообразное состояние
Äæ
• Обозначение: L-удельная теплота парообразования [
]
êã
• Удельная теплота сгорания топлива – величина равная энергии, которая выделяется
при сгорании данного вида топлива массой 1 кг.
Äæ
• Обозначение: q-удельная теплота сгорания топлива[
]
êã
12. Внутренняя энергия
• Внутренняя энергия зависит от массы, температуры тела, родавещества и от того, в каком агрегатном состоянии находится тело –
твердом, жидком или газообразном.
• Обозначение: U-внутренняя энергия [Дж](джоуль)
U N E k N En
• Внутренняя энергия идеального газа равна кинетической энергии
теплового движения его атомов или молекул.
3 m
U
RT
2M
• где m– масса газа (г), — количество вещества (моль), M – молярная
масса (г/моль),R– универсальная газовая постоянная ( Дж/(моль ×
K)), T– абсолютная температура газа (К).
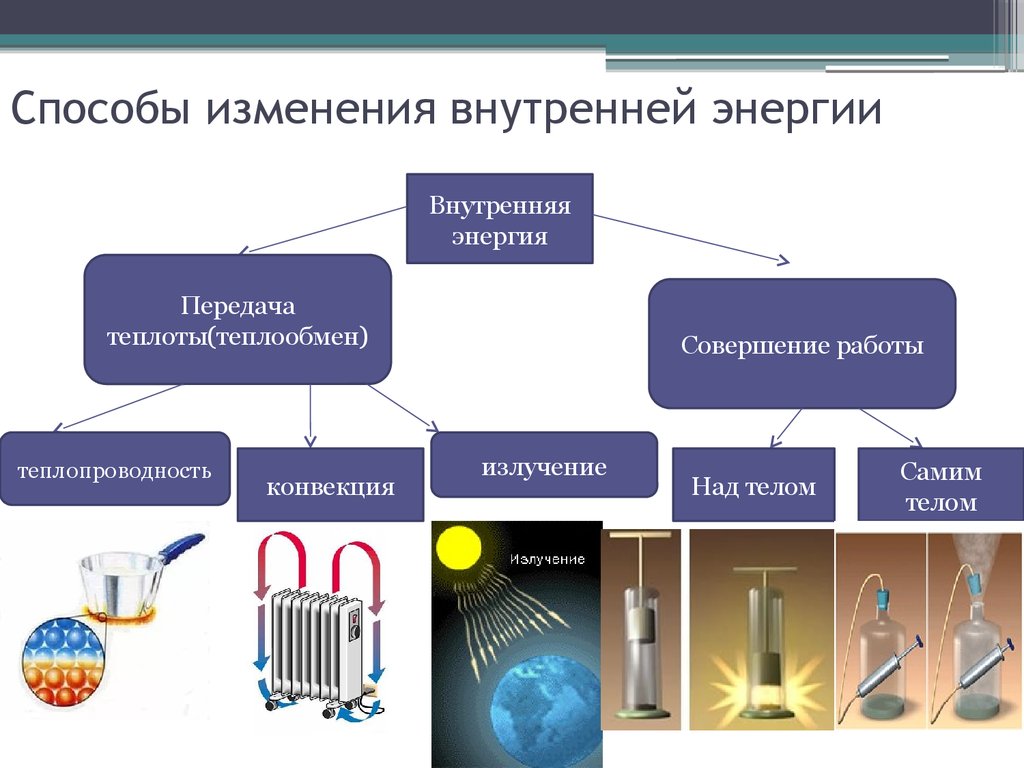
13. Способы изменения внутренней энергии
Внутренняяэнергия
Передача
теплоты(теплообмен)
теплопроводность
конвекция
Совершение работы
излучение
Над телом
Самим
телом
14. Изменение внутренней энергии
Жидкое
Количество теплоты
Потребление
Выделение
Что происходит с телом
нагревается
охлаждается
Формула
Условия
Тверд
ое
Газоо
бразн
ое
Что происходит с телом
Q ñm t 2 t1
t 2 t1 t 0
Q ñm t 2 t1
t 2 t1 t 0
Q m
Q m
плавление
Формула
кристаллизация
Условия
-
-
Что происходит с телом
Образуется пар
Сгорает топливо
Формула
Q=Lm
Условия
-
Q qm
-
15. Законы термодинамики
Первый закон термодинамики• Изменение внутренней энергии системы при переходе ее из
одного состояния в другое равно сумме работы внешних сил и
количества теплоты, переданного системе.
U Q A
• Количество теплоты, переданное системе, идет на изменение
ее внутренней энергии и на совершение системой работы над
внешними телами.
A Aг
Q U Aг
Второй закон термодинамики
• В циклически действующем тепловом двигателе невозможно
преобразовать все количество теплоты , полученное от
нагревателя , в механическую энергию.
16. Первый закон термодинамики для различных процессов
• 1.Изотермический процесс• В ходе изотермического процесса все полученное системой
количество теплоты идет на совершение работы
Q U Aã
U 0 , ò .ê. T 0
Q U Aã
Aã 0 , ò .ê. V 0
Q Aã
• 2. Изохорный процесс
• В ходе изохорного процесса все полученное системой количество
теплоты идет на изменение внутренней энергии системы.
• 3.Изобарный процесс
• А)одноатомный
Q U
5m
3m
m
Q
R T
U
R T , Aã R T
Q U Aã
2
2
• Б)не одноатомный(i – число степеней свободы движения частиц.)
m
i m
i 2 m
Q cm t 2 t1 , Aã R T
U
R T , Q
R T
2
2
17. Адиабатный процесс
• Процесс, который происходит без теплообмена свнешней средой называется адиабатным.
Q 0,0 U Aã
U Aã
если V 0 , то T 0
U Aг
p
если V 0 , то T 0
изотерма
адиабата
0
V
18. Определения
• Обратимый процесс- процесс , который может происходить как впрямом, так и в обратном направлении.
• Обратимый процесс-это идеализация реального процесса
• Необратимы процесс- процесс , обратный которому
самопроизвольно не происходит (теплообмен)
• Необратимым процессом является диффузия
• Диффузия- физическое явление , при котором происходит
самопроизвольное взаимное проникновение частиц одного вещества
в другое при их контакте
• Замкнутый процесс(цикл)- совокупность термодинамических
процессов ,в результате которых система возвращается в исходное
состояние.
• Коэффициент полезного действия теплового
À
двигателя(КПД)-отношение работы, совершаемой
двигателем за
цикл, к количеству теплоты, полученному от нагревателя
Q
• Обозначение:
-КПД[%]
19. Тепловые двигатели
ÊÏÄ : %нагреватель
Aã Qí Qõ
Qн
рабочее
тело
Qх
холодильник
Аг
Aã
100%
Q
Qí Qõ
100%
Qí
20. Лабораторная работа №3
«Опытная проверка закона Гей-Люссака»Цель работы: экспериментально проверить справедливость
соотношения V1/T1 = V2/T2.
• Оборудование : стеклянная трубка, запаянная
с одного конца, длиной 600 мм и диаметром
8-10 мм;
• цилиндрический сосуд высотой 600 мм и
диаметром 40-50 мм, наполненный горячей
водой (t ~ 60 °С);
• стакан с водой комнатной температуры;
• пластилин.
Измерено
Вычислено
l,
2
Δиl,
Указания
к выполнению
l1, мм
t1, 0С
t2, 0С работы:
мм
мм
Δol,
мм
Δl,
мм
Вычислено
ΔT, К
l1/l2
ε1, %
Δ1
T1/T2
ε 2, %
Δ2
T1, К
T2 , К
ΔиT,
К
ΔoT,
К















 Физика
Физика








