Похожие презентации:
Лазерная интерференционная микроскопия для исследования живых клеток
1.
Стр 1 из 58ЛАЗЕРНАЯ ИНТЕРФЕРЕНЦИОННАЯ
МИКРОСКОПИЯ ДЛЯ
ИССЛЕДОВАНИЯ ЖИВЫХ КЛЕТОК
2.
Стр 2 из 58Использование различных методов микроскопии для
исследования биологических объектов
Животные
клетки
Растительные
клетки
1 см
1 мм
100 mм 10 mм
Бактерии
митохондрии
Вирусы
1 mм 100 нм
оптическая микроскопия
Белки Молекулы
10 нм
1 нм
0,1 нм
Для получения хорошего разрешения, как
правило, приходится прибегать к
использованию красителей. Тяжело численно
определять толщину объектов.
электронная микроскопия
Не работает с живыми объектами
Интерференционая
микроскопия
сканирующая зондовая микроскопия
(для атомно-силовой микроскопии)
Неспособна хорошо работать с клетками мягких тканей (например,
нервными) . Более сложна при обучении.
3.
Биологические объекты, как правило,бесцветны и обладают низким контрастом
для их визуализации необходимо
Стр 3 из 58
улучшение контраста
Увеличить контраст можно за счет увеличения интенсивности отдельных участков клетки
(например использование красителей — увеличивается различие интенсивности между соседними
окрашенными и неокрашенными органеллами клетки)
Также можно увеличить контраст изображения за счет регистрации изменения фазы
образца и ее преобразования в видимое глазом изменение амплитуды
Это позволяет получить изображение живых объектов с их минимальными модификациями
световое изображение
интерференционное изображение
Лазерная интерференционная микроскопия
(ЛИМ) относится к таким методам
4.
Особенности ЛИМСтр 4 из 58
Помимо увеличения контраста и разрешения
лазерная интерференционная микроскопия
позволяет количественно оценить изменения
показателя преломления и толщины
биологических объектов, пропорциональные
оптической плотности образцов
(то есть, используя ЛИМ можно получать функциональные
изображения объектов, аналогично атомно-силовой
микроскопии)
Таким образом можно получать
трехмерные изображения
объектов, причем высота в
каждой точке объекта будет
пропорциональна локальному
изменению оптической
плотности
5.
Основные принципы ЛИМСтр 5 из 58
Луч лазера, являющегося источником освещения, разделяется на два луча:
луч проходящий через образец и контрольный луч, используемый для
сравнения.
В детекторе эти два луча интерферируют между собой. Поскольку лучи
проходят через разные оптические среды, они имеют разную скорость
продвижения, т. е. происходит сдвиг фазы. Таким образом за одно и тоже
время лучи проходят различный оптический путь
Оптическая разность хода лучей, называемая
оптическая разность хода (ОРХ), связана с
разностью фаз этих лучей, , соотношением:
ОРХ
2 2
Величина ОРХ, пропорциональна показателю преломления и
толщине образца. Значение фазовой высоты зависит от размеров и
свойств образца
6.
Разрешение ЛИМСтр 6 из 58
Латеральное разрешение определяется, аналогично традиционным
оптическим микроскопам, критереем разрешения Релея и составляет
величину около 0,5
мкм.
Вертикальное разрешение может достигать величины порядка 1
Коллоиды серебра в
физиологическом растворе
нм.
7.
Особенности отображения биологическихобъектов при помощи ЛИМ
Стр 7 из 58
Экспериментально измеряемая при помощи ЛИМ оптическая разность хода (ОРХ), или фазовая
высота, в каждой точке плоскости объекта представляет из себя сумму произведений показателя
преломления на толщину различных оптических сред в этой точке (напр. клеточных органелл). z и
n– толщина и показатель преломления оптической среды, соответственно:
ОРХ ( n1 z1 + n2 z2 + ... + nn zn ) - nmz
Нельзя разделить эти два случая
От перемены мест слагаемых сумма не меняется
m
m
n5 z5
n2 z2
m
n4 z4
m
m
n4 z4
n1z
m
n3 z3
n3 z3
m
m
n2 z2
m
n1 z1
n5 z5
m
n1 z1
n1z
= ОРХ
3D форма объекта отличается от его 3D фазового изображения!
8.
Особенности отображения биологическихобъектов при помощи ЛИМ
сечение реального
объекта
Стр 8 из 58
сечение фазового портрета
однородные клетки сферической или цилиндрической формы
нм
250
20
0
15
однородные клетки более сложной формы (эритроциты)
10
5
0
0
5
10
15
20
мкм
нм
300
гетерогенные объекты (большинство клеток в том числе
нейроны пиявки и прудовика)
0
30
25
20
15
mм
10
5
0
0
5
10
15
mм
20
25
9.
Интерпретация изменения фазовойвысоты
Стр 9 из 58
Продольное сечение фазового изображения (x)
ЛИМ микроскоп оценивает значение
ОРХ, , в каждой точке объекта
ОРХ (n - n0 ) z
Если величина n известна, то можно
оценить толщину объекта и рассчитать
его объем (напр., в случае эритроцитов)
Если известно изменение величины
толщины (объема) то можно оценить
изменение показателя преломления
объекта. Изменение показателя
преломления свидетельствует об
изменении свойств объекта
10.
Стр 10 из 58Связь ОРХ с количеством вещества
Показатель преломления связан с концентрацией (m/V)
n n0 + C
n0- показатель преломления среды
- экспериментально определяемый коэффициент, зависящий от рода вещества
В упрощенном виде объем есть произведение площади, S, на толщину, z
V z S
ОРХ (n - n0 ) z
При этом величина ОРХ пропорциональна концентрации вещества, а
произведение ОРХ на площадь пропорционально количеству вещества
m
ОРХ C z ОРХ C zS V m
V
– зависит от показателей преломления вещества и
среды, а также от удельной плотности вещества, ρ
n - n0
11.
Основные используемые формулыПоказатель преломления связан с концентрацией
Зная объем объекта можно рассчитать
его показатель преломления
S
n
+ n0
Vгеом
Из измеряемых параметров
средней величины ОРХ и
площади можно рассчитать
количество вещества в
клетке
Стр 11 из 58
n n0 + C
Зная показатель преломления
объекта можно рассчитать его
показатель преломления
S
V
n - n0
m
n - n0
mean S
12.
Определение размеров клетокСтр 12 из 58
Один из наиболее простых способов оценки состояния эритроцитов это оценка их объема
H, мкм
Определение высоты и объема эритроцитов при помощи ЛИМ
Hмакс
0
Hмакс— максимальное значение
высоты объекта
Hсреднее— среднее значение высоты,
определяемое как сумма высот всех
точек объекта, деленное на их
количество.
Фазовый объем определяется как произведение средней высоты
объекта на его площадь.
Фазовый объем, пропорционален фазовой высоте и, соответственно,
пропорционален изменению как геометрических изменений клетки, так и
изменению ее внутренних свойств, выражающихся в изменении
показателя преломления клетки
13.
Стр 13 из 58Определение размеров клеток
Определение площади объектов
Самый простой и используемый способ оценить площадь
объектов это вычислять их, используя фоновое значение.
Каждый объект, представляется как “остров”, окруженный
“морем”, т.е. участками изображения, имеющего фоновое
значение (или как “озеро”, окруженное “сушей”, в случае пор).
Изменение фонового значения приводит к
значительным изменениям площади объектов.
H, нм
100
а
50
0
б
в
в
б
а
H=-20 нм
H= 0 нм
H= 5 нм
14.
Какие характеристики эритроцитовможно измерить с помощью ЛИМ
Стр 14 из 58
Оценка формы
а) стоматоцит з-го порядка;
б) стоматоцит 2-го порядка
в) стоматоцит 1-го порядка;
г) дискоцит;
д) эхиноцит 1-го порядка;
е) эхиноцит 2-го порядка;
ж) эхиноцит 3-го порядка
морфологический индекс
Каждой клетке присваивался определенный балл в соответствии с ее формой.
Стоматоцитам третьего типа присваивалось значение -3, второго -2, первого -1, дискоцитам 0, эхиноцитам первого типа +1, второго +2,
третьего +3.
Морфологический индекс определялся как отношение суммы баллов, характеризующих клетки, деленной на общее количество клеток
Площадь фазового изображения эритроцитов –
экспериментально измеряемый параметр,
достоверное различие площадей эритроцитов может свидетельствовать об изменении характеристик их мембран;
среднее ОРХ клетки – рассчитывалось как среднее арифметическое всех значений ОРХ, входящих в клетку,
зависит от толщины клетки и количества вещества (гемоглобина), входящего в эритроцит, произведение площади на
среднее значение ОРХ пропорционально содержанию гемоглобина в эритроците;
содержание гемоглобина – расчетная величина, для каждой клетки определяется как произведение среднего
ОРХ на площадь эрироцита, а также константы, зависящих от молекулярных характеристик гемоглобина.
Содержание гемоглобина оценивалось по формуле:
mHb
Hb
khem - k0
OPDmean S
S- площадь эритроцита, k0- показатель преломления среды (при использовании смеси
глицерин вода он составлял 1,40), k0- показатель преломления гемоглобина (принимался
равным 1,615), Hb- удельная плотность гемоглобина, принимается равной 1,36 г/см 3;
15. Заключение
Стр 15 из 58Заключение
Таким образом, полученные результаты позволяют
сделать вывод, что метод ЛИМ является эффективным и
мощным средством, позволяющим не только получать
изображения клеток с высоким разрешением, но и в ряде
случаев количественно оценивать высоту, площадь,
объем и содержание вещества в клетках. Полученные
данные могут быть использованы для выявления
наличия агрегации клеток и точного определения формы
клеток. Используя дополнительные методы определения
объема можно определять коэффициент преломления
(концентрацию вещества) клеток, который может давать
дополнительную информацию об изменениях,
происходящих в клетке при различных воздействиях на
нее
16.
Стр 16 из 58Обработка данных
Обработка изображений
Вычитание фоновой плоскости
Фильтрация случайных помех при помощи различных фильтров
Определение размеров клеток
Статистическая обработка
Описательная статистика
Дескриптивная статистика
И много чего еще
17.
Программы для обработки изображенийСтр 17 из 58
FIJI (ImageJ)
Gwiddion
Femtoskan
SPIP
Продукция компании Мекос
Семейство программ Image Pro Plus
Metamorph
И др.
18.
Стр 18 из 58Обработка изображений
вычитание фоновой плоскости
Данная процедура позволяет устранить дефекты, обусловленные
следующими причинами
Постоянная
составляющая
Постоянный наклон
Обусловлена наличием:
Жидкости ячейки, обладающей
конечной толщиной,
заполненной жидкостью с
определенным показателем
преломления
Z
1
N2
∑Z
ij
•неровностью подложки
•неточной установки образца
относительно луча света
Обусловлен наличием:
•Неравномерности освещения
Z
Удаляется из изображения путем
вычитания постоянного наклона.
Удаляется из кадра
путем вычитания
Z' ij Z ij - Z
Обусловлен наличием:
Искажения, связанные с
неравномерностью
освещения
ij
Для этого находится
аппроксимирующая плоскость,
которая вычитается из плоскости
фазового изображения
Z
Y
X
Y
X
Процедура позволяет увеличить точность и улучшить детализацию изображений
19.
Стр 19 из 58Обработка изображений
Фильтрация случайных помех при помощи различных фильтров
Случайные помехи обусловлены следующими причинами
Шумы
аппаратуры
Дефекты на матрице
Внешние акустические
шумы и вибрации
Устраняется из изображения в результате применения различных фильтров
Участок
применения
фильтра
расположение элементов в
неотсортированном массиве
(синим цветом помечен
центральный элемент)
Процедура позволяет увеличить точность изображений
расположение элементов в
отсортированном массиве
(новый центральный элемент
помечен красным цветом)
20.
Стр 20 из 58Определение размеров клеток
Определение границ объектов
Пороговый алгоритм и его варианты
Самый простой и используемый способ оценить площадь объектов
это вычислять их, используя фоновое значение. Каждый объект,
представляется как “остров”, окруженный “морем”, т.е. участками
изображения, имеющего фоновое значение (или как “озеро”,
окруженное “сушей”, в случае пор).
Изменение фонового значения приводит к
значительным изменениям площади объектов.
H, нм
100
а
50
0
б
в
в
б
а
H=-20 нм
Алгоритм водораздела и его варианты
H= 0 нм
H= 5 нм
21.
Статистическая обработкаСтр 21 из 58
В последние годы требования к статистике при публикации результатов
ужесточились, не все российские ученые адаптировались к этим требованиям
К счастью появилось большое количество программ, в которых все считают
за вас, даже указывая на применимость или неприменимость метода.
Для исследователя сейчас важно знать терминологию, чтобы нажать
правильную кнопку (границы применимости методов тоже – увы,
автоматический режим не всегда работает)
Программы, где можно достаточно просто обработать и
представить свои данные
(хотя статистические модули есть во всех уважающих себя программах)
GraphPad Prism 7.04, GraphPad Software – проста, есть необходимый минимум
и не только, есть подробный хелп по программе и статистике на сайте
Microcal Origin Pro 2018 – мощная программа для представления и обработки
данных, есть подробный и понятный хелп
StatSoft, Inc. STATISTICA 10 – программа для статистических расчетов, неплохая
подборка материалов о статистике на сайте
MedCalc Statistical Software version 15.8 – неплохая небольшая
программа для статистических расчетов
22.
Статистическая обработкаСтр 22 из 58
Как правильно обработать статистические данные?
однозначного ответа нет, зависит от формы проведения
эксперимента, количества экспериментальных данных,
приборной погрешности и т.д.
Ниже приведены некоторые соображения по обработке
статистических результатов применительно к конкретной
задаче практикума по микроскопии
Тем не менее подобный подход применим к обработке
любых микроскопических данных
23.
Стр 23 из 58Определение размеров клеток
Что можно посчитать?
H, мкм
Да что угодно
Hмакс
0
Площадь фазового изображения эритроцитов;
среднее ОРХ клетки;
Hb
содержание гемоглобина: m k - k OPDmean S
s
0
количественные
качественные
порядковые
(оценка их доли)
24.
Стр 24 из 58Статистическая обработка
Схема построения эксперимента
Сравниваем между собой (или с
референсными значениями две
или несколько проб
Изменение пробы во времени
0
1
2
Количество объектов
Используется нормальное
распределение или нет
10
N
Распределение
объектов по размерам
5
0
20
40
60
80
100
25.
Стр 25 из 58Описательная (дескриптивная) статистика
Показатели положения экспериментальных данных
на числовой оси
показатель центральной тенденции*,
Среднее арифметическое
Медиана
Мода
полученный делением суммы всех значений
данных на число этих данных. Адекватно если
у нас нормальное (!) распределение
центральное значение признака в последовательном ряду всех
полученных значений (половина объектов больше, а половина меньше).
Как вариант: медиана - 50-м перцентиль (0,5-квантиль) или второй
квартиль выборки или распределения.
Медиана вместе с квартилями используется для представления
дискретных или количественных переменных при ненормальном
распределении.
наиболее часто встречаемое значение в выборке.
В некоторых случаях может быть две или более мод, что может
свидетельствовать о наличии двух (нескольких ) самостоятельных групп.
Максимальное и минимальное значение
26.
Описательная (дескриптивная) статистикаСтр 26 из 58показатели разброса, описывающие степень
разброса данных
Доверительный
интервал
В биологических исследованиях значения параметра достаточно
сильно варьирует, поэтому наиболее оптимальным описанием
величины является диапазон, в который укладывается большинство
значений исследуемого признака, т.е. ширина распределения.
95% доверительный интервал.
Стандартное
отклонение s
Стандартная
ошибка среднего
Xi - X
n -1
sX
Квантили, квартили
(интерквартильный
размах)
s
n
2
Только для нормального распределения!
Оценивает широту распределения, характеризует
разброс данных
Только для нормального распределения!
Характеризует точность нахождения среднего (если
ошибка обусловлена случайными причинами)
Квантили характеризует собой частоту попадания значений
переменной в определённые интервалы. Чаще всего
используется разделение на 4 интервала (25%, 50%, 75%).
При разделении на четыре квантиля (именуемых квартилями) для предоставления
оценки центральной тенденции, ширины и асимметрии распределения
результатов достаточно трёх чисел: нижний квартиль (попало 25% самых
маленьких значений), 50% квартиль, который соответствует медиане (попало 50%
значений), и верхний квартиль (попало 75% самых маленьких значений).
Интерквантильный размах - разность между верхней и нижней квартилью.
26
из 28
27.
Описательная (дескриптивная) статистикаСтр 27 из 58OPD, nm
130
120
110
108.786(95%)
100
100.263(75%)
93.712(50%)
90
87.444(25%)
80
77.907(5%)
70
B
28.
Описательная (дескриптивная) статистикаСтр 28 из 58OPD, nm
130
120
110
108.786(95%)
103.56414(1 SD)
100
100.263(75%)
93.712(50%)
90
87.444(25%)
84.03915(-1 SD)
80
77.907(5%)
70
B
29.
Стр 29 из 58Описательная (дескриптивная) статистика
Графическое представление результатов
Количественные данные
Диаграмма размаха
(Ящик с усами)
ус
800
800
700
650
µkg/mL
TAC, µmol/L
750
600
400
Верхняя квартиль
600
среднее
550
медиана
500
450
*
P3=0.0205
200
before rGH
treatment
after rGH
treatment
Нижняя квартиль
400
350
300
control
before
Гистограмма
D
B
0,8
доля
10
N
0,6
29,79%
0,4
5
0,2
0,0
0
60
80
1
2
3
38,7%
31,51%
1,0
40
after
Качественные данные
Диаграммы
Количественные данные
20
ящик
100
1
2
группа
3
30.
Статистическая обработкаСтр 30 из 58
Если у нас две выборки!
Оценка достоверности отличий между популяциями
Для этого существуют методы оценки статистической значимости отличий
(дисперсионный анализ)
Принцип построения таких методов
Формулировка 0-вой гипотезы (полученные различия случайны или не случайны)
Определяем вероятность получить наблюдаемые различия при условии справедливости
нулевой гипотезы
Есть параметрические (основанные на нормальном распределении –
оценке дисперсии) и непараметрические
Т.е. если наша выборка является нормальным распределением – используем
параметрические методы, если нет - непараметрические
Наиболее часто используемые критерии
параметрический – парный (двувыборочный) T-тест Стьюдента (с мод.)
Непараметрический – Манна-Уитни U тест
Бывают для зависимых и независимых выборок
Параметрический – Т-тест (для зависимых и независимых выборок)
Непараметрический – Манн-Уитни (для независимых) Вилкоксона (для зависимых)
31.
Стр 31 из 58Статистическая обработка
Статистическая обработка измеренного параметра
Определяем нормальное ли у нас распределение
да
Находим среднее, стандартное
отклонение и стандартную
ошибку среднего
нет
Находим медиану и квартили
Строим гистограмму и корректируем данные (если есть основания)
Выбираем критерий и определяем достоверно
ли отличаются пробы друг от друга
Здесь не упоминается метрология и основы обработки сигнала
32.
Стр 32 из 58ПРИМЕРЫ
Нейробластулы (стволовые клетки в культуре)
Ядерные эритроциты лягушки
Тромбоциты человека
Тучные клетки мыши
Эритроциты
Нервное волокно
Визуализация коллоидов
Сравнение с атомно-силовой микроскопией
33.
Нейробластулы (стволовые клетки вкультуре)
H, нм
150
100
50
0
0
20 мкм
20
40
60
мкм
20 мкм
Стр 33 из 58
34.
Стр 34 из 58Тромбоциты человека
H, нм
80
60
40
20
0
0
10 мкм
20 мкм
20
40
60
мкм
35.
H, мкмЭритроциты лягушки
Стр 35 из 58
200
100
0
0
10
20
30
10 мкм
мкм
20 мкм
36.
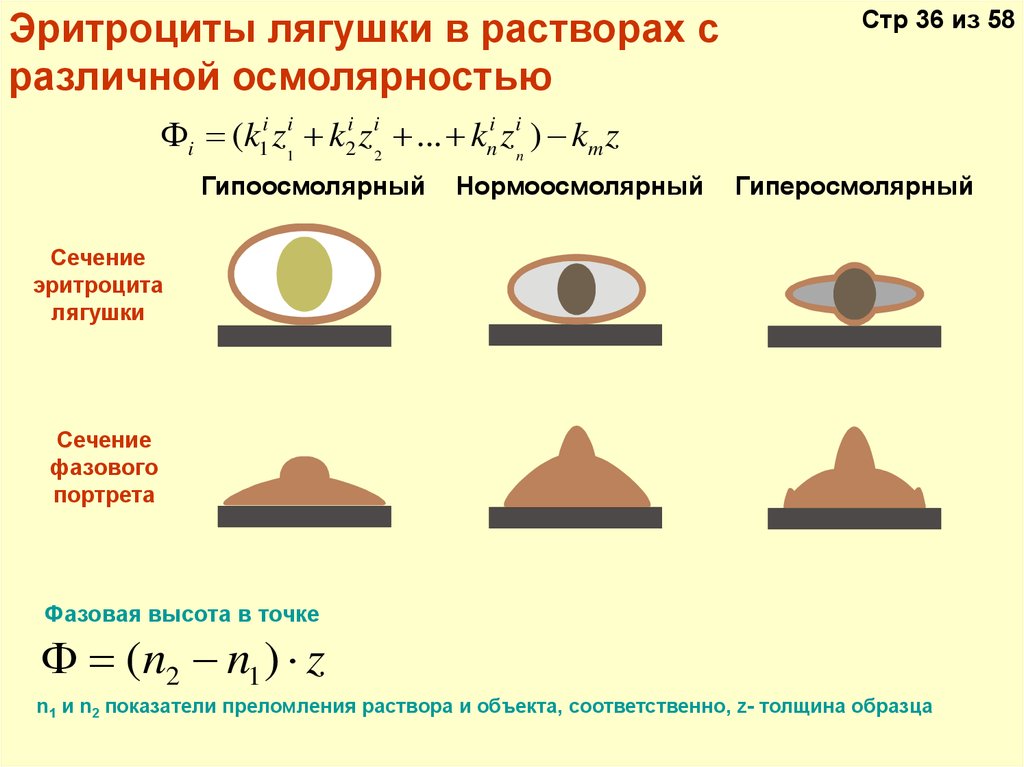
Эритроциты лягушки в растворах сразличной осмолярностью
Стр 36 из 58
i (k1i z1i + k2i z i2 + ... + kni z in ) - km z
Гипоосмолярный
Нормоосмолярный
Гиперосмолярный
Сечение
эритроцита
лягушки
Сечение
фазового
портрета
Фазовая высота в точке
(n2 - n1 ) z
n1 и n2 показатели преломления раствора и объекта, соответственно, z- толщина образца
37.
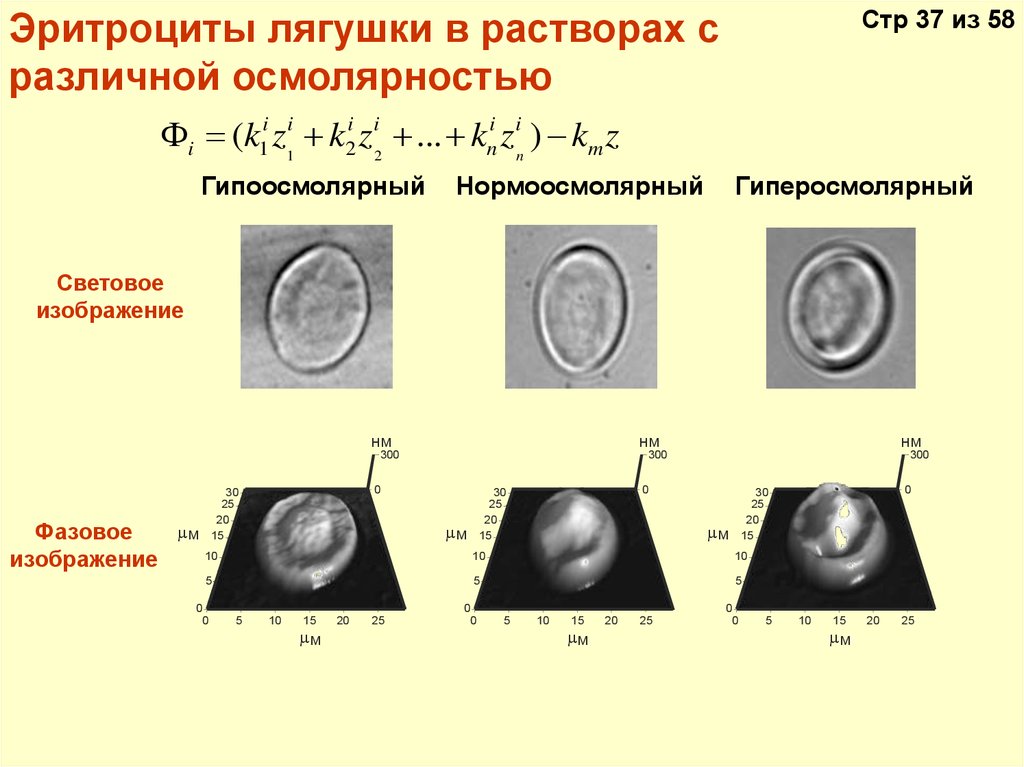
Стр 37 из 58Эритроциты лягушки в растворах с
различной осмолярностью
i (k1i z1i + k2i z i2 + ... + kni z in ) - km z
Гипоосмолярный
Нормоосмолярный
Гиперосмолярный
Световое
изображение
нм
нм
300
Фазовое
изображение
0
30
25
20
15
mм
нм
300
0
30
25
20
15
mм
300
mм
10
10
10
5
5
5
0
0
5
10
15
mм
20
25
0
0
5
10
15
mм
20
25
0
30
25
20
15
0
0
5
10
15
mм
20
25
38.
Эритроциты лягушкиАпоптоз эритроцита лягушки
Стр 38 из 58
39.
Тучные клетки мышиДействие ионофора
Приводит к выбросу гистамина
3
10 мкм
3
V-V0, мкм
2
70 мин
объема менее 10%
Площадь, mм высота, нм высота, нм
0 мин
V0= 356 мкм , общее изменение
10 мкм
20
0
средняя высота
5
0
максимальная высота
5
0
200
100
0
0
10 20 30 40 50 60 70
время, мин
Стр 39 из 58
Изменение во времени
40.
Стр 40 из 58ЭРИТРОЦИТЫ
41.
Стр 41 из 58Эритроцит,
размещенный на отражающей подложке в физиологическом растворе,
является характерным примером измерения прозрачного образца. Содержимое
эритроцита представляет собой достаточно однородную массу, поэтому высоту
(толщину) рельефа эритроцита, z можно оценивать, используя формулу:
z
n2 - n1
n1 и n2 – показатели преломления среды, напр.
плазмы, (1,335) и эритроцита (1,405), соответственно
Параметры эритроцита хорошо изучены, с ним достаточно легко
работать, что делает данную клетку удобным модельным объектов для
разработки приемов и методик работы с клетками
Кроме этого оценка состояния эритроцитов является диагностическим
критерием при оценке ряда патологий
42.
Стр 42 из 58Оценка формы
Пример изображения различных форм эритроцитов
60
50
Y, м
км
40
30
20
10
Z, мкм
4
2
0
0
0
20 mm
дискоциты
стоматоцит
“пачка” из двух клеток
“пачка” из трех клеток
эхиноцит
10
20
30
X, мкм
40
50
60
43.
Стр 43 из 58Оценка формы
Особенности отображения эритроцитов при
помощи ЛИМ
дискоцит
стоматоцит
-3
-2
Сечение
Реального объекта
-1
0
эхиноцит
+1
+2
+3
Сечение
фазового портрета
44.
Стр 44 из 58Оценка формы
Превращения эритроцитов при изменении рН
рН
4.5
5.5
7.4
8.4
видео
изображение
nm
nm
nm
250
250
250
20
20
0
15
15
Фазовое
изображение
mm
20
0
mm
10
mm
10
0
5
10
mm
15
20
0
5
10
mm
15
20
mm
10
0
0
0
15
5
0
0
250
20
0
15
5
5
nm
10
5
0
5
10
mm
15
20
0
5
10
mm
15
20
45.
Стр 45 из 58Оценка формы
Превращения эритроцитов при изменении осмолярности
250
Осмолярность, мОсм
330
500
700
видео
изображение
20
Фазовое
изображение
nm
nm
250
250
20
0
15
mm
mm
5
20
0
10
mm
15
20
mm
10
0
0
250
20
0
15
5
5
nm
250
15
10
0
0
nm
15
mm
10
5
5
10
mm
15
20
0
0
0
10
5
5
10
mm
15
20
0
0
5
10
mm
15
20
46.
Стр 46 из 58Определение объема
Определив толщину эритроцитов, z, по формуле:
Можно рассчитать объем клетки (фазовый объем,
Vphase), как произведение площади клетки, S, на ее
толщину:
V phase zS
или
Vphase
z
n2 - n1
S
n2 - n1
Таким образом, фазовый объем зависит от площади и
показателей преломления среды и эритроцита
Показатель преломления может меняться при изменении
состояния эритроцита
В этой ситуации нам необходимо оценивать показатель
преломления эритроцитов либо независимыми методами либо
при помощи специализированных методик или рассчитав
показатель преломления из известной величины объема, что
наиболее удобно в случае эритроцитов.
47.
Стр 47 из 58Определение объема
Изменение состояния эритроцитов при изменении
осмолярности и рН раствора
средний объем клеток
фазовый объем клеток
150
Объем, мкм3
Объем, мкм3
150
100
50
100
50
0
0
4
5
6
7
pH
8
9
10
200
400
600
800
1000
Осмолярность, мосм/литр
При нормальной осмолярности и рН значения фазового и
геометрического объема совпадают.
При изменении осмолярности наблюдаются значительные различия
между величинами этих объемов
48.
Определение показателя преломленияnэрит
Стр 48 из 58
S
+ n раст
Vгем
Изменение объема клеток приводит к изменению концентрации
гемоглобина внутри клетки, что в свою очередь сказывается на
показателе преломления эритроцита
Кроме того изменение показателя преломления может быть
обусловлена и другими причинами, не связанными с изменением
концентрации гемоглобина
(изменение свойств мембраны и гемоглобина)
49.
Определение содержания гемоглобинаРавенство показателей преломления в
данном случае позволяет говорить о том
что параметр S/V пропорционален
концентрации гемоглобина в эритроците
Стр 49 из 58
S
nгем - n раст x
Vгем
Объемную долю гемоглобина можно пересчитать
в объемную концентрацию (г/см3), CV, используя
удельную плотность гемоглобина Hb:
mHb
CV
x
HbVгем Hb
VHb и mHb – объем и масса гемоглобина в эритроците, Величина Hb,
принимается равной 1,36 г/см3
CV
Hb
S
nгем - nраст Vгем
mHb
n
гем
Hb
- n раст
S
Фазовый объем пропорционален содержанию гемоглобина в эритроците
50.
Определение содержания гемоглобинаСтр 50 из 58
содержание гемоглобина, пг
Изменение формы эритроцитов
35
30
25
20
15
10
5
0
0
5
10
время, мин
15
Полученные результаты свидетельствуют о возможности
использования метода ЛИМ для оценки содержания количества
гемоглобина в эритроците и построения распределения содержания
количества гемоглобина в популяции
51.
Нервное волокно лягушкиH, нм
400
1
200
0
0
H, нм
Стр 51 из 58
мкм
10
400
2
200
0
0
мкм
10
1
2
10 мкм
10 мкм
52.
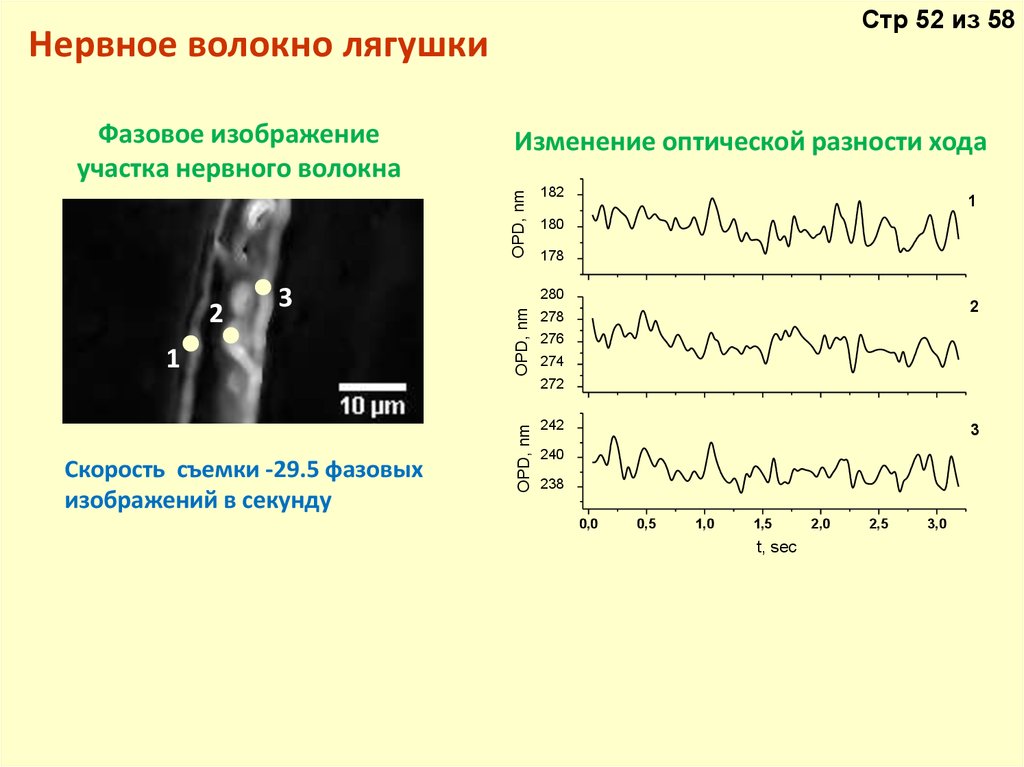
Стр 52 из 58Нервное волокно лягушки
Изменение оптической разности хода
OPD, nm
Фазовое изображение
участка нервного волокна
Скорость съемки -29.5 фазовых
изображений в секунду
178
280
OPD, nm
1
1
180
278
OPD, nm
2
3
182
242
2
276
274
272
3
240
238
0,0
0,5
1,0
1,5
t, sec
2,0
2,5
3,0
53.
Стр 53 из 58Визуализация
коллоидов
54.
Коллоиды серебра в физиологическом раствореСтр 54 из 58
55.
Стр 55 из 58Нейроны прудовика
Нейроны прудовика в
физиологическом растворе
Нейроны прудовика в
физиологическом растворе
+ коллоиды серебра
Фазовое изображение
Световое изображение
56.
Эритроциты крысы физиологическом растворе+ коллоиды серебра
Стр 56 из 58
Световое изображение
Фазовое изображение
57.
Стр 57 из 58Сравнение
с атомно-силовой
микроскопией
58.
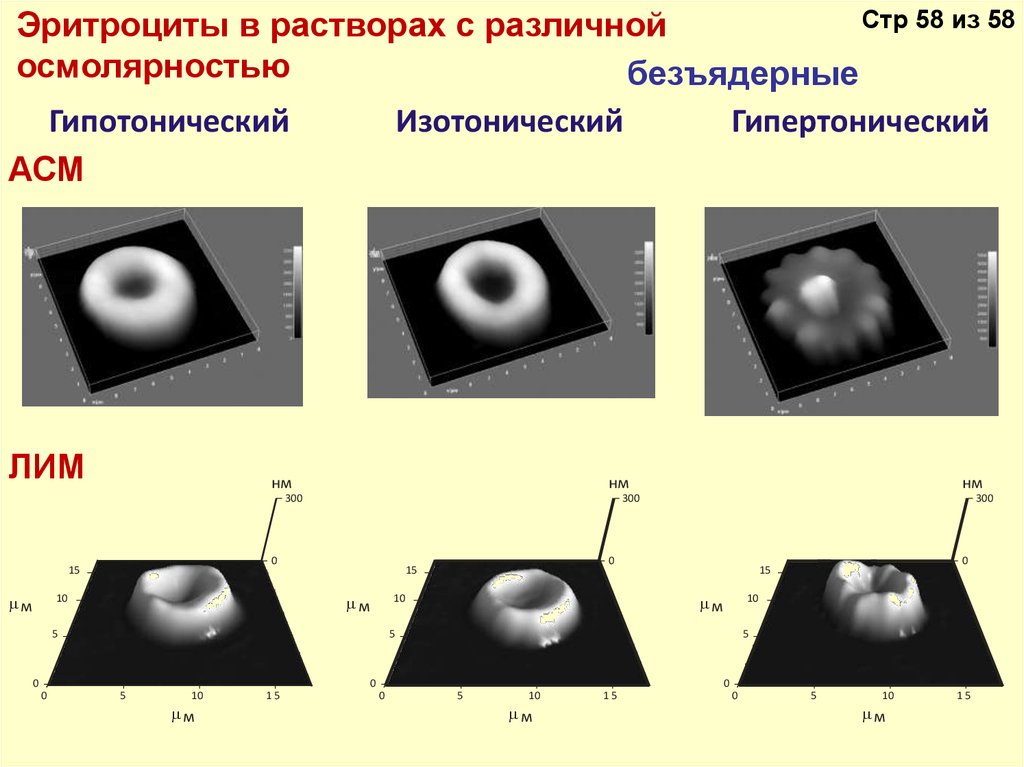
Стр 58 из 58Эритроциты в растворах с различной
осмолярностью
безъядерные
Гипотонический
АСМ
ЛИМ
Изотонический
нм
нм
300
mм
5
0
0
10
5
0
5
10
mм
15
0
15
mм
10
5
300
0
15
mм
10
нм
300
0
15
Гипертонический
0
0
5
10
mм
15
0
5
10
mм
15
59.
Стр 59 из 58Эритроциты в растворах с различной
осмолярностью
ядерные
Гипотонический
АСМ
ЛИМ
нм
Гипертонический
нм
300
нм
300
0
30
25
20
15
mм
Изотонический
0
30
25
20
15
mм
300
mм
10
10
10
5
5
5
0
0
5
10
15
mм
20
25
0
0
5
10
15
mм
20
25
0
30
25
20
15
0
0
5
10
15
mм
20
25
60.
Сравнение ЛИМ и АСМпри работе с клетками
Достоинства ЛИМ
-простая подготовка препаратов
-легко работать с живыми клетками
-высокая скорость получения изображений
-ме́ньшая стоимость прибора
Достоинства АСМ
-возможность напрямую измерять
геометрические размеры клеток
Стр 60 из 58
























































 Биология
Биология








