Похожие презентации:
Углеводы. Классификация
1. УГЛЕВОДЫ
2.
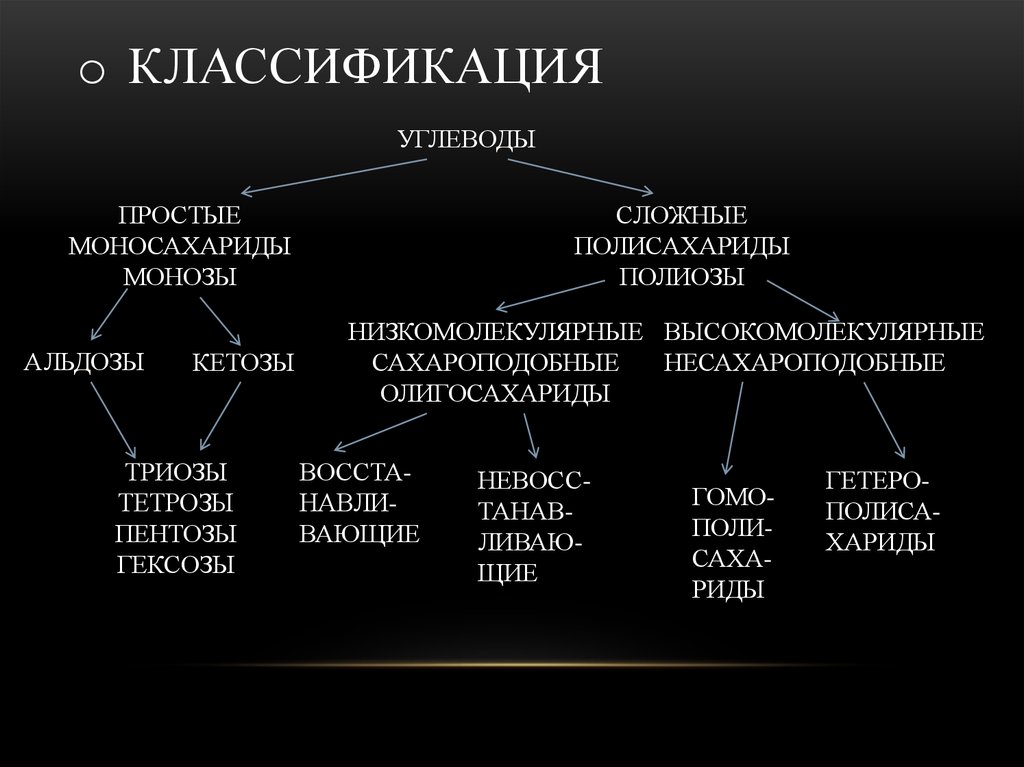
3. КЛАССИФИКАЦИЯ
o КЛАССИФИКАЦИЯУГЛЕВОДЫ
ПРОСТЫЕ
МОНОСАХАРИДЫ
МОНОЗЫ
АЛЬДОЗЫ
КЕТОЗЫ
ТРИОЗЫ
ТЕТРОЗЫ
ПЕНТОЗЫ
ГЕКСОЗЫ
СЛОЖНЫЕ
ПОЛИСАХАРИДЫ
ПОЛИОЗЫ
НИЗКОМОЛЕКУЛЯРНЫЕ ВЫСОКОМОЛЕКУЛЯРНЫЕ
САХАРОПОДОБНЫЕ
НЕСАХАРОПОДОБНЫЕ
ОЛИГОСАХАРИДЫ
ВОССТАНАВЛИВАЮЩИЕ
НЕВОССТАНАВЛИВАЮЩИЕ
ГОМОПОЛИСАХАРИДЫ
ГЕТЕРОПОЛИСАХАРИДЫ
4.
По строению моносахариды являютсяполигидроксиальдегидами и
полигидроксикетонами.
5.
АльдозыКетозы
O
тетрозы
H2 C
CH
CH
OH OH
OH
H2 C
C
H
O
пентозы
H2 C
CH
OH OH
C
CH
CH
OH
OH
H
O
гексозы
H2 C
CH
OH OH
CH
OH
CH
CH
OH
OH
C
H
CH
C
CH 2
OH OH
O
OH
CH
CH
C
CH 2
OH OH
OH
O
OH
H2 C
H2 C
CH
CH
CH
C
CH 2
OH OH
OH
OH
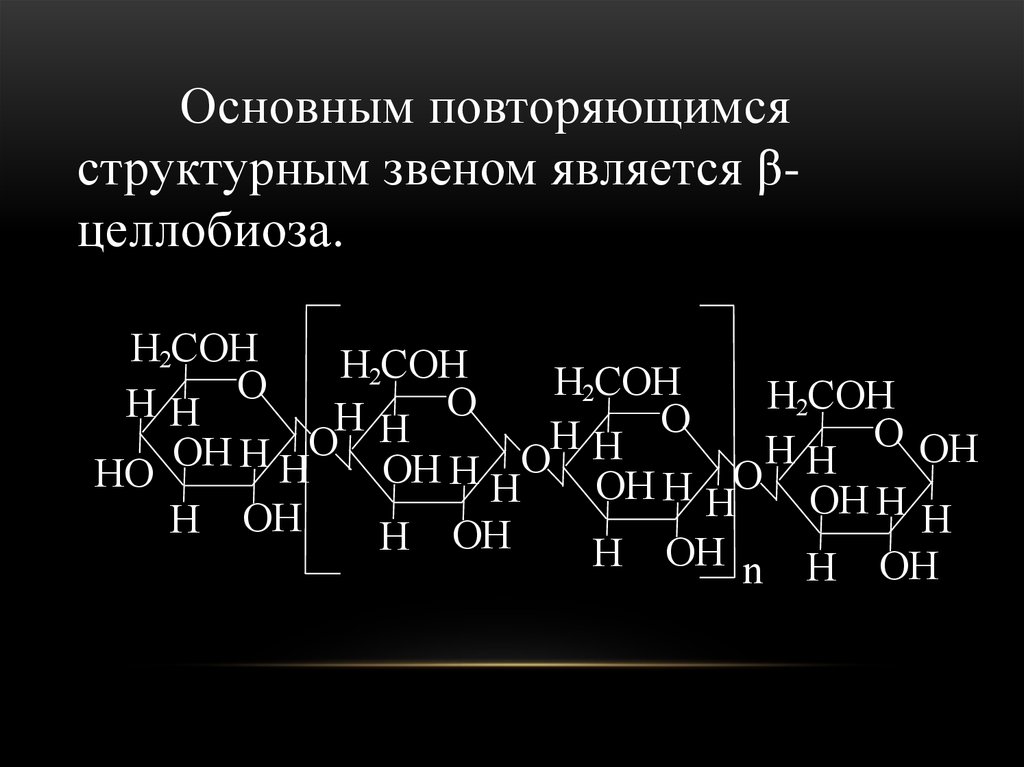
O
OH
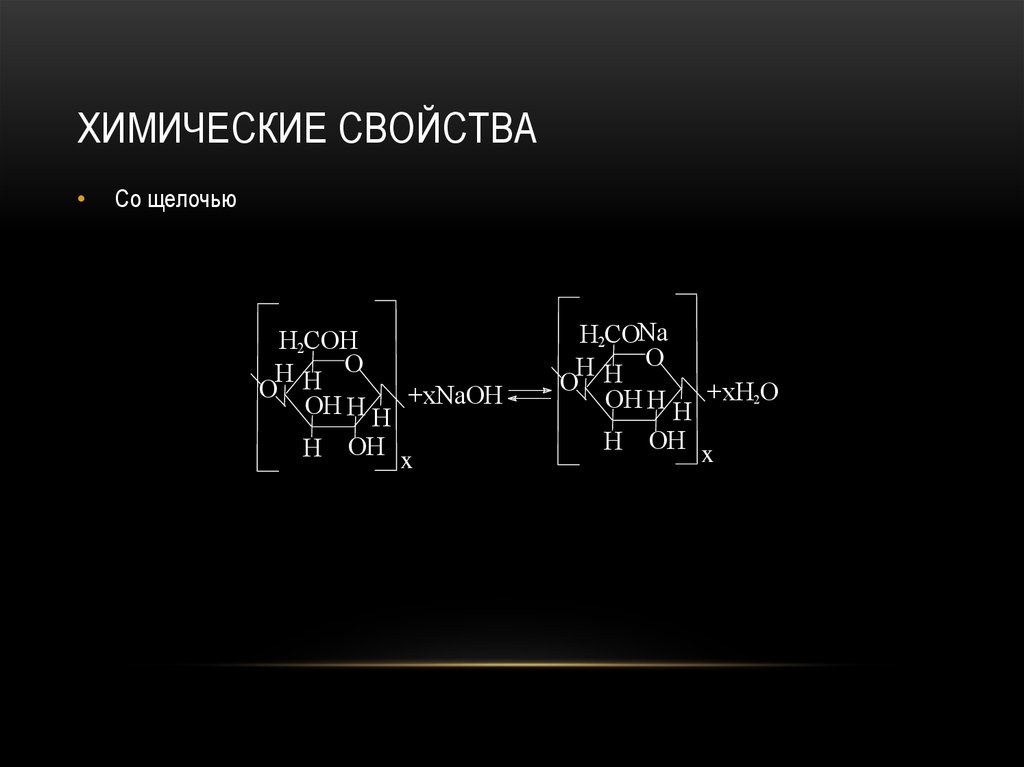
6.
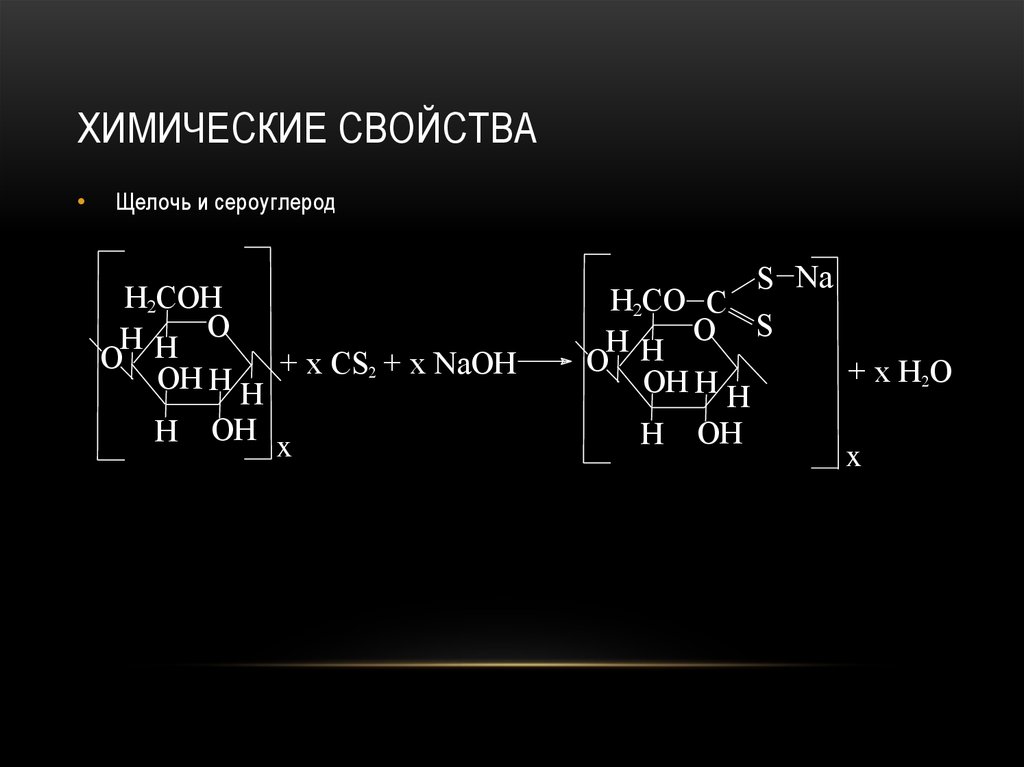
7.
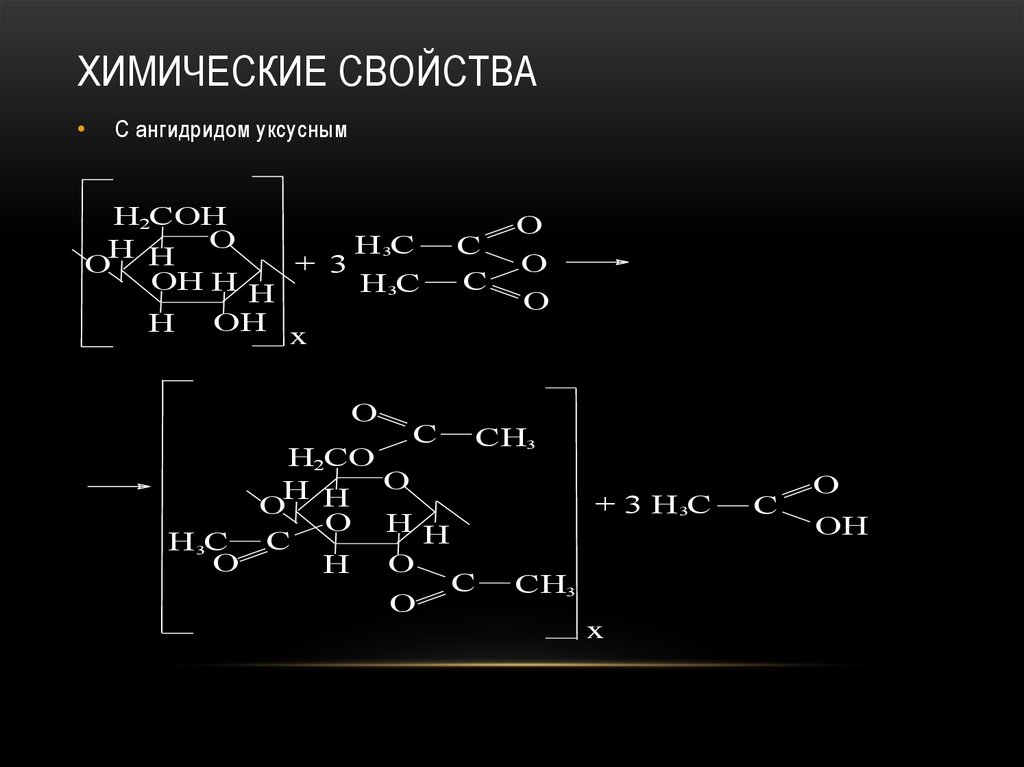
8.
Несахароподобные – высокомолекулярныеполисахариды, содержащие в молекуле от
десятков до нескольких десятков тысяч
остатков моноз, имеют ярко выраженное
кристаллическое строение, не растворимы в
воде и безвкусны.
9.
Если молекулы полисахарида состоят изостатков одного моносахарида, он является
гомополисахаридом, а если различных –
гетерополисахаридом.
10. моносахариды
МОНОСАХАРИДЫАЛЬДОЗЫ
11. Оптическая изомерия
ОПТИЧЕСКАЯ ИЗОМЕРИЯ12.
Для каждого оптическогоизомера существует один его
оптический антипод – энантиомер,
а остальные оптические изомеры
называют диастериомерами.
13.
Таким образом , две триозы составляют однупару антиподов, четыре тетрозы – две пары, восемь
пентоз – четыре пары, шестнадцать гексоз – восемь
пар антиподов, которые относят к двум рядам:
правому (D-ряд) и левому (L-ряд).
Все альдозы хорошо изучены. Одни из них
выделены из природных продуктов, другие получены
синтетически. Для всех альдоз установлены
относительные конфигурации, то есть
пространственное расположение заместителей у
асимметрических атомов относительно конфигураций
глицериновых альдегидов.
14.
Для более быстрого и удобного написанияконфигурации моноз немецкий химик-органик Эмиль
Фишер в 1891 году предложил изображать их
проекционными формулами.
HO
H
Формула Фишера для молекулы с одним
асимметрическим атомом
15.
Изображение на плоскости пространственных структурсоединений с асимметрическими атомами: при построении
формул для соединений с одним асимметрическим атомом на
плоскость проецируют модель молекулы, которую условно
располагают так, что бы асимметрический атом находился в
плоскости чертежа, заместители, расположенные слева и
справа - перед плоскостью, а заместители расположенные
вверху и внизу – за плоскостью чертежа (связи этих
заместителей с асимметрическим атомом иногда показывают
пунктирными линиями). Цепь молекулы с несколькими
асимметрическими атомами располагают в пространстве
вертикально в виде равномерно выпуклой ломаной линии,
обращенной выпуклостью к наблюдателю, причем главную
функциональную группу изображают вверху.
16.
Схема построения формулы Фишера для соединений с двумяасимметрическими атомами.
17.
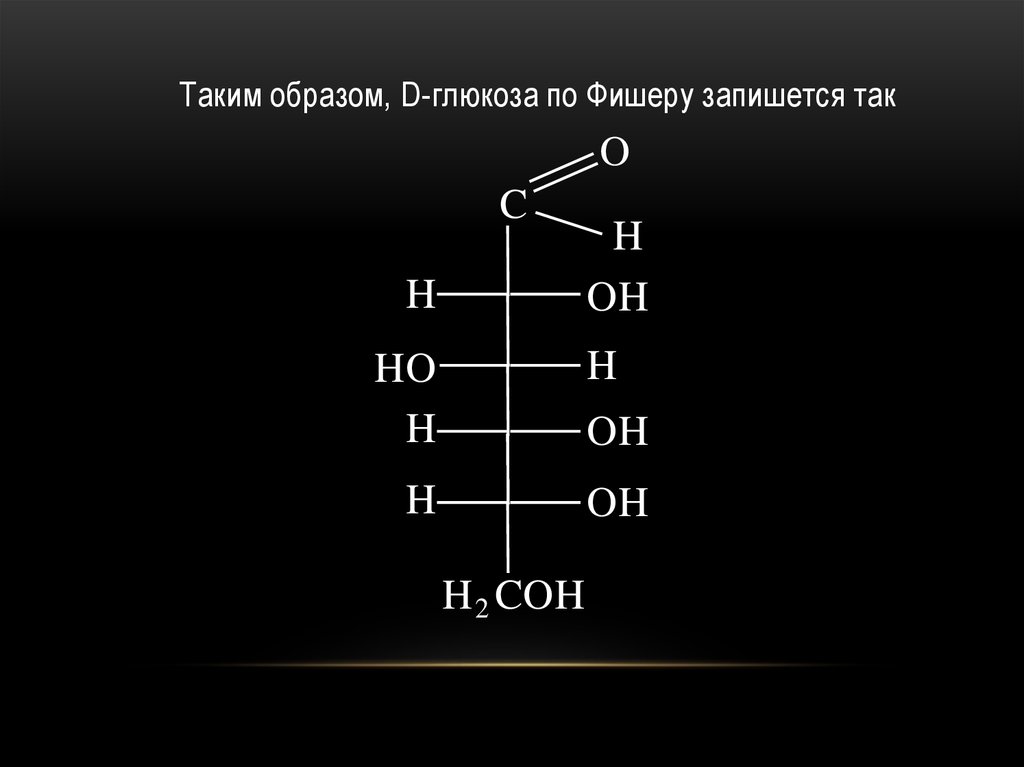
Таким образом, D-глюкоза по Фишеру запишется такO
C
H
H
OH
H
HO
H
OH
H
OH
H 2 COH
18.
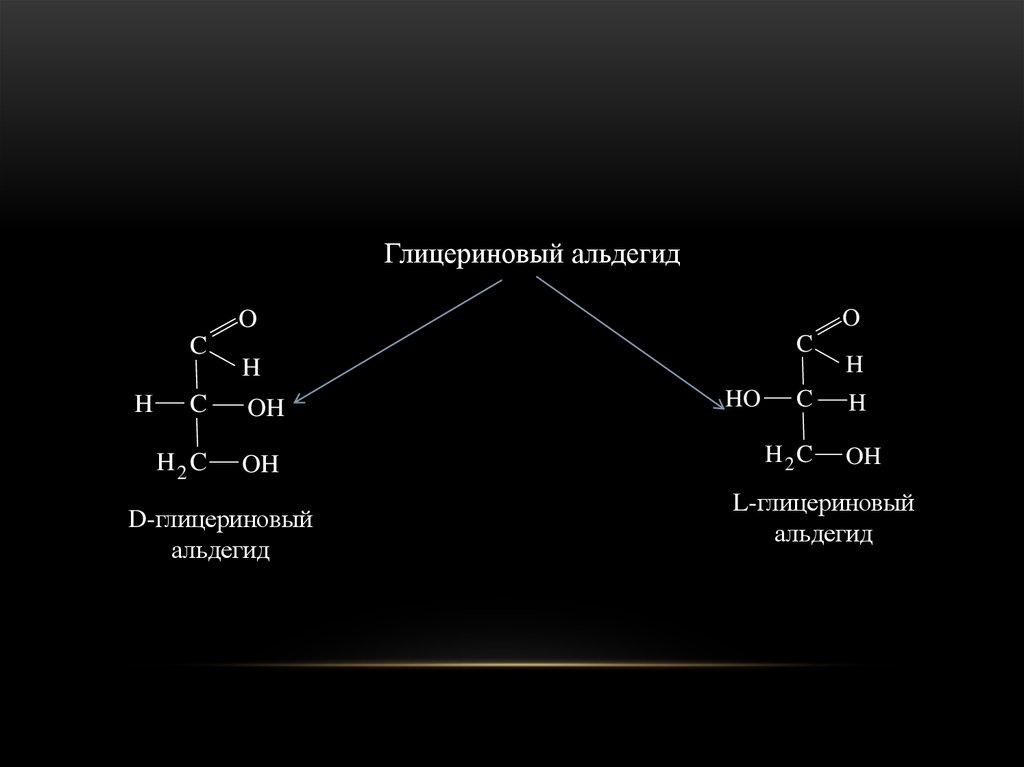
Представить себе пространственноестроение оптических изомеров альдоз удобнее
всего, если выводить их из глицеринового
альдегида, который существует в виде двух
антиподов.
19.
Глицериновый альдегидO
O
C
H
C
H
C
OH
H2 C
OH
D-глицериновый
альдегид
HO
C
H2 C
H
H
OH
L-глицериновый
альдегид
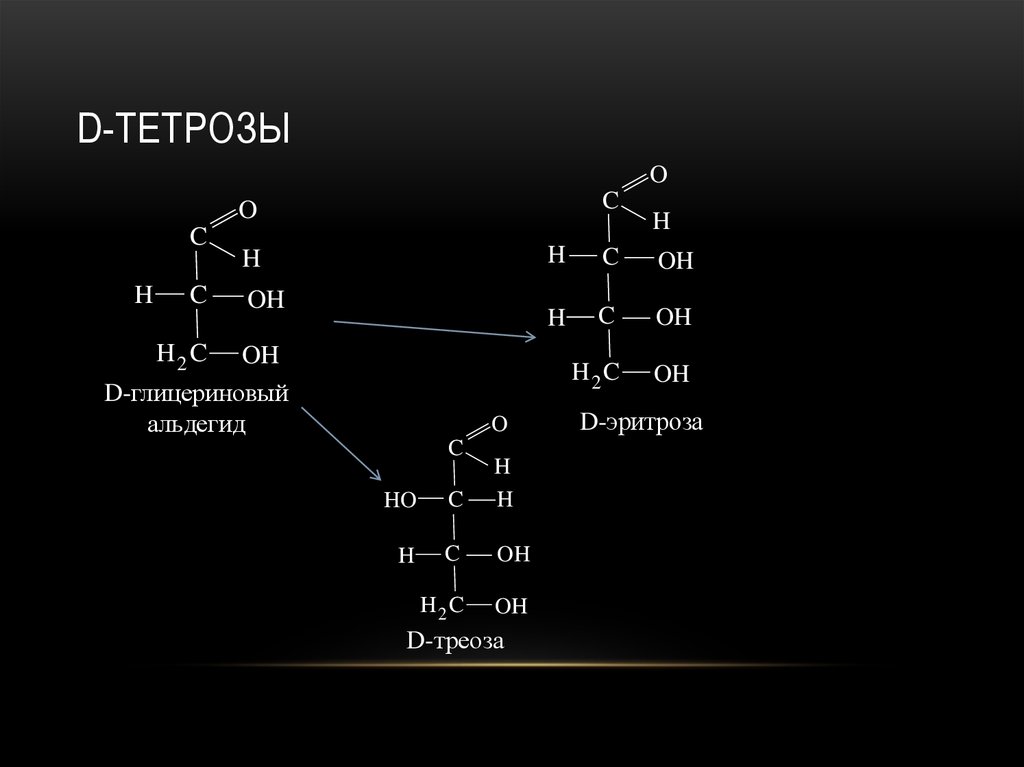
20. D-тетрозы
D-ТЕТРОЗЫO
C
O
C
H
C
H
OH
H2 C
OH
D-глицериновый
альдегид
O
C
HO
C
H
H
H
C
OH
H2 C
OH
D-треоза
H
H
C
OH
H
C
OH
H2 C
OH
D-эритроза
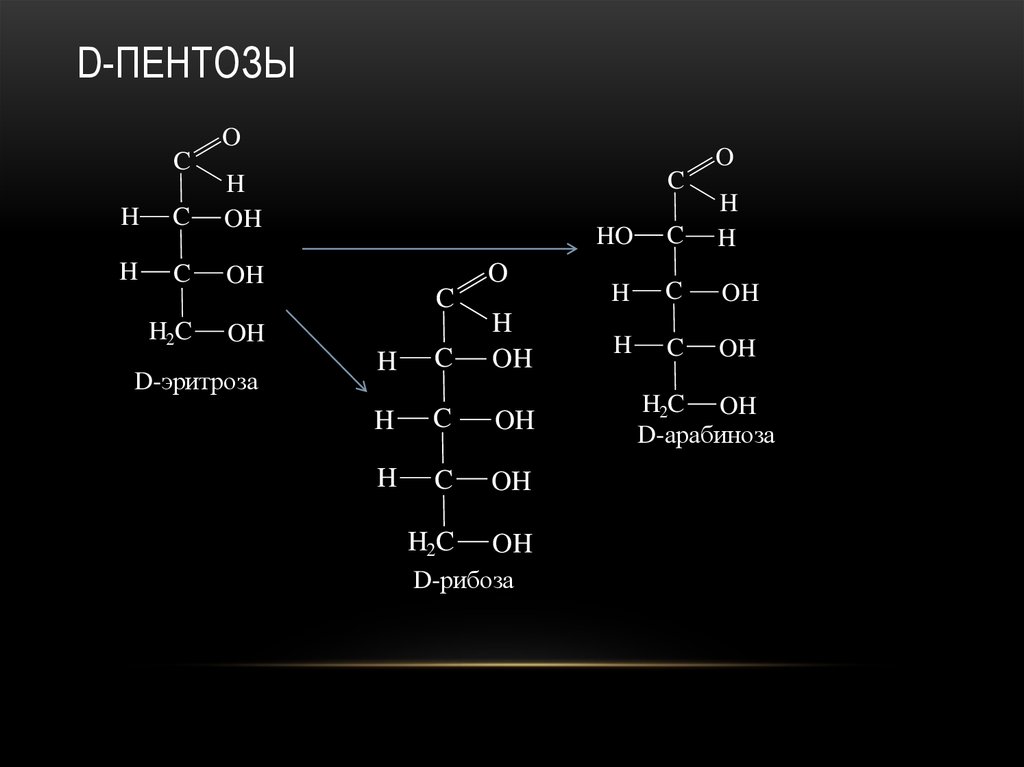
21. D-пентозы
D-ПЕНТОЗЫO
C
H
C
H
OH
H
C
OH
H2C
O
C
O
C
H
C
H
OH
H
C
OH
H
C
OH
H2C
OH
OH
D-эритроза
D-рибоза
HO
C
H
H
H
C
OH
H
C
OH
H2C OH
D-арабиноза
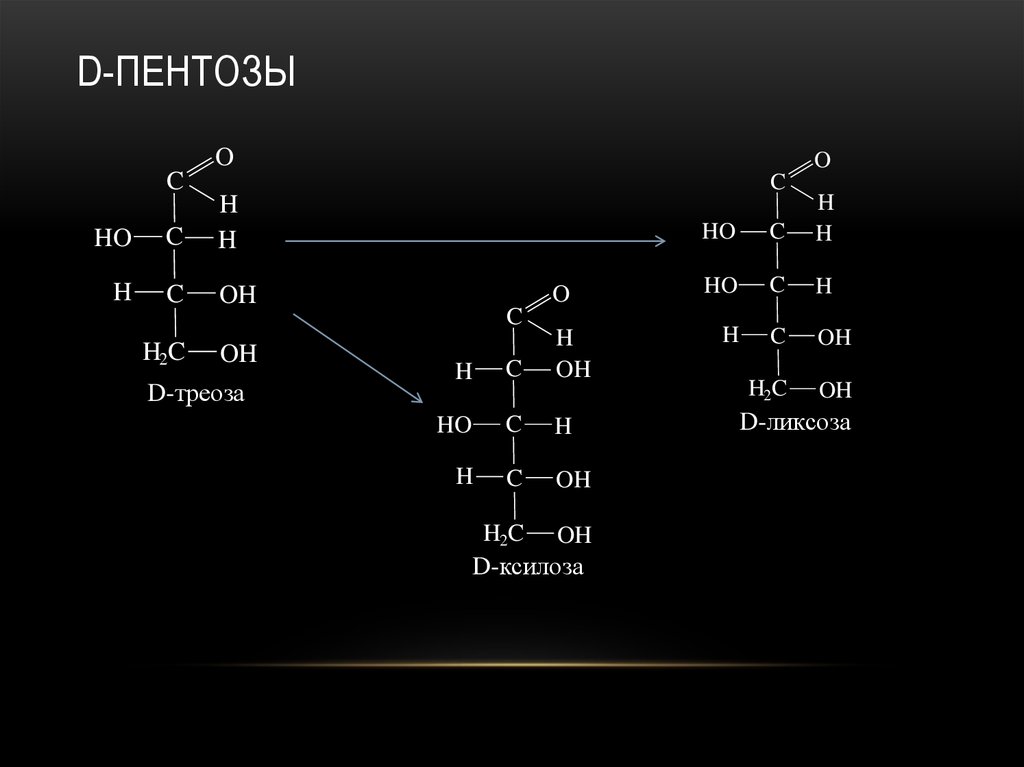
22. D-пентозы
D-ПЕНТОЗЫO
C
C
HO
C
H
H
H
C
OH
H2C
O
OH
D-треоза
O
C
H
OH
H
C
HO
C
H
H
C
OH
H2C
OH
D-ксилоза
HO
C
H
H
HO
C
H
H
C
OH
H2C
OH
D-ликсоза
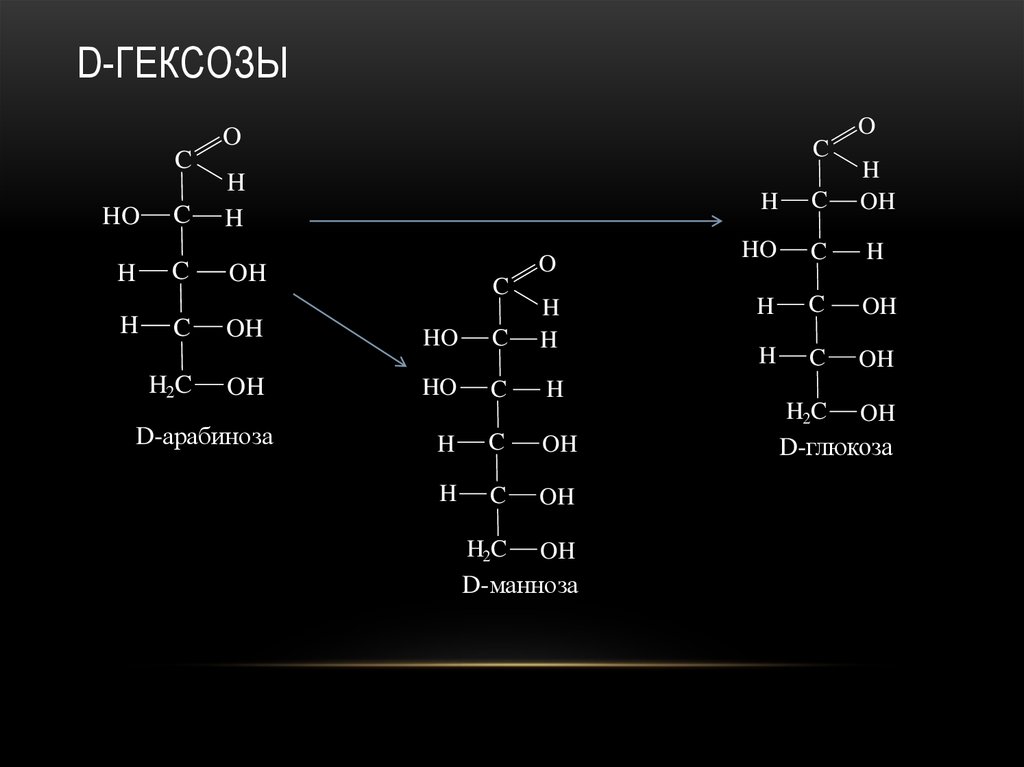
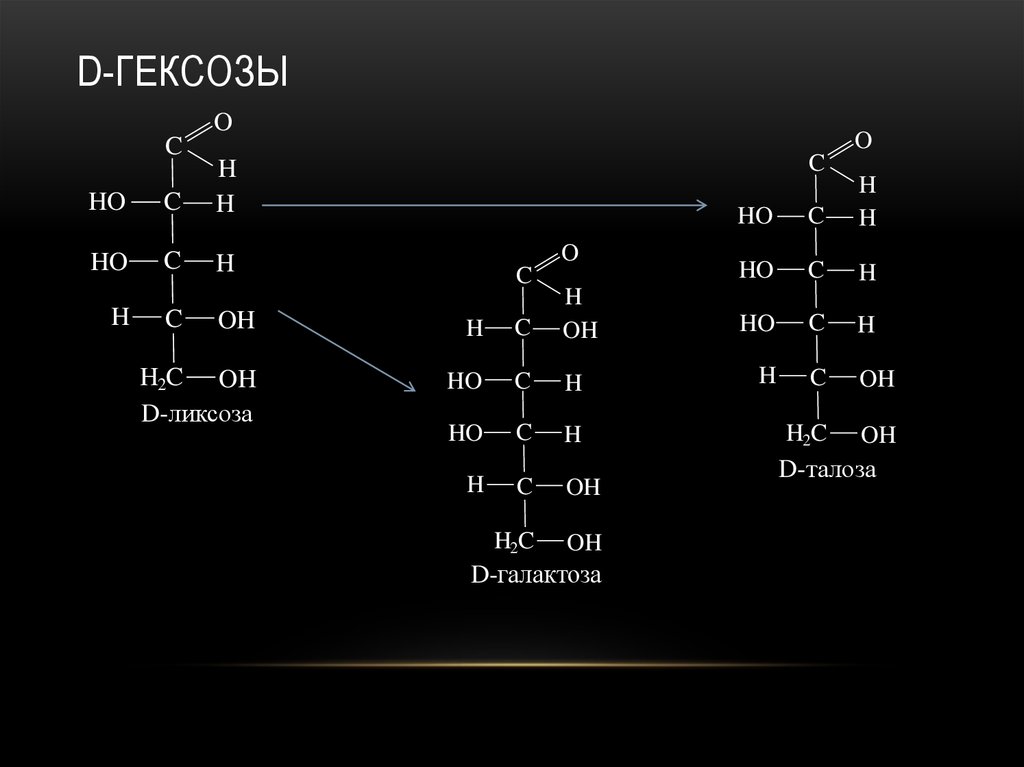
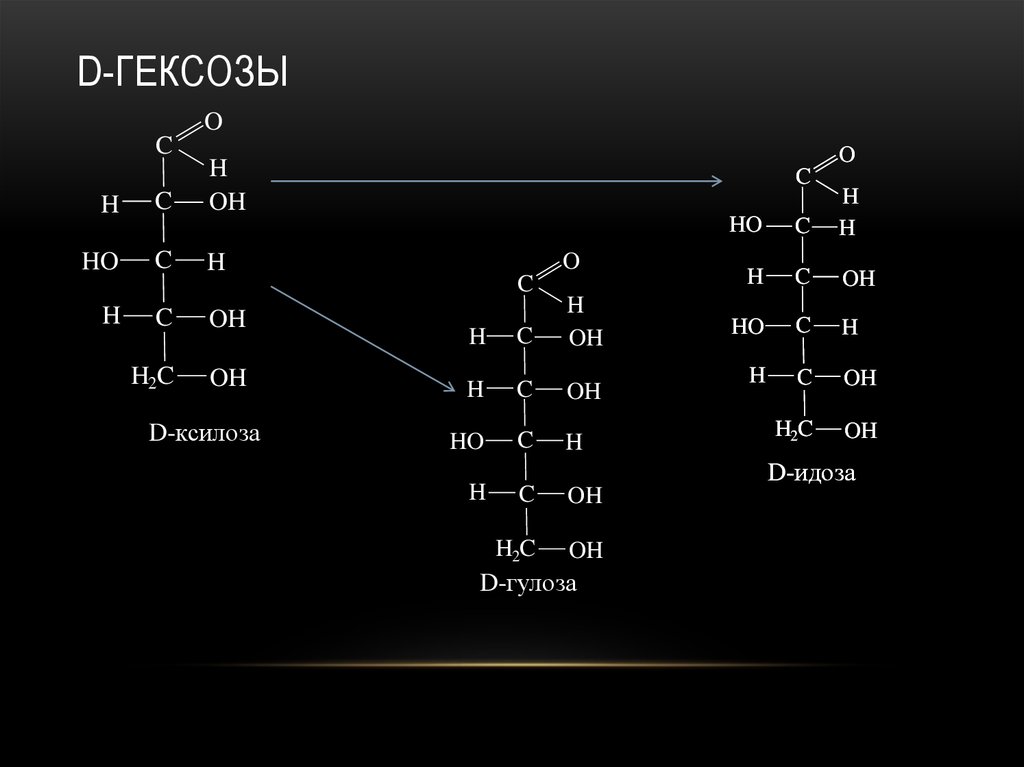
23. D-гексозы
D-ГЕКСОЗЫO
O
C
HO
H
H
C
C
C
H2C
C
H
H
O
OH
OH
OH
D-арабиноза
C
HO
C
H
H
HO
C
H
H
C
OH
H
C
OH
H2C
OH
D-манноза
H
C
H
OH
HO
C
H
H
C
OH
H
C
OH
H2C
OH
D-глюкоза
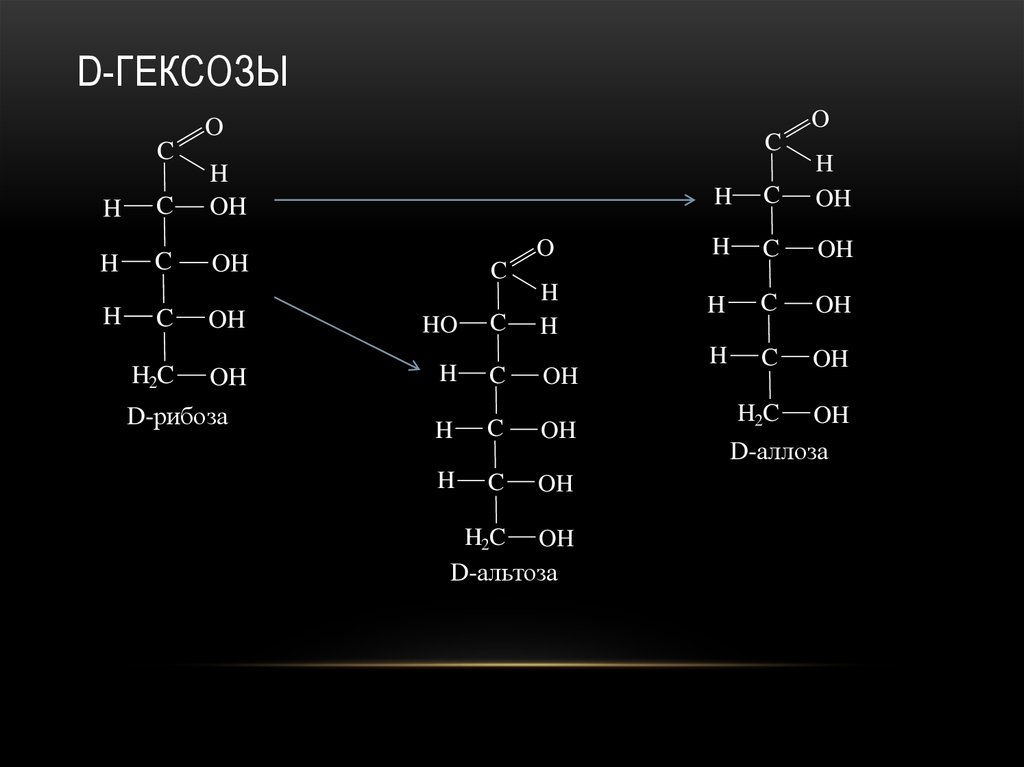
24. D-гексозы
D-ГЕКСОЗЫO
O
C
H
C
H
OH
H
C
OH
H
C
H2C
OH
OH
D-рибоза
C
C
HO
C
H
C
H
OH
O
H
C
OH
H
H
H
C
OH
H
C
OH
H
C
H
C
OH
H
C
OH
OH
H2C OH
D-альтоза
H2C
OH
D-аллоза
25. D-гексозы
D-ГЕКСОЗЫO
C
HO
C
H
H
HO
C
H
H
O
C
O
C
OH
H
C
H
OH
H2C OH
D-ликсоза
HO
C
H
HO
C
H
H
C
OH
H2C
OH
C
D-галактоза
HO
C
H
H
HO
C
H
HO
C
H
H
C
OH
H2C OH
D-талоза
26. D-гексозы
D-ГЕКСОЗЫO
C
H
C
HO
C
H
O
H
OH
C
O
H
C
OH
H2C
OH
D-ксилоза
C
H
C
H
OH
H
C
OH
HO
C
H
H
HO
C
H
H
H
C
OH
HO
C
H
H
C
OH
H2C
OH
D-идоза
C
OH
H2C
OH
D-гулоза
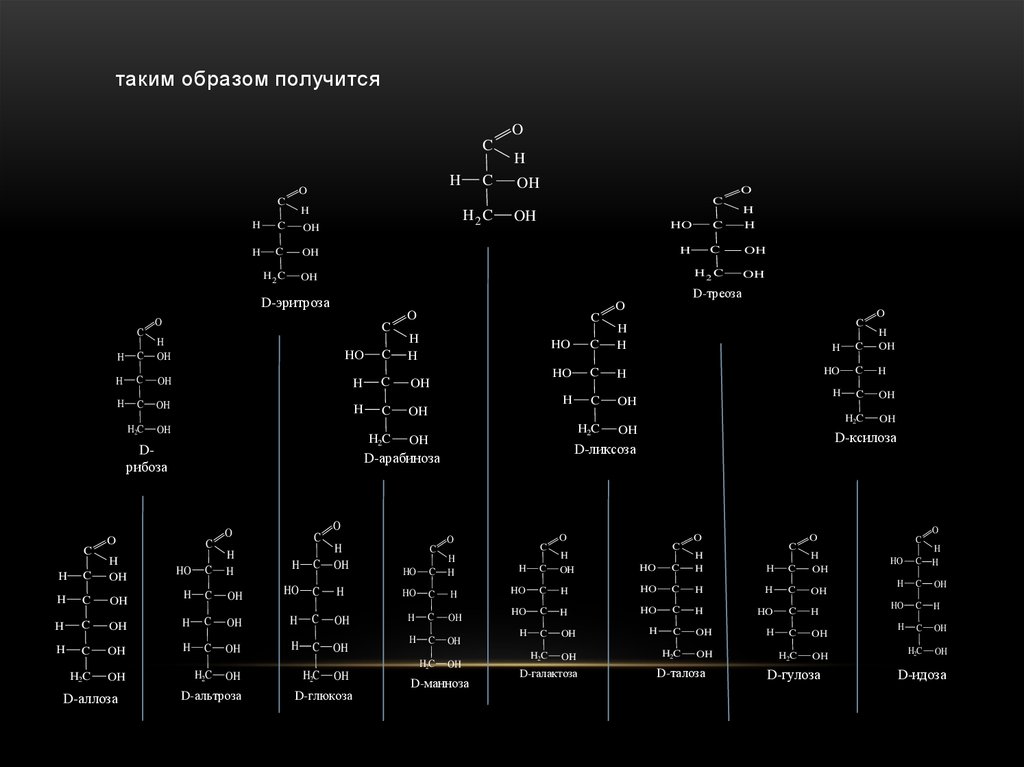
27.
таким образом получитсяO
C
H
O
C
C
H
OH
O
C
H
H
C
OH
H
C
OH
H2 C
OH
H2 C
OH
C
HO
C
OH
H
C
H
C
OH
H
C
H
C
OH
H
C
H2C
OH
H2C
Dрибоза
C
H
C
H
OH
H
C
OH
H
C
OH
H
C
H2C
OH
OH
D-аллоза
C
H
H
H
OH
HO
C
H
H
HO
C
H
H
C
OH
H2C
OH
OH
OH
C
H
C
H
OH
C
H
HO
C
H
H
H
C
OH
HO
C
OH
H
H
C
H2C
OH
OH
D-альтроза
C
OH
H2 C
OH
O
C
H
C
H
OH
HO
C
H
H
C
OH
H2C
OH
D-ксилоза
O
O
H
H
D-ликсоза
D-арабиноза
C
H
H
O
O
O
O
C
D-треоза
D-эритроза
C
HO
H
C
C
H2C
OH
OH
OH
D-глюкоза
C
HO
C
H
H
HO
C
H
H
H
C
OH
C
OH
H2C
OH
D-манноза
O
O
O
C
H
HO
HO
H
C
C
H
OH
HO
C
H
HO
C
H
C
OH
H2C
OH
D-галактоза
C
H
H
H
C
H
OH
C
H
H
C
OH
C
HO
H
H
C
OH
H2C
OH
D-талоза
O
O
C
HO
H
C
H
C
OH
H2C
OH
D-гулоза
C
HO
C
H
H
H
C
OH
HO
C
H
H
C
OH
H2C
OH
D-идоза
28.
Принадлежность моносахарида к тому или иномугенетическому ряду определяют по конфигурации его
последнего (считая от альдегидной группы) асимметрического
атома углерода. Если она соответствует конфигурации Dглицеринового альдегида, то есть гидроксил стоит справа, то
моноза относится к D-ряду. Если же гидроксил стоит слева и
конфигурация последнего асимметрического атома моноза
соответствует L-глицериновому альдегиду, ее относят к L-ряду.
Принадлежность моносахарида к D-ряду или L-ряду
указывает только на то, что он формально может быть получен
из D- или L-глицеринового альдегида.
Направление вращения плоскости поляризации света
растворами моносахаридов зависит от конфигурации всех
асимметрических атомов молекулы.
29.
Поэтому конфигурацию моноз, то есть принадлежностьих к тому или иному генетическому ряду, принято обозначать
буквами (D и L соответственно), а направление вращения
плоскости поляризации света – знаками: «+» – вправо и «-» –
влево. Так D(-) – рибоза относится к D-ряду, плоскость
поляризации света вращает влево.
Альдозы, отличающиеся друг от друга конфигурацией
лишь у асимметрического атома углерода, соседнего с
карбонильной группой, называют эпимерами.
Эпимерами, в более широком смысле этого слова,
называют оптические изомеры, отличающиеся конфигурацией
лишь у одного из асимметрических атомов молекулы, но в
таком случае, обязательно должно быть указано у какого.
30.
В природе наиболее широкораспространены пентозы и гексозы.
31.
Из альдопентоз наиболее известны D-рибоза и Dдезоксирибоза, входящие в состав нуклеиновых кислот, и Dксилоза, входящая в состав некоторых полисахаридов –пентозанов.
O
C
O
C
H
O
C
H
H
C
OH
H
C
H
H
C
OH
H
C
H
C
OH
H
C
H
H
C
OH
OH
HO
C
H
OH
H
C
OH
H2 COH
H2 COH
H2 COH
D-рибоза
2-дезокси-D-рибоза
D-ксилоза
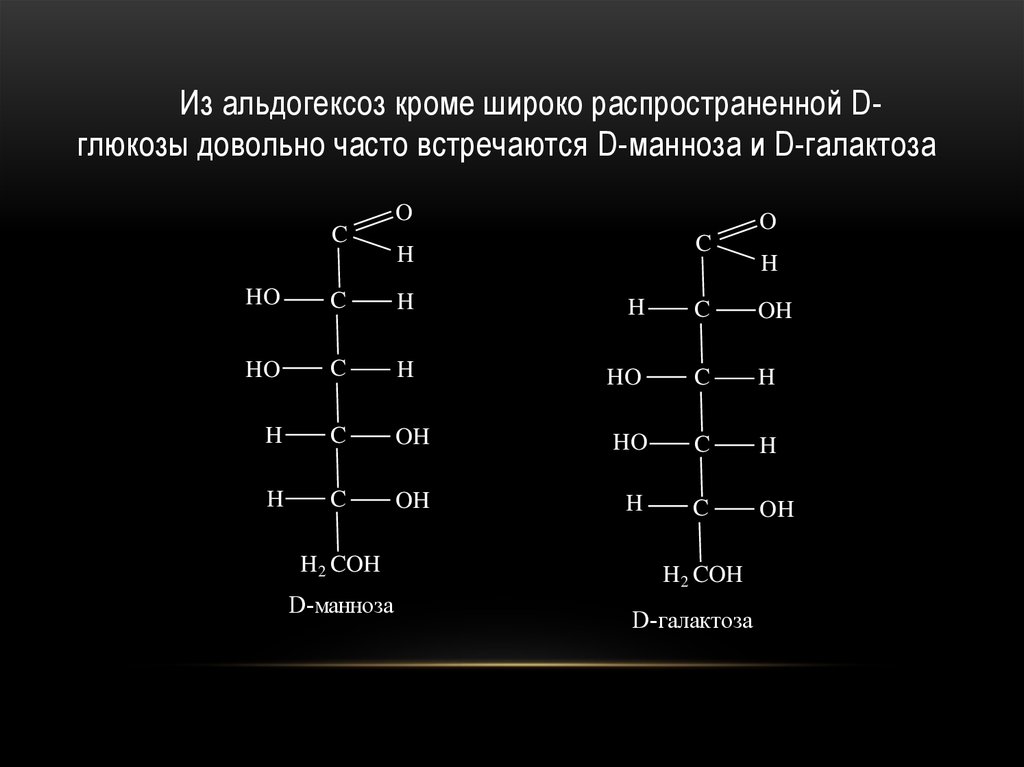
32.
Из альдогексоз кроме широко распространенной Dглюкозы довольно часто встречаются D-манноза и D-галактозаO
C
O
C
H
H
HO
C
H
H
C
OH
HO
C
H
HO
C
H
H
C
OH
HO
C
H
H
C
OH
H
C
OH
H2 COH
D-манноза
H2 COH
D-галактоза
33.
Большинство природныхмоносахаридов относятся к D-ряду.
34.
Моносахариды могут иметь двоякое строение: не толькоальдегидо- и кетоспиртов, но и внутрициклических полуацеталей, не
содержащих свободной альдегидной (или кетонной) группы, но легко
дающей ее при разрыве цикла.
Так в кристаллическом состоянии моносахариды имеют
циклическое строение, а в растворах представлены циклическими и
открытыми формами, находящимися в динамическом равновесии,
называемом цикло-цепной таутомерией.
Образование циклических форм обусловлено взаимодействием
альдегидной группы с гидроксилом пятого или реже, четвертого
углеродного атома.
Циклизация происходит так, что атом водорода гидроксильной
группы присоединяется к кислороду альдегидной группы за счет разрыва πсвязи, образуя так называемый полуацетальный, или гликозидный,
гидроксил.
35.
Атом кислорода гидроксильной группы упятого атома углерода после отщепления от
него атома водорода соединяется с атомом
углерода альдегидной группы. Таким образом,
возникает кислородный мостик между пятым и
первым атомами углерода замыкающий
шестичленный цикл.
В полуацетальной форме нет свободной
альдегидной группы. В молекуле появляется
пятый (новый) асимметрический центр.
36.
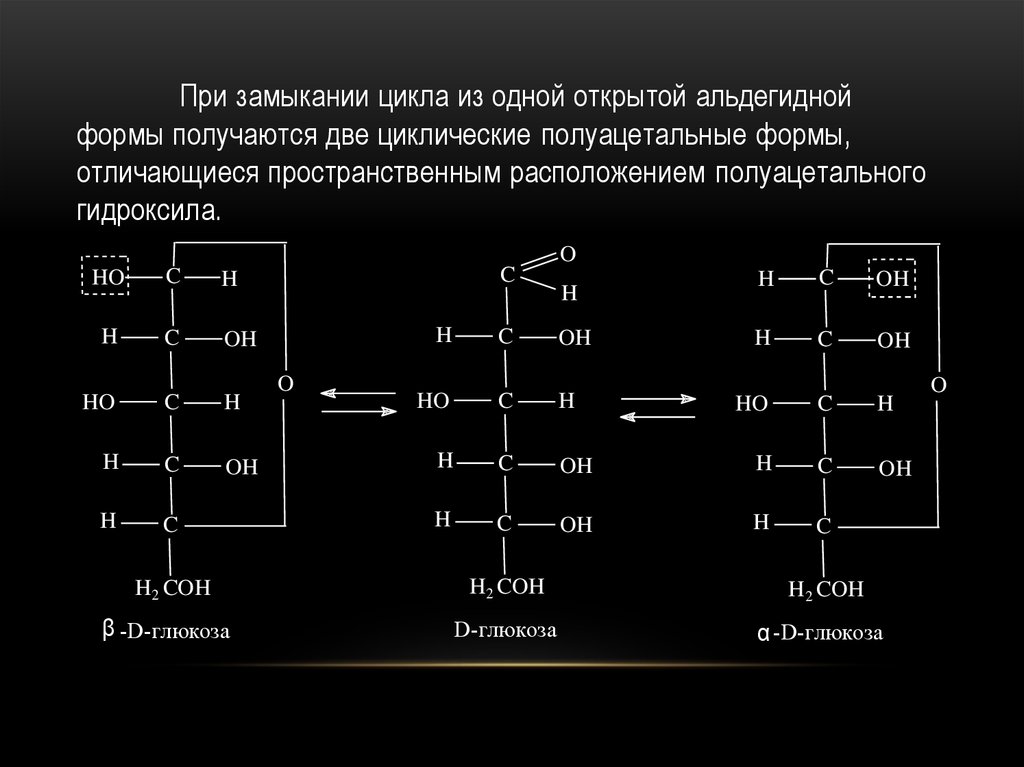
При замыкании цикла из одной открытой альдегиднойформы получаются две циклические полуацетальные формы,
отличающиеся пространственным расположением полуацетального
гидроксила.
O
HO
C
H
H
C
OH
HO
C
H
H
C
OH
H
C
H2 COH
β -D-глюкоза
C
O
H
H
C
OH
H
C
OH
HO
C
H
OH
H
C
OH
HO
C
H
H
C
OH
H
C
H
C
OH
H
C
H2 COH
H2 COH
D-глюкоза
α -D-глюкоза
O
37.
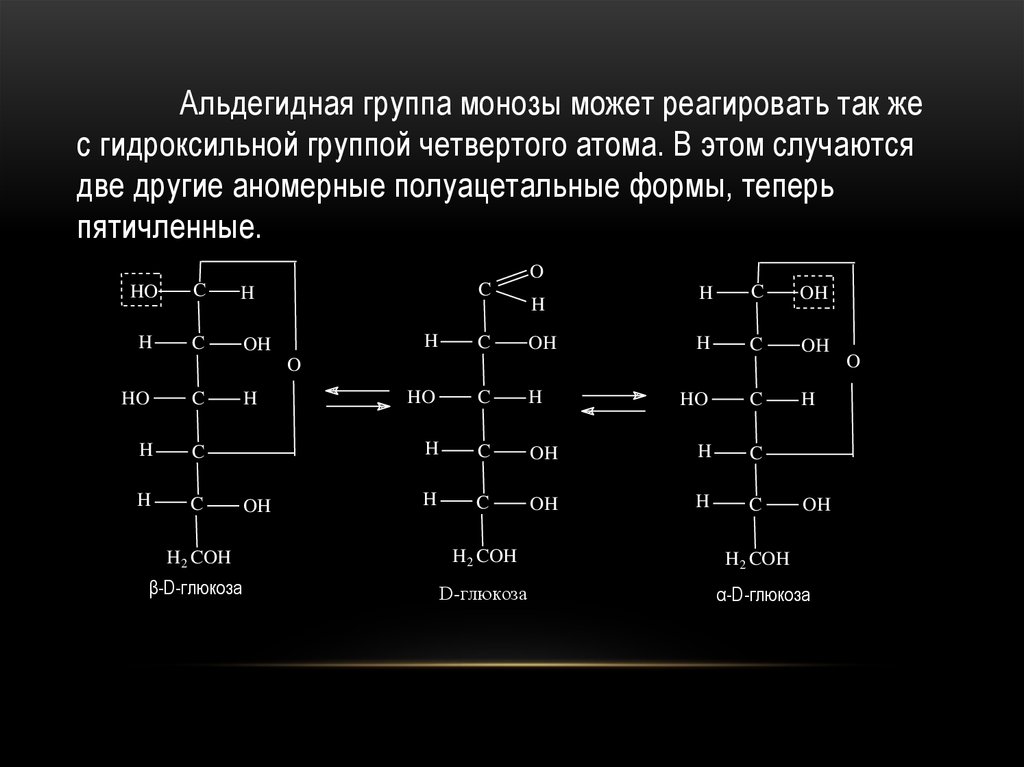
Альдегидная группа монозы может реагировать так жес гидроксильной группой четвертого атома. В этом случаются
две другие аномерные полуацетальные формы, теперь
пятичленные.
O
HO
C
H
H
C
OH
C
H
C
H
OH
H
C
OH
H
C
OH
HO
C
H
O
HO
C
H
C
H
C
H
OH
HO
C
H
H
C
OH
H
C
H
C
OH
H
C
H2 COH
H2 COH
β-D-глюкоза
D-глюкоза
OH
H2 COH
α-D-глюкоза
O
38.
Моносахариды, имеющие пятичленное кольцо, относятк производным фурана и называют фуранозами, а имеющие
шестичленное кольцо, относят к производным пирана и
называют пиранозами.
O
O
фуран
O
O
пиран
Строение пираноз и фураноз удобнее изображать
«перспективными» формулами, предложенными английским
химиком-органиком Уолтером Хеуорсом.
39.
Атомы кислорода всегда располагают в правом верхнем углу. Для болееотчетливого изображения плоскости кольца часть его, обращенная к наблюдателю,
обозначается утолщенными линиями. Углеродные атомы, входящие в цикл, не пишутся,
а только нумеруются. Через них проводят вертикальные линии, на концах которых
обозначают атомы водорода и гидроксогруппы в соответствии с их пространственным
расположением в молекуле.
При этом атомы и группы, находящиеся с левой стороны цепочки, размещают
над плоскостью кольца, то есть сверху него, за исключением атома водорода при
четвертом атоме углерода (в фуранозах) и при пятом (в пиранозах), а гидроксильные
группы и водородные атомы, расположенные с правой стороны цепи, размещают под
плоскостью кольца, то есть снизу:
6
5
6
5
4
O
1
4
3
2
пираноза
O
1
3
2
фураноза
40.
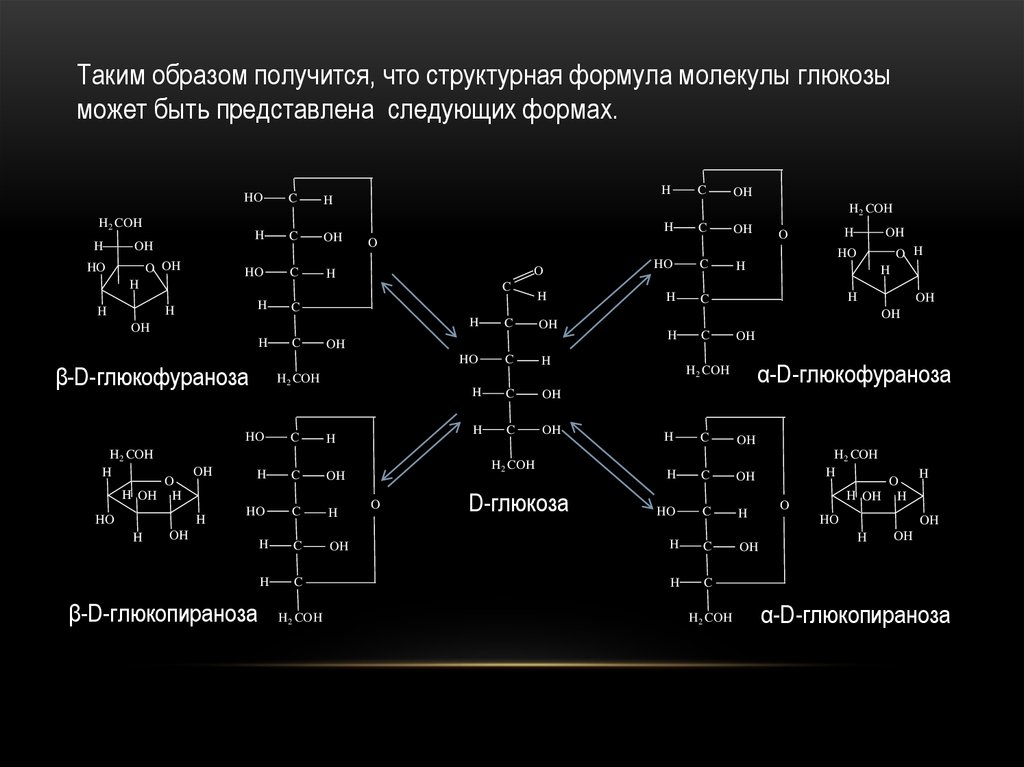
Таким образом получится, что структурная формула молекулы глюкозыможет быть представлена следующих формах.
HO
H2 COH
H
H
OH
O OH
HO
HO
C
C
C
H
OH
H
O
H
C
H
β-D-глюкофураноза
O
H OH H
HO
OH
H
H
H
C
OH
HO
C
H
C
H
H
C
C
OH
OH
H
H
C
OH
HO
C
H
OH
β-D-глюкопираноза
H
C
H
C
H 2 COH
OH
OH
HO
C
H
H
C
OH
H
C
OH
H 2 COH
O
D-глюкоза
H
O
OH
O H
HO
H
H
OH
OH
H
C
OH
α-D-глюкофураноза
H 2 COH
H2 COH
HO
H2 COH
H
C
C
O
OH
H
H
H2 COH
C
H
H
H
H
C
OH
H
C
OH
HO
C
H
H
C
H
C
H 2 COH
OH
H2 COH
H
O
H OH H
O
HO
H
OH
H
OH
α-D-глюкопираноза
41. МОНОСАХАРИДЫ
КЕТОЗЫ42.
Кетозы являются изомерами альдоз с тем же числом углеродныхатомов и так же подразделяются на тетрозы, пентозы, гексозы и т.д.
Кетозы содержат на один асимметрический атом углерода
меньше, чем соответствующие альдозы, и поэтому имеют меньшее число
оптических изомеров.
Принадлежность кетоз к D- или L-ряду определяется по
расположению гидроксила у последнего (считая от карбонильной группы)
асимметрического атома углерода, соответствующего исходному
глицериновому альдегиду.
H2 COH
C
H2 COH
O
C
D-ряд
O
L-ряд
H
C
H2 COH
OH
HO
C
H2 COH
H
43.
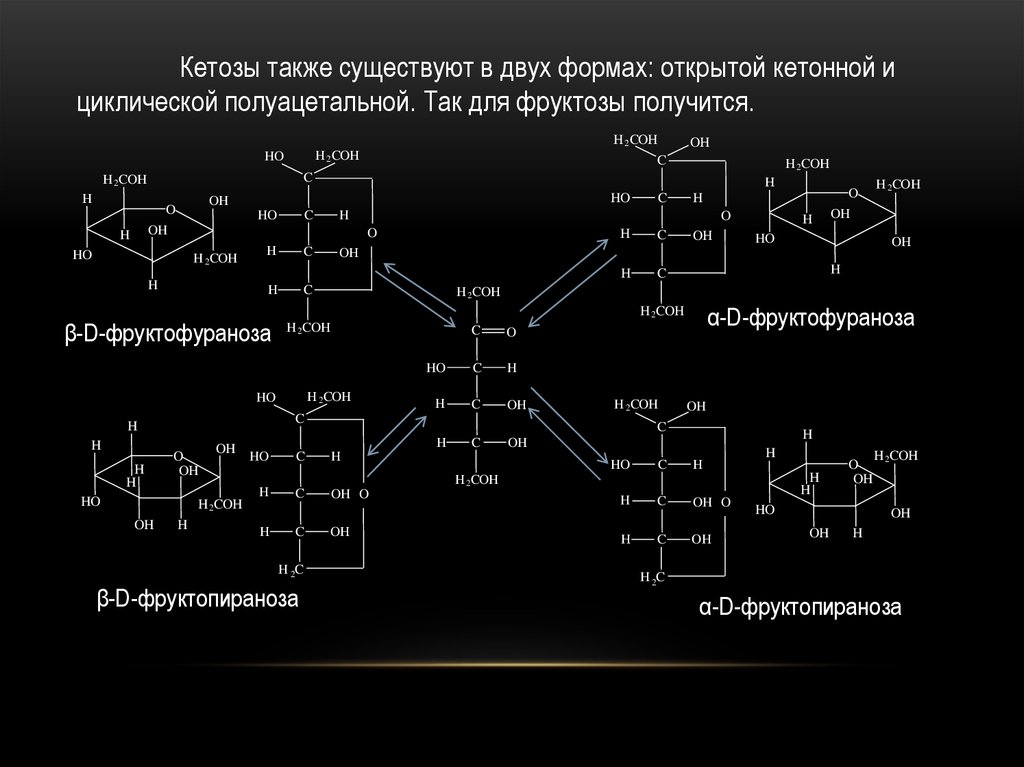
Кетозы также существуют в двух формах: открытой кетонной ициклической полуацетальной. Так для фруктозы получится.
H 2COH
H 2 COH
HO
H 2COH
HO
C
H 2COH
H
C
H
C
H 2 COH
H 2COH
C
O
HO
C
H
H
C
OH
H
H
C
H
C
O
OH
OH
H 2COH
H
H 2COH
H
HO
H 2COH
HO
C
H
H
C
OH O
C
OH
H
C
H
H
H
H
H 2 COH
C
H 2C
β-D-фруктопираноза
OH
α-D-фруктофураноза
OH
HO
OH
H
H
H 2COH
H
C
H
H
OH
O
OH
OH
C
HO
OH
H
H 2COH
HO
H
H
O
H
β-D-фруктофураноза
C
H
O
HO
H
H
HO
OH
O
OH
H
C
C
H 2COH
H
OH
C
OH O
C
OH
O
OH
HO
H 2COH
OH
OH
H
H 2C
α-D-фруктопираноза
44. моносахариды
МОНОСАХАРИДЫсвойства
45.
Альдопентозам свойственны почти все реакции альдегидови многоатомных спиртов. Они окисляются, дают реакции
серебряного зеркала и Фелинга, при мягком окислении образуют
карбоновые кислоты (в виде лактона), при восстановлении дают
пятиатомные спирты – пентиты, при взаимодействии с
фенилгидразином образуют азазоны. Алкилирование
альдопентоз приводит к образованию простых эфиров.
Алкилирование сильными реагентами (например:
диметилсульфатом) приводит к образованию тетраметилового
эфира, у которого одна метильная группа (гликозидная) легко
отщепляется.
Известны как альдогексозы так и кетогексозы. Для гексоз
характерны реакции карбонильных соединений и многоатомных
спиртов – гекситов; окисляются до монокарбоновых кислот, с
фенилгидрозином образуют озазоны.
46.
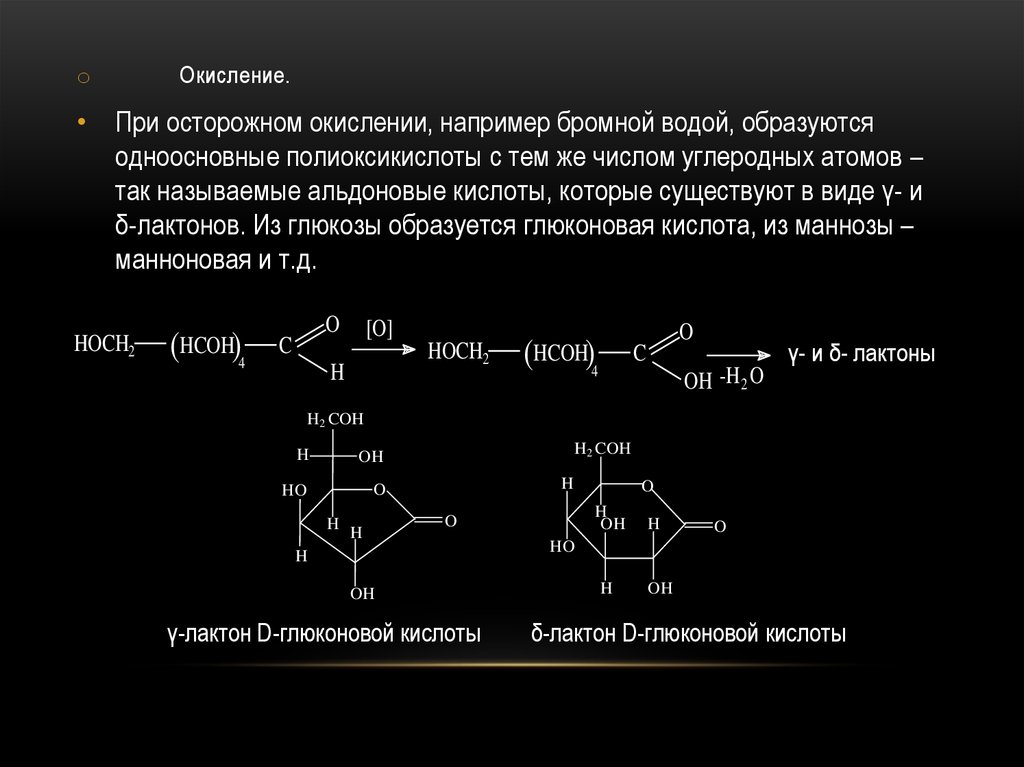
oОкисление.
• При осторожном окислении, например бромной водой, образуются
одноосновные полиоксикислоты с тем же числом углеродных атомов –
так называемые альдоновые кислоты, которые существуют в виде γ- и
δ-лактонов. Из глюкозы образуется глюконовая кислота, из маннозы –
манноновая и т.д.
HOCH2
(HCOH)4
O
C
[O]
HOCH2
H
(HCOH)4
O
C
OH -H 2 O
γ- и δ- лактоны
H2 COH
H
OH
HO
O
H H
H2 COH
H
H
OH
O
H
OH
γ-лактон D-глюконовой кислоты
O
H
O
HO
H
OH
δ-лактон D-глюконовой кислоты
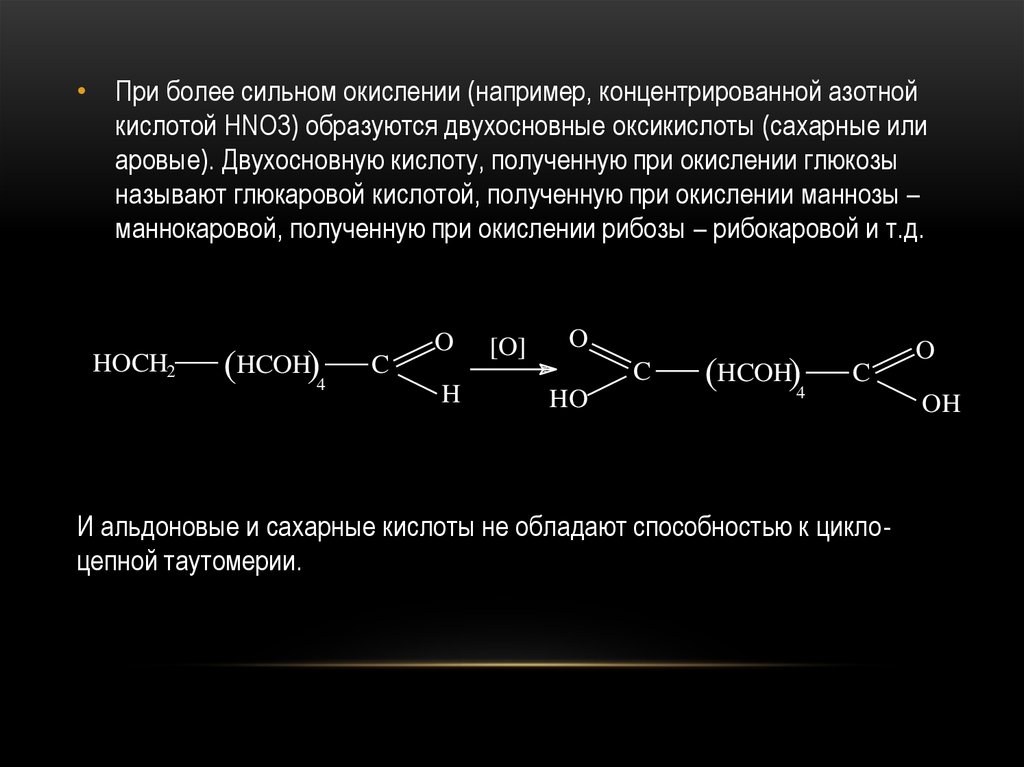
47.
• При более сильном окислении (например, концентрированной азотнойкислотой HNO3) образуются двухосновные оксикислоты (сахарные или
аровые). Двухосновную кислоту, полученную при окислении глюкозы
называют глюкаровой кислотой, полученную при окислении маннозы –
маннокаровой, полученную при окислении рибозы – рибокаровой и т.д.
HOCH2
(HCOH)4
C
O
H
[O]
O
C
HO
(HCOH)4
C
И альдоновые и сахарные кислоты не обладают способностью к циклоцепной таутомерии.
O
OH
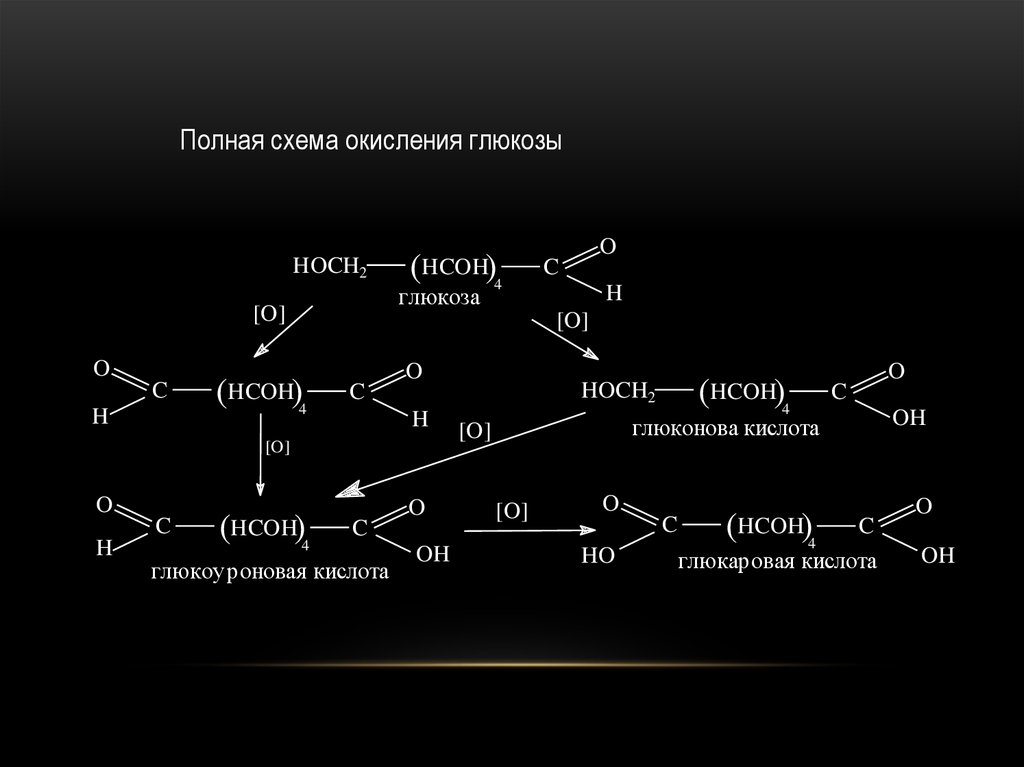
48.
Полная схема окисления глюкозыHOCH2
C
H
(HCOH)4
C
H
(HCOH)4
H
[O]
C
O
H
[O]
O
C
глюкоза
[O]
O
(HCOH)4
O
C
глюкоуроновая кислота
O
OH
(HCOH)4
HOCH2
C
глюконова кислота
[O]
[O]
O
C
HO
(HCOH)4 C
глюкаровая кислота
O
OH
O
OH
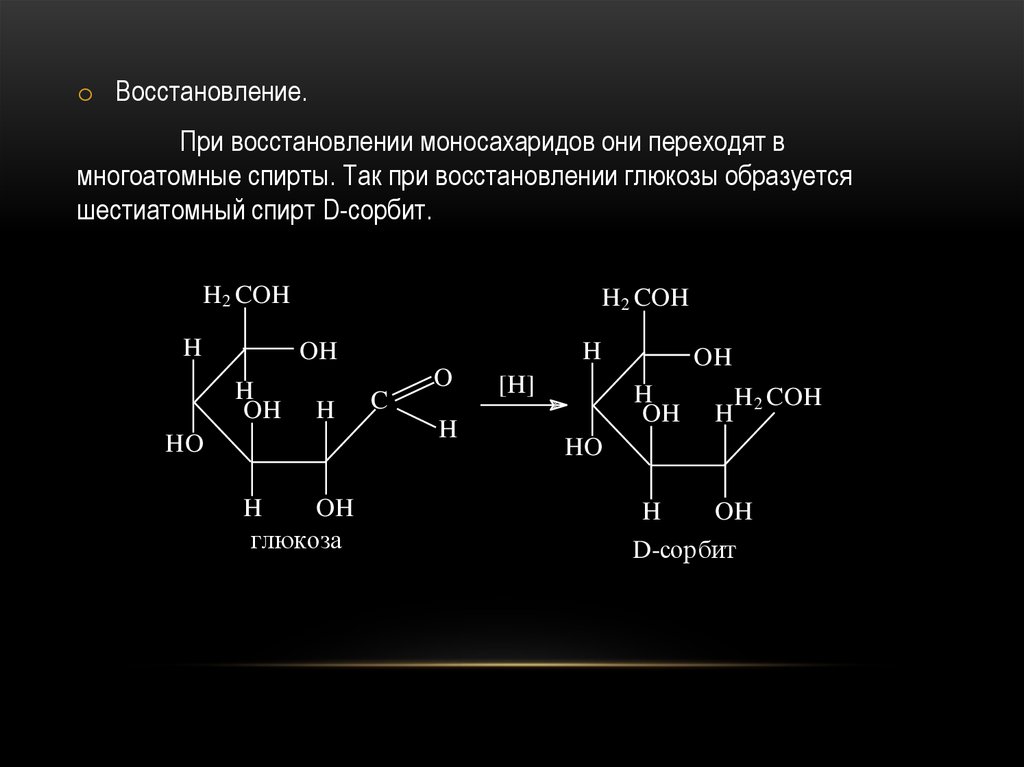
49.
o Восстановление.При восстановлении моносахаридов они переходят в
многоатомные спирты. Так при восстановлении глюкозы образуется
шестиатомный спирт D-сорбит.
H 2 COH
H
H 2 COH
OH
H
OH
H
HO
H
OH
глюкоза
H
C
O
H
[H]
OH
H
OH
H
H 2 COH
HO
H
OH
D-сорбит
50.
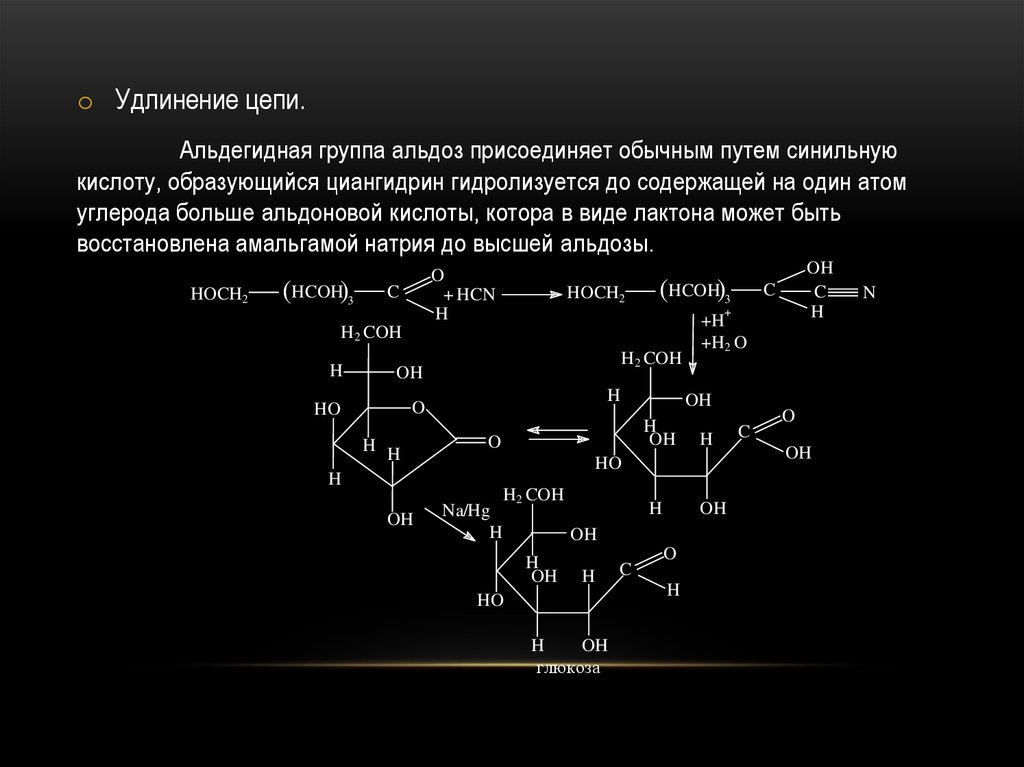
o Удлинение цепи.Альдегидная группа альдоз присоединяет обычным путем синильную
кислоту, образующийся циангидрин гидролизуется до содержащей на один атом
углерода больше альдоновой кислоты, котора в виде лактона может быть
восстановлена амальгамой натрия до высшей альдозы.
HOCH2
(HCOH)3
O
+ HCN
H
C
HOCH2
(HCOH)3
OH
HO
O
H H
H2 COH
H
OH
+H
+H2 O
OH
H
OH
O
H
HO
H
Na/Hg
H
C
+
H2 COH
H
OH
C
H
H2 COH
OH
H
OH
H
OH
H
HO
OH
H
глюкоза
C
O
H
C
O
OH
N
51.
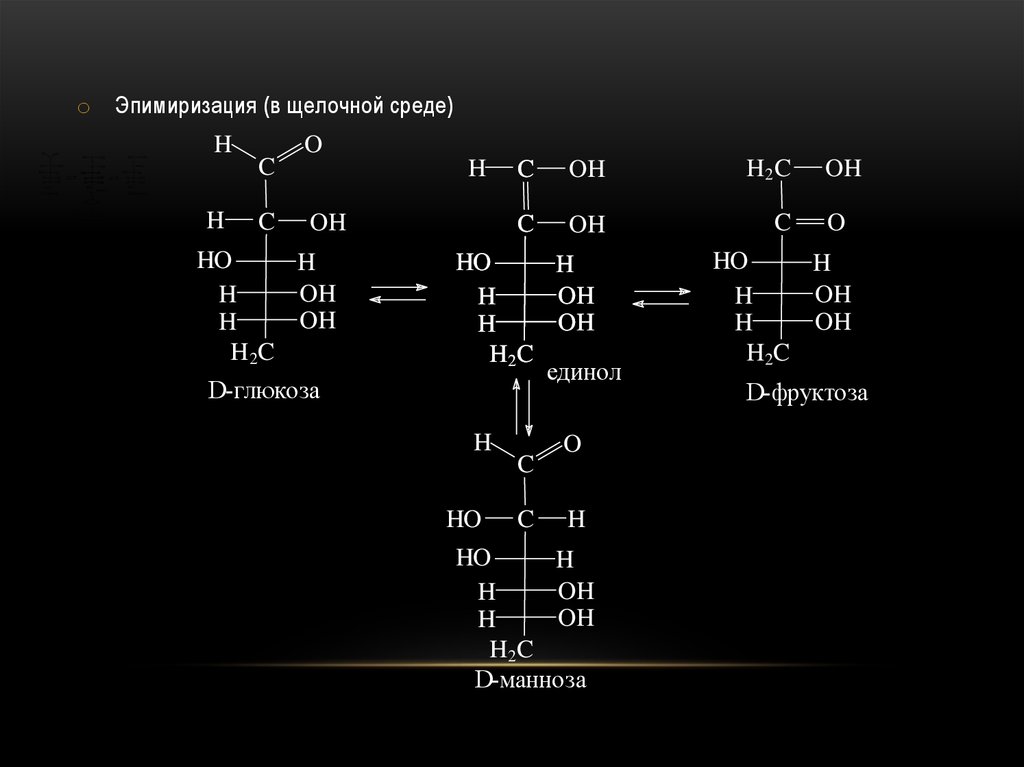
o Эпимиризация (в щелочной среде)H
O
C
H
C
H
OH
HO
H
OH
H
OH
H
H 2C
D-глюкоза
C
OH
H2 C
C
OH
C
HO
H
OH
H
OH
H
H 2C
единол
H
HO
C
C
OH
H
O
C
O
HO
H
OH
H
OH
H
H2C
H
C
OH
H2 C
C
OH
C
OH
D-фруктоза
O
H
HO
H
OH
H
OH
H
H 2C
D-манноза
H
C
OH
HO
H
OH
H
OH
H
H 2C
D-глюкоза
HO
H
OH
H
OH
H
H 2C
единол
H
HO
C
C
O
H
HO
H
OH
H
OH
H
H 2C
D-манноза
O
HO
H
OH
H
OH
H
H2C
D-фруктоза
52.
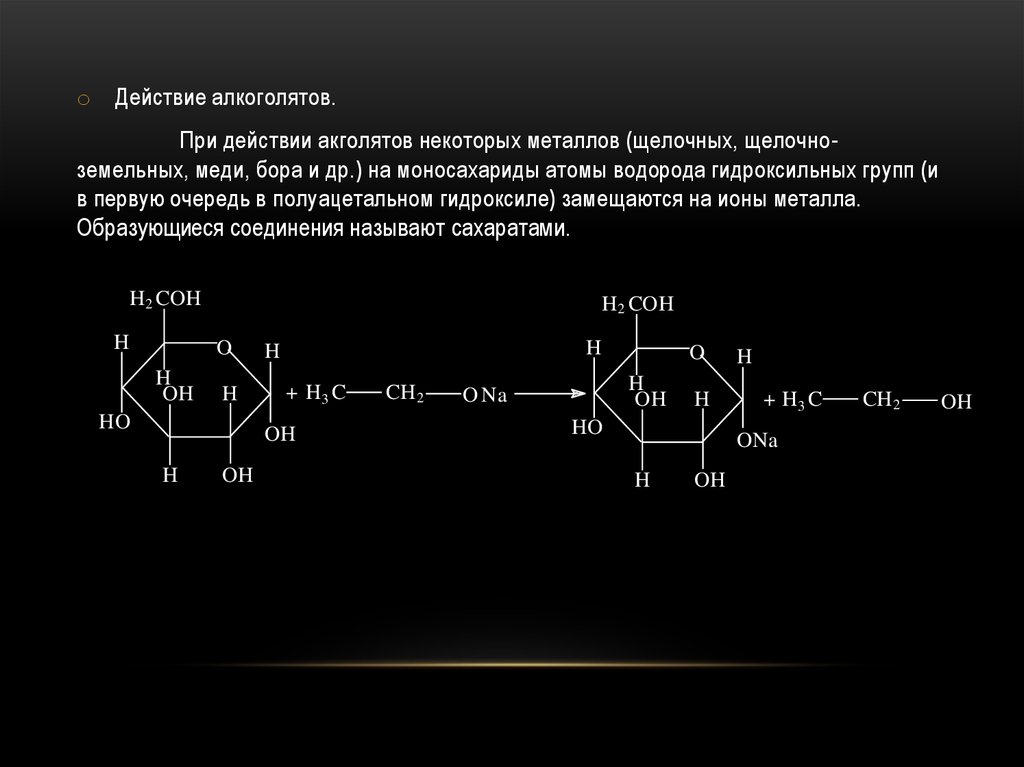
o Действие алкоголятов.При действии акголятов некоторых металлов (щелочных, щелочноземельных, меди, бора и др.) на моносахариды атомы водорода гидроксильных групп (и
в первую очередь в полуацетальном гидроксиле) замещаются на ионы металла.
Образующиеся соединения называют сахаратами.
H2 COH
H
H2 COH
O
H
OH
H
HO
H
H
+ H3 C
OH
H
OH
CH 2
O
H
OH
O Na
H
HO
H
+ H3 C
ONa
H
OH
CH 2
OH
53.
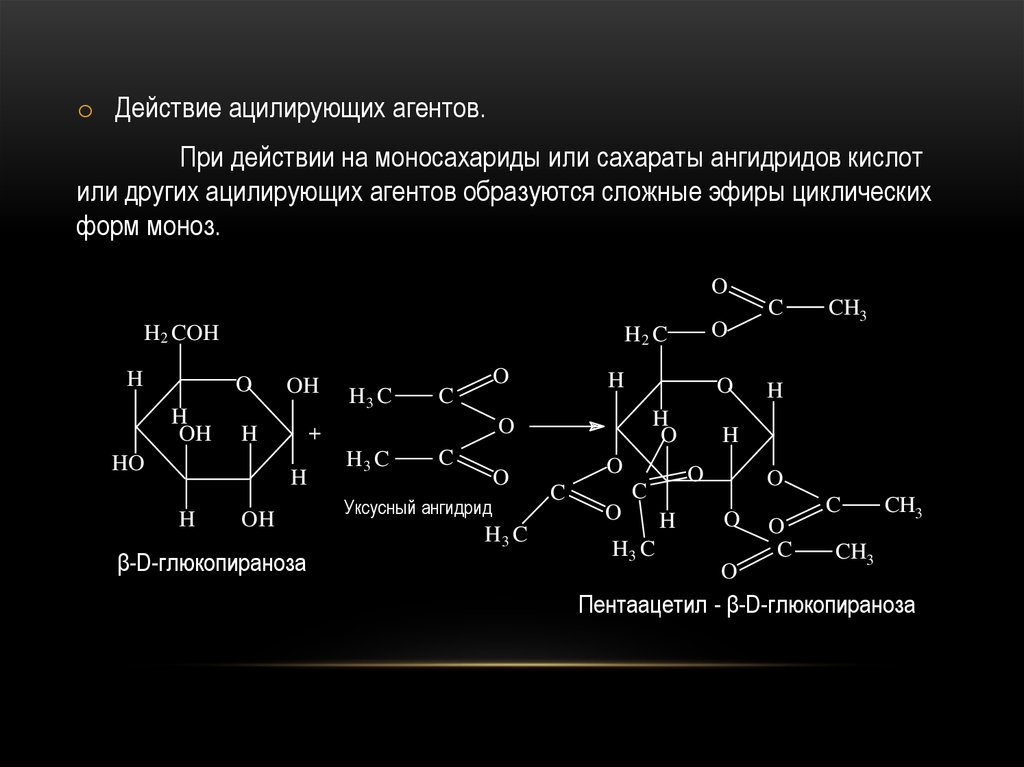
o Действие ацилирующих агентов.При действии на моносахариды или сахараты ангидридов кислот
или других ацилирующих агентов образуются сложные эфиры циклических
форм моноз.
O
C
H2 COH
H
H
OH
O
OH
H
+
HO
H
H
O
H2 C
OH
β-D-глюкопираноза
H3 C
O
C
H
O
H
O
O
H3 C
C
O
Уксусный ангидрид
H3 C
O
C
O
H3 C
H
H
H
O
C
CH3
O
O
O
C
O
C
CH3
CH3
Пентаацетил - β-D-глюкопираноза
54.
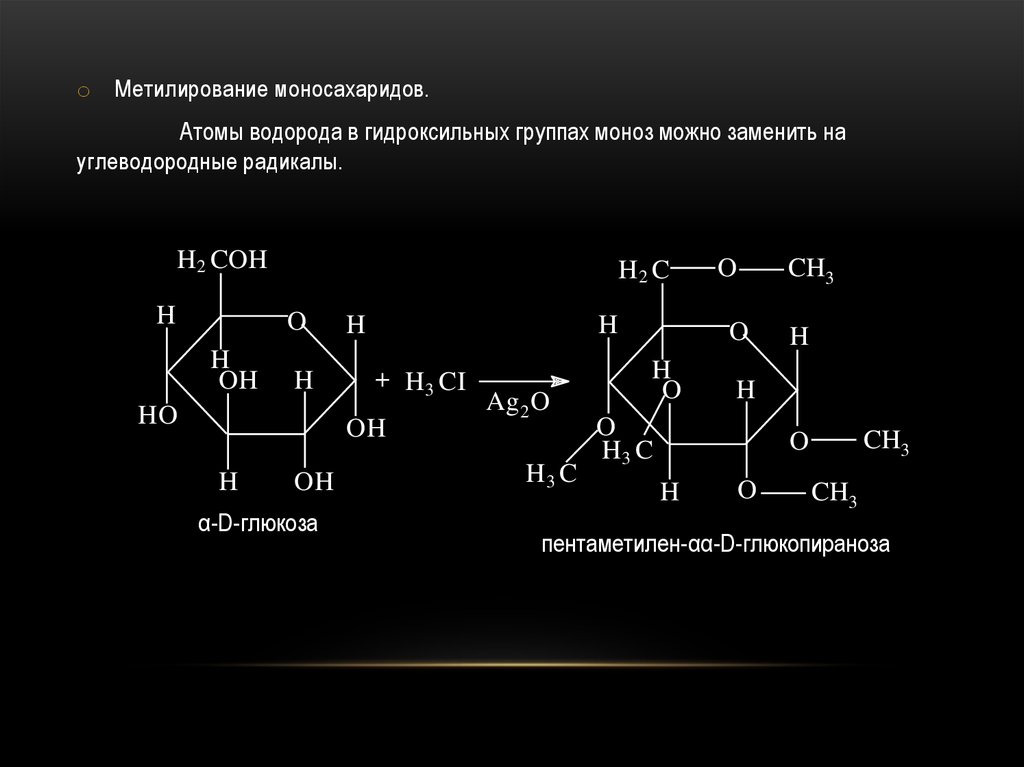
o Метилирование моносахаридов.Атомы водорода в гидроксильных группах моноз можно заменить на
углеводородные радикалы.
H2 COH
H
H2 C
O
H
OH
H
HO
H
H
+ H3 CI
OH
H
OH
α-D-глюкоза
Ag 2 O
H3 C
O
CH3
O
H
O
H
H
O
H3 C
CH3
O
H
O
CH3
пентаметилен-αα-D-глюкопираноза
55. моносахариды
МОНОСАХАРИДЫВажнейшие представители
56. ксилоза
КСИЛОЗА57. рибоза
РИБОЗА58. 2-дезоксирибоза
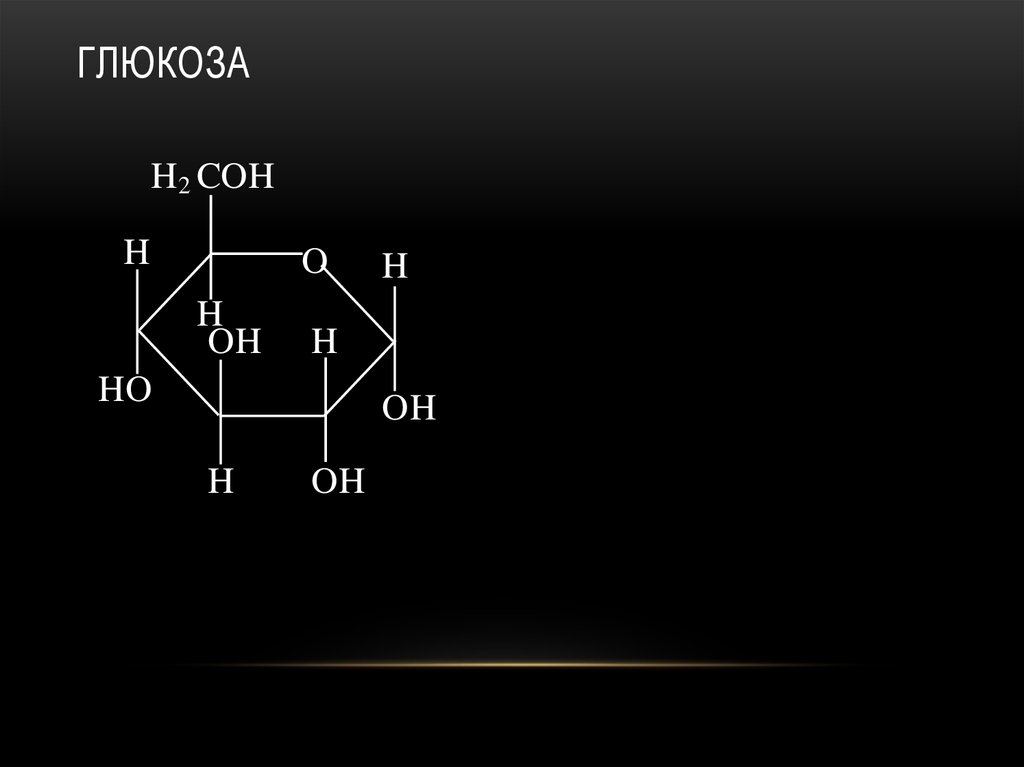
2-ДЕЗОКСИРИБОЗА59. глюкоза
ГЛЮКОЗАH2 COH
H
O
H
OH
H
H
HO
OH
H
OH
60. галактоза
ГАЛАКТОЗА61. фруктоза
ФРУКТОЗА62. Сорбоза и аскорбиновая кислота
СОРБОЗА И АСКОРБИНОВАЯ КИСЛОТА63. дисахариды
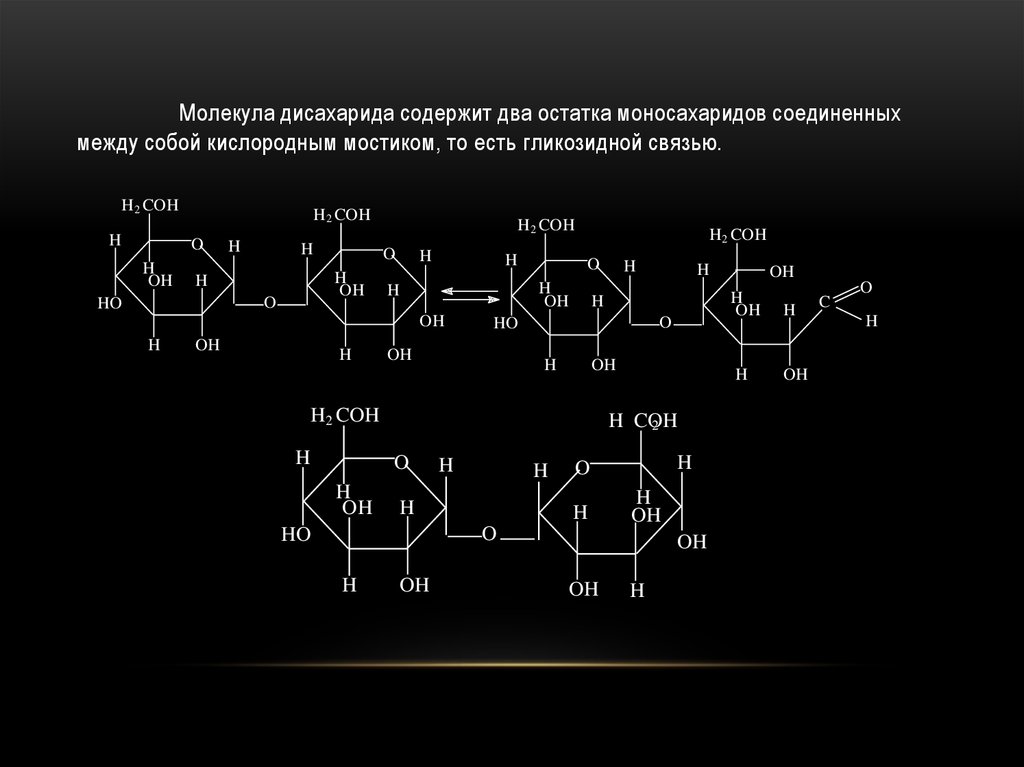
ДИСАХАРИДЫ64.
Молекула дисахарида содержит два остатка моносахаридов соединенныхмежду собой кислородным мостиком, то есть гликозидной связью.
H2 COH
H
H2 COH
O
H
OH
H
H
O
HO
O
H
OH
H
H2 COH
H
H
OH
H
O
H
OH
H
OH
H
H2 COH
H
OH
H
OH
H
H COH
2
O
H
H
H
H
O
H
H
OH
O
HO
H
OH
OH
OH
OH
H
OH
O
HO
OH
H
H
H2 COH
H
H
H
H
OH
C
O
H
65. дисахариды
Для дисахаридов характерны все те жехимические реакции, что и для моносахаридов:
•Восстановление
•Удлинение цепи
•Действие алкоголятов
•Действие ацилирующих агентов
•Метилирование моносахаридов
•Окисление
66. Окисление
Окисление дисахаридов протекает не так глубоко, какмоносахаридов. Кроме того окислению подвергаются только
те из них, которые способны к существованию в открытой
форме. И называют восстанавливающими сахарами.
H 2 COH
H 2 COH
O
OH
HO
O
O
OH
OH, H
OH
OH
мальтоза
H 2 COH
H 2 COH
O
OH
HO
O
C
OH
OH
O
OH
H
OH
[O]
H 2 COH
H 2 COH
O
HO
OH
O
C
OH
OH
мальтобионовая кислота
O
OH
OH
OH
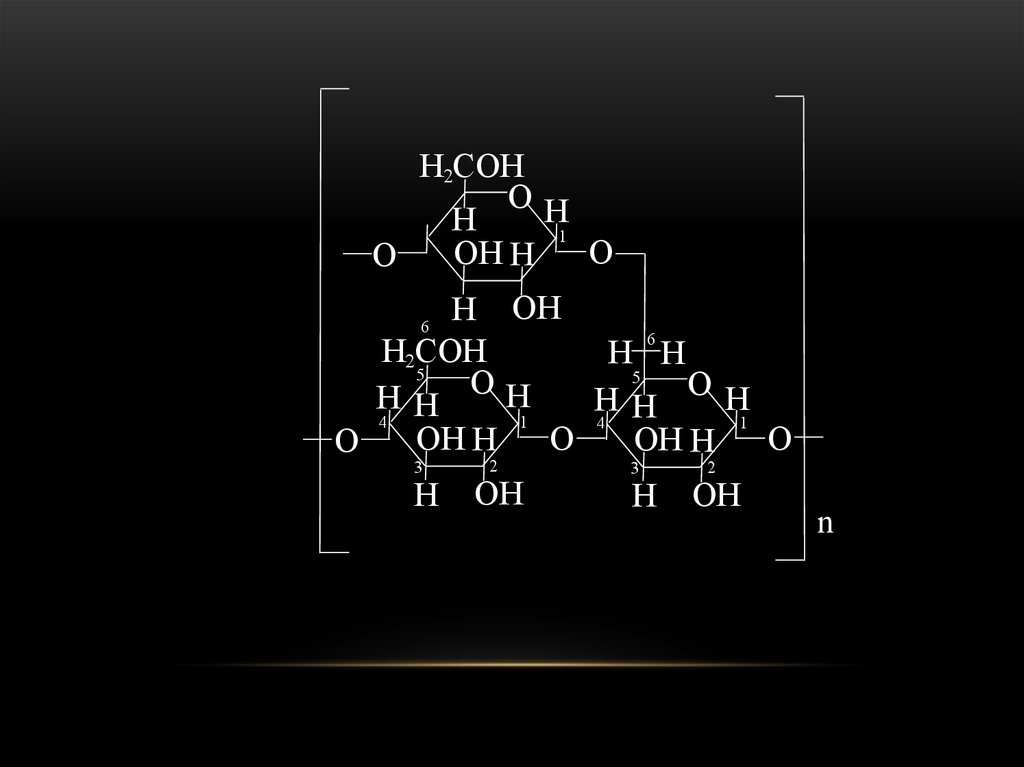
67. Полисахариды
ПОЛИСАХАРИДЫ68.
Полисахариды – это углеводы, которые при гидролизеобразуют сотни или даже тысячи моносахаридов. Это природные полимеры, которые являются продуктами поликонденсации альдоз и кетоз.
69.
70.
Наиболее важные представителиoКрахмал
oЦеллюлоза
oГликоген
71. крахмал
КРАХМАЛСодержится в зернах растений и в
картофеле. Обычно его выделяют из
картофеля или кукурузных зерен.
Образуется в виде микроскопических
зернышек (20÷100 мкм), набухает в
воде с последующим распадом и
образованием вязких растворов,
клейстеров (гелей).
72. крахмал
КРАХМАЛПредставляет собой неоднородный
полисахарид и состоит из
полисахаридов:
амилозы (≈20%)
и
амилопектина (≈80%).
73. амилоза
АМИЛОЗАОбразована из остатков Dглюкозы. Основной повторяющийся
фрагмент – α-мальтоза.
H2COH
H2COH
H2COH
H2COH
HH OH
HH OH
HH OH
HH OH
O
OH H O
O
OH H OH
OH H
HO OH H
n
H OH
H OH
H OH
H OH
[
]
74. амилоза
АМИЛОЗАВ образовании кислородных мостиков
участвует α-полуацетальный гидроксил одного моносахарида и четвертый
гидроксил следующей молекулы (α1,4-глюкозид-глюкозидная связь).
6
6
H2COH
H2COH
5
5
O
OH
H
HH
H
H
4
1
4
1
OH H
O
O
OH H
O
[
3
H
2
OH
3
H
2
OH
]
n
75.
Предположительно, амилоза состоитиз длинных цепей, содержащих 200 и
более звеньев D-глюкозы. Цепи, как
правило, не разветвленные.
Молекула амилозы свернута в
спираль.
В воде растворяется.
С йодом образует интенсивное синее
окрашивание.
76. амилопектин
АМИЛОПЕКТИНМолекула амилопектина
характеризуется высокой степенью
разветвления и состоит из нескольких
стен коротких цепей, каждая из
которых содержит по 20÷25
глюкозных остатков, связанных α-1,4глюкозид-глюкозидной, а отдельные
цепи α-1,6-глюкозид-глюкозидной.
77.
H2COHOH
H
1
O
OH H
O
H OH
6
H2COH
H
H
5
5
OH
HH OH
H
H
1
4
1
4
O
O
OH H
OH H
O
6
3
H
2
OH
3
H
2
OH
n
78.
• В горячей воде набухает собразованием клейстера.
• При взаимодействии с йодом
образует соединение с фиолетовым
окрашиванием.
79.
В общем виде формула крахмаламожет быть представленав следующем
виде
H2COH
H2COH
H2COH
H2COH
H2COH
H2COH
O
O
H HH
HH
H HH OH HH OH HH OH H H OH
HO OH H O OH H O OH H O OH H O OH H O OH H OH
H OH
H OH
H OH
H OH
H OH
H OH
n
Невосстанавливающая
Повторяющаяся часть
Восстанавливающая
часть
часть
80. Свойства крахмала
СВОЙСТВА КРАХМАЛА• Очень характерным свойством
крахмала является цветная реакция с
йодом. Образуется соединение с
ярко синей окраской (max
поглощения 620÷650 нм).
81.
• Считают, что появление окраски связаносо специфическим донорно-акцепторным
взаимодействием между
гидроксогруппами молекулы крахмала и
молекулами йода, при этом йод
помещается внутри спирали
макромолекулы амилозы.
82. Нахождение в природе. Применение
НАХОЖДЕНИЕ В ПРИРОДЕ.ПРИМЕНЕНИЕ
Крахмал имеет очень широкий
спектр применения. Он является
главной составной частью пищевых
продуктов (хлеб, крупы, мука,
картофель, кукуруза).
83.
• Из него получают сироп и глюкозу .• В результате ферментативных
процессов получают этиловый и нбутиловый спирты, молочную и
лимонную кислоты и др.
• При гидролизе крахмала происходит
расщепление его молекулы наболее
мелкие полисахариды.
84.
Растворимй крахмал + H Oдекстрины + H O мальтоза + H O глюкоза
2
2
2
85. применение
ПРИМЕНЕНИЕ• Используют в текстильной
промышленности для изготовления
красок и клеев.
• Применяют в медицине для
изготовления присыпки, таблеток,
мазей и д.р.)
86. гликоген
ГЛИКОГЕНИмеет структуру близкую к
структуре амилопектина, но более
разветвленную (с α-1,4 и α-1,6
глюкозидными связями.
Образуется только в животных
организмах.
С йодом дает красно-бурое
окрашикание.
87.
Целлюлоза (или клетчатка)широко распространенный в природе
полисахарид. Она содержится в
растениях и является главным
компонентом древесины и
растительного волокна.
Примером чистой целлюлозы
может быть рассмотрен хлопок,
фильтровальная бумага.
88.
Макромолекула целлюлозы состоитиз остатков β-глюкозы, связанных β-1,4глюкозид-глюкозидной связью
6
6
H2COH
H
2COH
5
5
HH O
O
H
O 4
H
O
4
1O
OH H H
OH H H
2
3
3
2
H OH
H OH
n
89.
Основным повторяющимсяструктурным звеном является βцеллобиоза.
H2COH
H
2COH
H
O
2COH
H2COH
O
HH
HH
O
O
H
O
H
OH
H
OH
H
O
H
H
OH
HH
HO
OH H HO OH H
H OH
H
H OH
H OH n H OH
90. целлюлоза
ЦЕЛЛЮЛОЗАОбщий вид
H2COH
HH O
O
OH H H
H
OH x
91. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВАСо щелочью
H2COH
HH O
O
OH H H +xNaOH
H
OH x
H2CONa
HH O
O
OH H H +xH2O
H
OH x
92. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВАЩелочь и сероуглерод
H2COH
HH O
O
OH H H + x CS2 + x NaOH
H
OH x
S Na
H2CO C
HH O S
O
+ x H2O
OH H H
H OH
x
93. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВАС ангидридом уксусным
H2COH
H 3C
H H O
+ 3
O
OH H H
H 3C
H OH x
O
C
H2CO
H H O
O
O HH
H 3C C
O
H O
O
C
C
O
O
O
CH3
+ 3 H 3C
C
CH3
x
C
O
OH
94. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВАНитрование ступень1
H2COH
+ H SO
HH O
+ x HONO2 - H O
O
2
OH H H
2
H
OH x
4
NO2
H2CO
HH O
O
OH H H
H
OH
x
95. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВАНитрование ступень 2
H2COH
+ H SO
HH O
+ 2 x HONO2 - 2H O
O
2
OH H H
2
H
OH x
4
NO2
H2CO
HH O
O
OH H H
H O
O2N
x
96. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВАНитрование ступень 3
NO2
H
CO
2
H2COH
HH O
+ H SO
HH O
+ 3 x HONO2 - 3H O O O H
O
2
OH H H
H
O2N H O
H OH x
x
ON
2
4
2
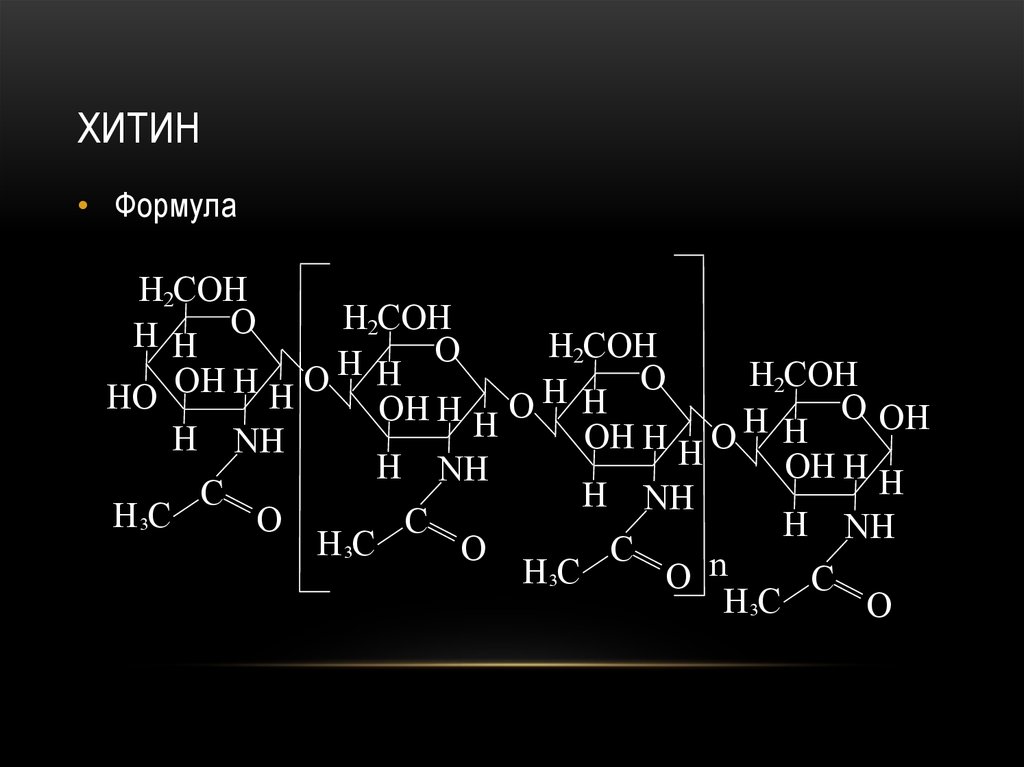
97. хитин
ХИТИН• Формула
H2COH
H
O
2COH
HH
H
O
2COH
HH
H2COH
O
O
OH
H
H
HO
H
O OH
OH H H O H
H
OH H H O H
H NH
OH H H
H NH
C
H NH
H3C
O
C
H NH
H3C
O
C
H3C
O n
C
H3C
O
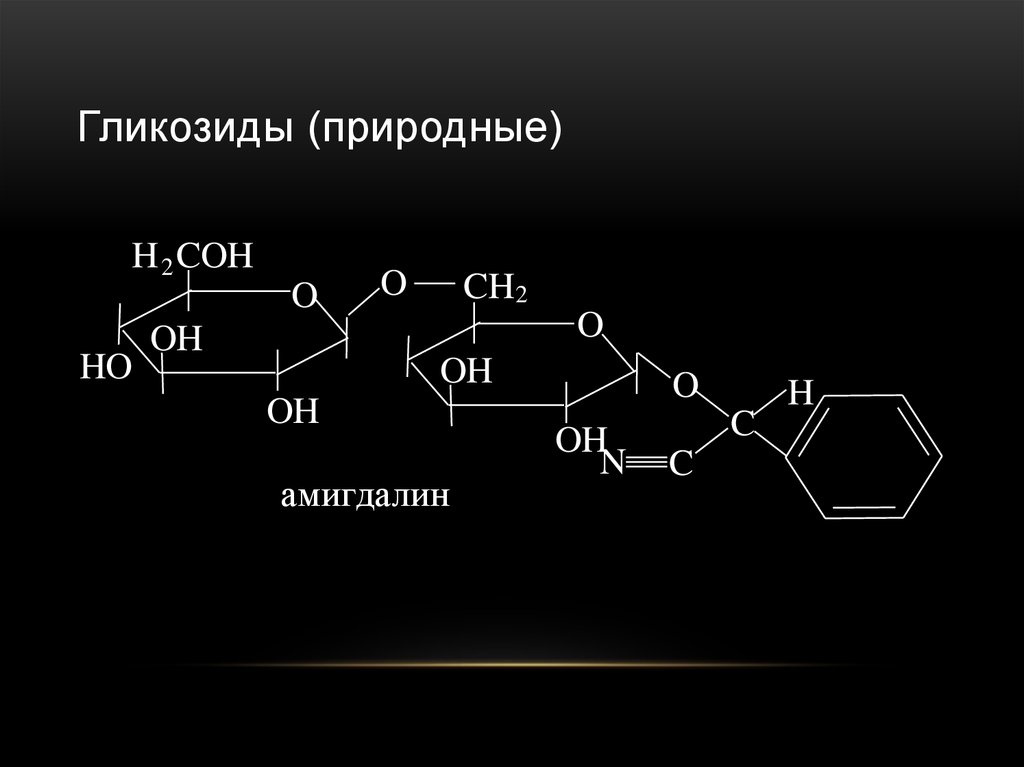
98. Гликозиды (природные)
H 2 COHO
HO
OH
O
CH2
O
OH
OH
амигдалин
O
OH
N
C
C
H


































































 Химия
Химия








