Похожие презентации:
Кинетика. Базовые понятия
1.
Кинетика.Базовые понятия.
2. Химическая кинетика
• Химическая кинетика — наука о скоростяхи механизмах химических реакций.
3. Термодинамика или кинетика?
Быть или не быть?Когда быть?
4. Химическая кинетика решает следующие задачи, перечисленные в порядке сложности их решения:
• 1. Установление экспериментальным путем зависимостимежду скоростью химической реакции и условиями ее
проведения, т. е. концентрацией реагентов и продуктов,
концентрацией катализатора (если он есть в системе),
температурой, давлением и т. д.
• 2. Установление механизма химической реакции, т. е.
выяснение элементарных стадий, из которых она состоит, и
идентификация активных промежуточных частиц,
ответственных за осуществление этих стадий.
• 3. Установление связи между строением химических
соединений и их реакционной способностью.
• В сжатой форме эти три основные задачи химической кинетики
можно сформулировать так: изучение химических
превращений, предсказание их и управление ими.
5. Скорость химической реакции
• Скорость химической реакции — это число актовпревращения в единице объема в единицу времени.
• Например, для реакции:
• A A + B B + ... x X + y Y + ... ,
• где i — стехиометрические коэффициенты,
• Скорость химической реакции будет описываться
уравнением, если i-е вещество исходное:
• Если j-е вещество — продукт реакции:
• (V = const , Ci — концентрация вещества i)
6. Кинетическое уравнение
• Кинетическое уравнение — это уравнение,описывающее зависимость скорости
химической реакции от концентраций
компонентов реакционной смеси.
A B
W
dC A (t )
k C A (t ) ,
dt
A + B X
W
dC A (t ) dC B (t )
k * C A (t ) C B (t )
dt
dt
(V = const , CA— концентрация вещества A, CB— концентрация вещества B)
7. Порядок реакции.
Порядок реакции. Если зависимость скорости реакции от концентраций реагирующихвеществ представить в виде
n
W k C ni i ,
i=1
то величину ni называют порядком реакции по веществу i.
Сумму порядков по всем веществам называют порядком реакции:
ni
n ni
i=1
Примеры для реакций:
A B
A + B X
nA = 1,
n=1
nA = 1, nB = 1
n=2
2A + 3B 2X
nA = 2, nB = 3
n=5
8. Константа скорости
nn
Константа скорости химической реакции. Множитель k в уравнении W k C i i
i=1
называют константой скорости.
Константа скорости численно равна скорости реакции при концентрации всех реагирующих
веществ, равной единице; k не зависит от концентрации реагирующих веществ, но зависит от
температуры.
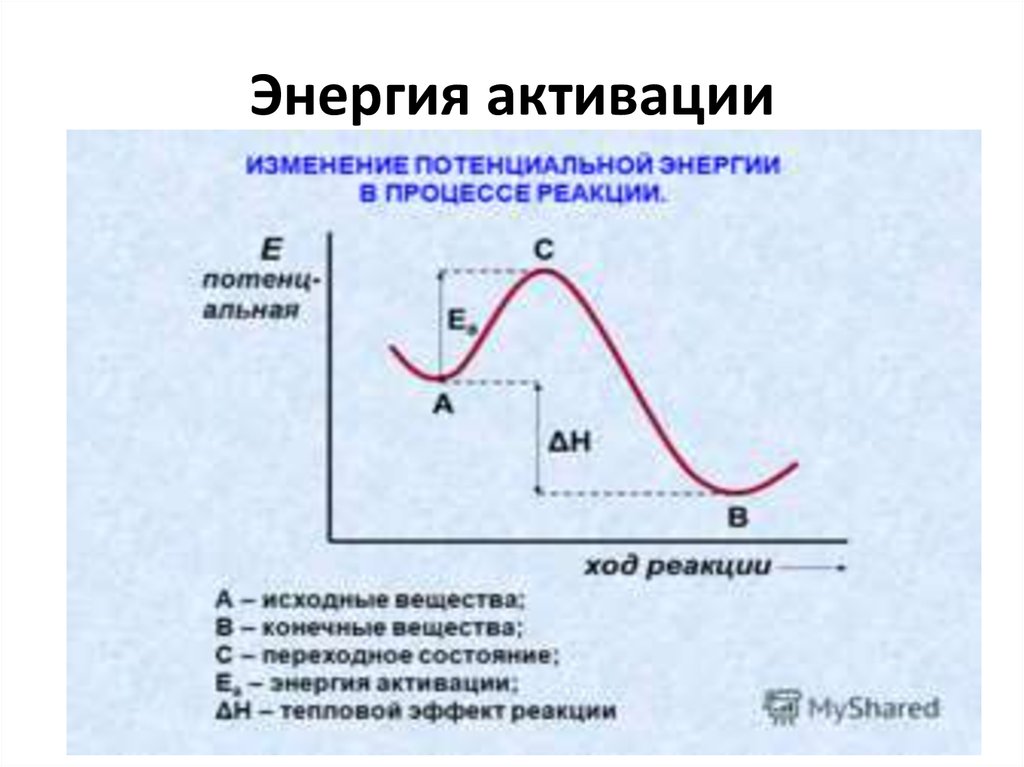
9. Энергия активации
Энергия активации. В большом числе случаев зависимость k от T может бытьприближенно описана уравнением Аррениуса:
k A e -E/RT ,
где T — абсолютная температура, A и E — параметры, в первом приближении не
зависящие от T.
Параметр E называется энергией активации, а параметр A — предэкспоненциальным множителем. Иногда предэкспоненциальный множитель обозначают не
через A, а через ko. Тогда уравнение Аррениуса принимает вид:
k ko e
-E/RT
.
10. Правило Вант-Гоффа
Правило Вант-Гоффа: В интервале температур от 0 оС до 100 оС при повышениитемпературы на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
11. Формальная кинетика
• Формальная кинетика — это раздел кинетики,рассматривающий временной ход превращений
вне связи с конкретной природой объектов,
участвующих в превращении. Для формальной
кинетики важна лишь математическая форма
уравнений, описывающих кинетику превращения,
но не детальная природа превращения. Например,
формальная кинетика одинакова для двух таких
разных процессов, как распад или изомеризация
молекул (это — химические процессы) и
радиоактивный распад атомных ядер (это —
физический процесс).
12. Закон действующих масс
• Кинетический закон действующих масс былсформулирован в шестидесятые годы XIX в.
Тогда его формулировали так: скорость
химической реакции пропорциональна
концентрации взаимодействующих частиц.
• Сегодня ясно, что в такой формулировке закон
действующих масс справедлив только для
простых реакций, т. е. он формулируется так:
скорость простой химической реакции
пропорциональна концентрации
взаимодействующих частиц.
13. Мономолекулярные реакции
Рассмотрим необратимое мономолекулярное превращение частиц A в частицы B:A B .
dC( t)
k C( t)
1
dt
Это и есть закон действующих масс для мономолекулярных реакций в дифференциальной форме. Он имеет вид дифференциального уравнения первого порядка.
Размерность константы скорости [k1] = [t–1] = [с–1].
Интегральная форма закона действующих масс
Интегрируя уравнение
dC( t)
k C( t) в пределах по концентрации от Co до C(t) и по
1
dt
времени от 0 до t, получаем
C(t) C e
o
k t
1
,
где Co – начальная концентрация вещества A, а k имеет размерность с-1, [k1] = [с-1].













 Химия
Химия








