Похожие презентации:
Обмен веществ. Регуляция углеводного обмена. (Лекция 2)
1.
Регуляция углеводного обмена2.
50% энергетическихпотребностей
Углеводы [C(H2O)]n
Моносахариды
Гексозы
6
5
4
6
CH2 OH
O
2
3
5
1
4
CH2 OH
O
5
1
2
4
3
Глюкоза
Пентозы
6
2
3
Глюкоза
6
CH2 OH
O
5
1
HOCH2 CH2 OH
O
1
5
2
4
Галактоза
HOCH2
O
4
3 2
5
HOCH2
O
1
4
3 2
Фруктоза
Рибоза
2-Дезоксирибоза
Дисахариды
CH2 OH
O
CH2 OH
O
O 4
с вязь
Глюкоза) Глюкоза)
1
Мальтоза
CH2 OH
O
1
CH2 OH
O
O
CH2 OH
HOCH2
O
O
O
CH2 OH
2
с вязь
Глюкоза) Фруктоза)
4
1
с вязь
Галактоза) Глюкоза)
Лактоза
Сахароза
Полисахариды
CH2 OH
O
CH2 OH
O
O
CH2 OH
O
O
с вязи
Крахмал, гликоген
CH2 OH
O
1
3
O
CH2 OH
O
O
с вязи
Целлюлоза
CH2 OH
O
3.
глюкагонкатехоламины
глюкокортикоиды
глюкагон
катехоламины
глюкокортикоиды
Источники глюкозы
пища
гликогенолиз
глюконеогенез
Глюкоза
крови
инсулин
транспорт
в клетку
инсулин
Утилизация глюкозы
гликолиз
пентозо-фосфатный путь
гликогенсинтез
4.
Переваривание и транспорт в клетки5.
Переваривание основных углеводов пищи.РР-панкреатический полипептид, CGRP-пептид,связанный с геном кальцитонина
Грелин,
инсулин,
дофамин,
бомбезин,
секретин,
ВИП,
вещество P,
гастрин
PP,
соматостатин,
CGRP
Крахмал, гликоген
слюнная,
панкреатическая
амилаза
Мальтоза
(1,4-связь)
Мальтазаглюкоамилаза
Глюкоза
Изомальтоза
(1,6-связь)
Сахаразаизомальтаза
Глюкоза
Блуждающий
нерв, ХЦК
Сахароза
Сахаразаизомальтаза
Глюкоза Глюкоза
Ингибиторы дисахаридаз:
антидиабетическое действие
Фруктоза
Пища
6.
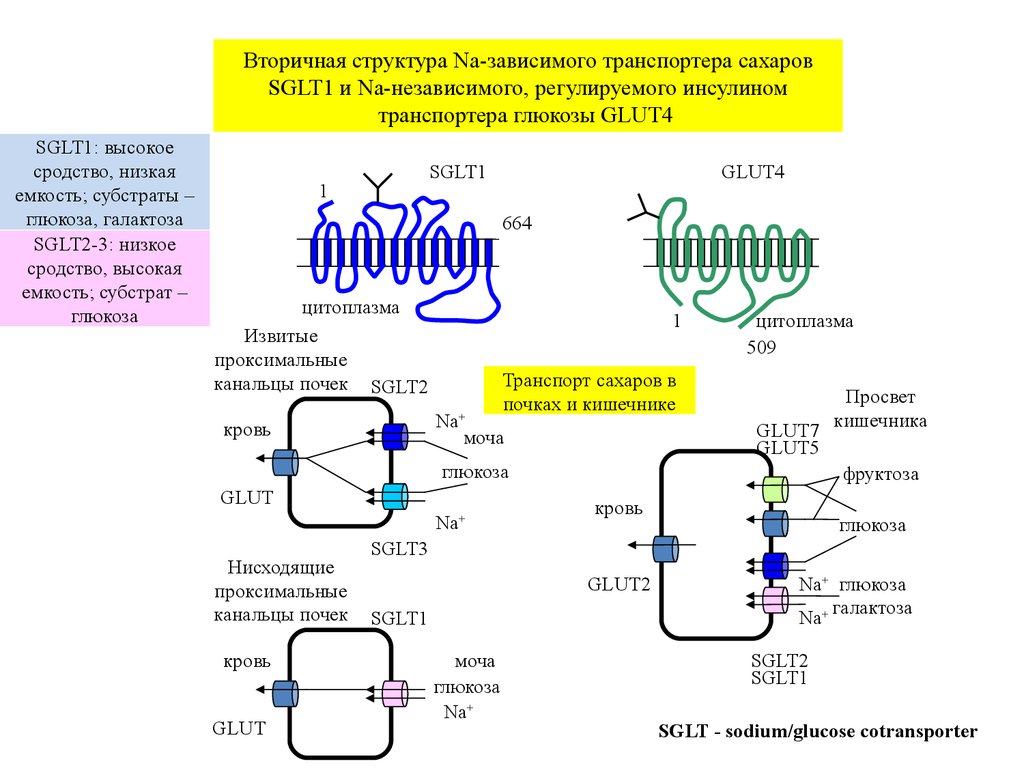
Вторичная структура Na-зависимого транспортера сахаровSGLT1 и Na-независимого, регулируемого инсулином
транспортера глюкозы GLUT4
SGLT1: высокое
сродство, низкая
емкость; субстраты –
глюкоза, галактоза
SGLT2-3: низкое
сродство, высокая
емкость; субстрат –
глюкоза
SGLT1
1
GLUT4
664
цитоплазма
Извитые
проксимальные
канальцы почек SGLT2
1
Транспорт сахаров в
почках и кишечнике
Na+
моча
кровь
цитоплазма
509
GLUT7
GLUT5
глюкоза
GLUT
Na+
Нисходящие
проксимальные
канальцы почек
кровь
GLUT
Просвет
кишечника
фруктоза
кровь
глюкоза
SGLT3
GLUT2
SGLT1
моча
глюкоза
Na+
Na+ глюкоза
галактоза
Na+
SGLT2
SGLT1
SGLT - sodium/glucose cotransporter
7.
В крови глюкоза находится в плазме и эритроцитах в приблизительноравной концентрации. Эритроциты – «циркулирующие гепатоциты»
(гипогликемия → выход свободной глюкозы и гликогенолиз)
Поступление глюкозы в большинство клеток организма ( кроме клеток кишечника и почек)
происходит по градиенту концентрации путем диффузии, облегчаемой транспортерами GLUT – 14 изоформ
Сродство транспортеров к глюкозе
адаптировано к типу клеток
20-50 мМ
Km для
глюкозы
Транспорт
глюкозы
max
GLUT-2 (почки,
печень, кишечник)
GLUT-1 (многие клетки)
GLUT-4 (адипоциты,
скелетные мышцы)
GLUT-3
GLUT-1,4
Независимый
от инсулина
транспорт
GLUT-2
0
1-5 мМ
GLUT-3 (нейроны)
0
3
5
9
Физиологический диапазон
Инсулин стимулирует встраивание в мембрану
адипоцитов GLUT-1 и GLUT-4, а в скелетной мышце только GLUT-4
(через активацию PI3K и ПК-В)
Глюкоза, мМ
20
8.
Тканевой обмен9.
Распределение глюкозы между путями обменаГлюкоза
Пентозофосфатный
путь
Гликогенез
Гликоген
Г-6-Ф
CO2 + НАДФH
Гликогенолиз
Глюконеогенез
Гликолиз
Триозы + АТФ
Гликогенез и гликогенолиз – в печени, мышцах, эритроцитах
Глюконеогенез – в печени, почках, очень незначительно – в кишечнике
Пентозо-фосфатный путь активен в тканях с интенсивным биосинтезом липидов
(печень, жировая ткань, гонады)
10.
Пентозо-фосфатный путьГлюкозо-6-фосфатдегидрогеназа,
6-фосфоглюконатдегидрогеназа
CO2 + HAДФН
Киназа фосфорилазы
Глюкоза
Глюкозо – 6 -фосфатаза
Гликогенфосфорилаза
гексокиназа
Глюкозо-6-фосфат
Глюкозо– 1-фосфат
PFK2
FBPase2
Фруктозо – 6 фосфат
Фруктозо- 1,6 - бифосфатаза
Фруктозо – 2,6-бифосфат
фосфофруктокиназа
Фруктозо-1,6 - бифосфат
фосфоенолпируваткарбоксикиназа
оксалацетат
пируваткарбоксилаза
фосфоенолпируват
пируваткиназа
пируват
+АТФ
Ацетил – Ко А
пируватдегидрогеназа
Киназа пируватдегидрогеназы
гликоген
гликогенсинтаза
УДФглюкоза
Киназа 3
гликогенсинтазы
11.
Регуляция гликолиза12.
Доменная организация гексокиназГлюкоза
регуляторный
домен
каталитический
домен
(ингибирование
продуктом)
1
917
Гексокиназа I
1
917
Гексокиназа II
1
923
Гексокиназа III
465
Гексокиназа IV
(глюкокиназа)
гидрофобный
фрагмент
1
(заякоривание на
митохондриях)
(печень, кишечник,
мозг, β-клетки п/ж)
Мышца
Покой
Глюкоза
Лимитирующая
стадия
Проникновение
в клетку (GLUT)
Образование Г6-Ф
(гексокиназа II)
Работа
Лимитирующая
стадия
Г-6-Ф
13.
Фрагмент промоторной области гена гексокиназы II человека.SRE – стеринчувствительный элемент, CRE - cAMP-чувствительный элемент
C/EBP – белок, связывающий ССААТ/энхансер
адреналин
инсулин
цАМФ
[экспрессия]
-369
SRE
C/EBP
CREB
SREBP-1
SRE
CRE
-279
В скелетной мышце экспрессия гексокиназы II однонаправленно
регулируется инсулином и адреналином
14.
Промоторы гена глюкокиназы«Нейроэндокринный промотор»
дистальный
промотор
Промотор, работающий
исключительно в печени
проксимальный
промотор
мРНК
глюкокиназы
«Печеночный промотор» индуцируется инсулином: через 3ч экспрессия гена возрастает
в 15 – 30 раз
«Нейроэндокринный промотор» работает в бета- и альфа-клетках поджелудочной железы,
определенных нейронах гипоталамуса, энтероцитах тонкого кишечника.
«Нейроэндокринный промотор» в клетках островков Лангерганса работает конститутивно.
Влияние инсулина или повышенных концентраций глюкозы на этот промотор - менее, чем
в 1,5 раза. Действие, в основном, - на уровне стабилизации мРНК глюкокиназы.
15.
Инсулин стимулирует активность ряда транскрипционных факторов,взаимодействующих с проксимальным промотором гена глюкокиназы.
HIF – индуцируемый гипоксией фактор; HNF – ядерный фактор гепатоцитов; SREBP – белок,
взаимодействующий со стеринчувствительным элементом (SRE) ; PKB – протеинкиназа B;
PI3K – фосфатидилинозитид-3-киназа; Fru-2,6-P2 – фруктозо-2,6-бифосфат
Г-6-Ф Гексокиназа
Инсулин
Прием пищи
PI3K
Глюкокиназа
SREBP-1c
Глюкоза
эугликемия
мРНК
p300
SREa
Глюкокиназа печень, кишечник,
мозг, β-клетки п/ж)
Fru-2,6-P2
PKB
-205
SREb
-181
HIF-1
-87
HNF-4α
-52
Регуляция активности глюкокиназы (GK) на посттрансляционном уровне путем обратимой
инактивации регулирующим глюкокиназу белком (GKRP). А: натощак; Б: после приема пищи
А
цитоплазма
GKRP →↓толерантности
к глюкозе
[глюкоза]
Б
глюкозо-6-Ф
GK
GK
GKRP
Ядро
глюкоза
GK
GKRP
Ядро
GKRP
Ядро
16.
Fru-1,6-P2Бифункциональный фермент 6-фосфофрукто-2-киназа/фруктозо-2,6бифосфатаза-2 (PFK2/FBPase2) определяет уровень минорного метаболита
фруктозо-2,6-бифосфата (Fru-2,6-P2), активирующего фосфофруктокиназу
(PFK1) и ингибирующего фруктозобифосфатазу (PBPase1)
Глюкоза
Fru-2,6-P2
PFK2
Fru-6-P
Субъединицы фосфофруктокиназы
(PFK) мышечного (M), печеночного
(L) и тромбоцитарного (P) типа с
сайтами фосфорилирования
PFKM
779
PFKL
779
PFKP
784
мышца
печень
PFKM
PFKM
PFKM
PFKM
PFKL
PFKL
PFKL
PFKL
эритроциты
PFKM PFKM PFKM
PFKM PFKM PFKL
PFKM PFKL PFKL
PFKL PFKL PFKL
FBPase1
FBPase2
PFK1
Fru-1,6-P2
Пируват
Fru-2,6-P2
17.
Доменная организация и фосфорилируемые остатки изозимовPFK2/FBPase2 человека
Варианты L и M
альтернативного
сплайсинга
33
PFK-2
P
Отсутствие
в мышце
471
29
FBPase-2
PFKFB1 (печень)
регуляция ПК-А
483
475
466 505
PFKFB2 (сердце)
P
PPP
471
461
520
PFKFB3 (мозг/плацента)
PP
444 469
PFKFB4 (семенники)
Изозимы отличаются
P
по соотношению
киназной и фосфосфатазной
активностей. При фосфорилировании PFKFB1 активность смещается с киназной на фосфатазную.
18.
ГлюкагонXu-5-P
Инсулин
PP2A
PKA
P
Fru-6-P
PFK2
FBPase2
Fru-2,6-P2
При высоком уровне инсулина и низком уровне глюкагона фермент дефосфорилируется и действует
в качестве киназы, что ведет к синтезу Ф-2,6-Ф2. Аналогично действует протеинфосфатаза 2А.
При снижении уровня инсулина и повышении концентрации глюкагона фермент фосфорилируется,
киназная активность утрачивается, появляется фосфатазная активность.
19.
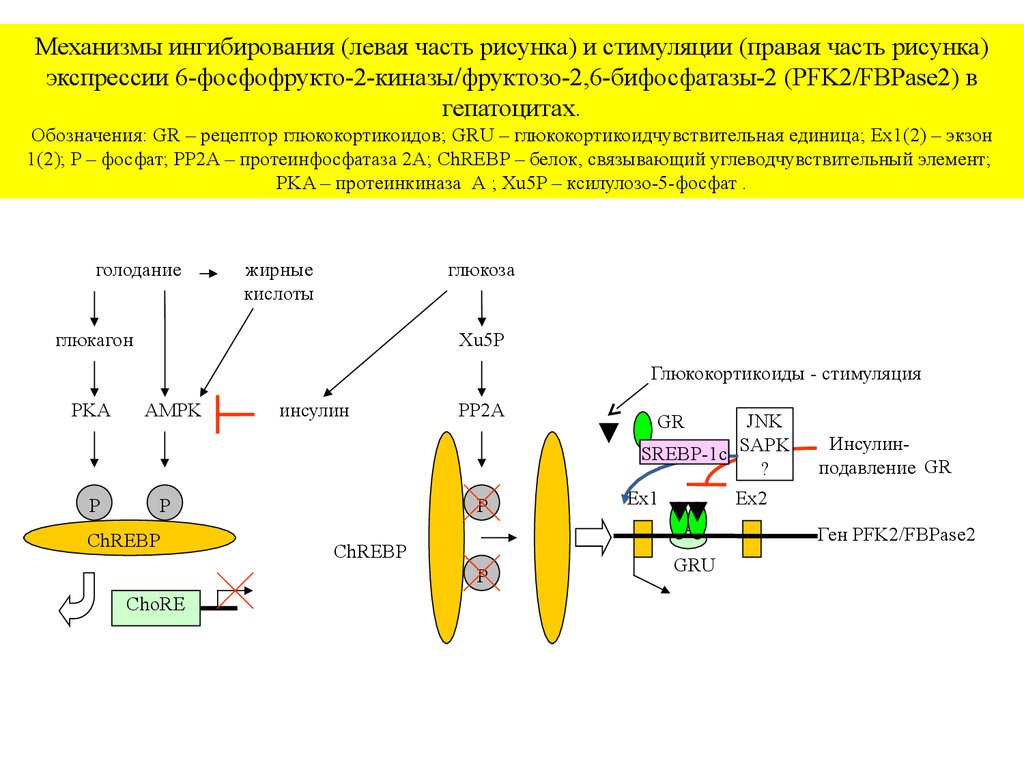
Механизмы ингибирования (левая часть рисунка) и стимуляции (правая часть рисунка)экспрессии 6-фосфофрукто-2-киназы/фруктозо-2,6-бифосфатазы-2 (PFK2/FBPase2) в
гепатоцитах.
Обозначения: GR – рецептор глюкокортикоидов; GRU – глюкокортикоидчувствительная единица; Ex1(2) – экзон
1(2); P – фосфат; PP2A – протеинфосфатаза 2A; ChREBP – белок, связывающий углеводчувствительный элемент;
PKA – протеинкиназа A ; Xu5P – ксилулозо-5-фосфат .
голодание
жирные
кислоты
глюкоза
глюкагон
Xu5P
Глюкокортикоиды - стимуляция
PKA
P
AMPK
инсулин
P
ChREBP
PP2A
P
Инсулинподавление GR
Ген PFK2/FBPase2
ChREBP
P
ChoRE
JNK
SREBP-1c SAPK
?
Ex1
Ex2
GR
GRU
20.
Локализация сайтов фосфорилирования в молекуле ChREBP.NLS – сигнал ядерной локализации; DBD – структура спираль-петля-спираль (ДНК-связывающий домен);
ZIP – лейциновая «застежка-молния»; PKA – протеинкиназа A; AMPK – АМФ-зависимая протеинкиназа.
PKA
P1
глюкагон
P4 P2P3
NLS
DBD ZIP
AMPK
864
жирные
кислоты
Дефосфорилирование ChREBP активированной PP2A ведет к транслокации его в клеточное
ядро и повышению его связывания с ДНК, в результате интенсивность транскрипции
чувствительных
генов возрастает.
ChREBP экспрессируется везде, но наиболее интенсивно – в печени, буром и белом жире,
тонкой кишке, почках и мышцах. Экспрессия в печени стимулируется глюкозой, в адипоцитах
стимулируется инсулином, глюкозой, подавляется жирными кислотами.
21.
пируваткиназафосфоенолпируват
PKR
574
PKL
PKM1
PKM2
531
Альтернативный
сплайсинг
Альтернативный
сплайсинг
пируват +АТФ
4 Изоформы пируваткиназы (PK)
эритроцитарного (R), печеночного (L),
мышечного (M) типа возникают в результате
альтернативного сплайсинга продуктов двух
генов. Показаны сайты фосфорилирования
Пируваткиназа функционирует в форме гомотетрамеров
22.
Механизмы ингибирования (левая часть рисунка) и стимуляции (праваячасть рисунка) экспрессии пируваткиназы печеночного типа (LPK)
Xu5P – ксилулозо-5-фосфат; PP2A - протеинфосфатаза
голодание
жирные
кислоты
глюкоза
инсулин
глюкагон
Xu5P
Регуляторы
?
PKA
AMPK
инсулин
?
PP2A
ChREBP/Mlx
P
P
ChREBP
P
-170
HNF4α
-126
ChoRE
ChREBP
P
мРНК LPK
ChoRE
Mlx - family of basic helix-loop-helix leucine zipper (bHLHZip) transcription factors
23.
Регуляция активности пируватдегидрогеназы фосфорилированиемэугликемия
НАДH
цикл
Кребса
CO2
ацетил-КоА
глюкоза
пируват
[блок использования пирувата
пируватдегидрогеназа
для глюконеогенеза]
активная
голодание
диабет
глюкоза
цикл
Кребса
CO2
НАДH
липосинтез
ацетил-КоА
пируват
липосинтез
пируватдегидрогеназа
неактивная
Гетеротетрамерная
пируватдегидрогеназа
Обозначен кластер сайтов
фосфорилирования в α-субъединице
α
β α
P
АТФ
киназа
пируватдегидрогеназы
(экспрессия)
(экспрессия)
β
Сайты различаются по
доступности для разных
изозимов киназы и фосфатаз
глюкокортикоиды (ГК-Рц)
жирные кислоты (PPAR )
инсулин
Множественность сайтов
фосфорилирования
пируватдегидрогеназы обеспечивает
тканеспецифичность регуляции
активности
24.
Модель гормональной регуляции экспрессии гена киназыпируватдегидрогеназы (PDK 4) человека. А: в присутствии глюкокортикоидов;
Б: в присутствии глюкокортикоидов и инсулина
А
Б
инсулин
GRE
IRS1
GR
FOXO
P300/
FOXO CBP
IRS2
PI3K
FOXO
PI-3,4-P2
коактиваторный
комплекс
Базальный
транскрипционный
компдекс
P300/
CBP
PKBинактивирующее
фосфорилирование
FOXO
PDK4
GR
Базальный
транскрипционный
компдекс
IRS3
GRE IRS1 IRS2 IRS3
PDK4
25.
выход из ядрав цитоплазму,
снижение
связывания с ДНК
и коактиваторами
IR genes – инсулинчувствительные гены, Akt – протеинкиназа В, P-FoxO – фосфорилированный
транскрипционный фактор, содержащий вилкоголовый блок О (Forkhead box O).
26.
Регуляция глюконеогенеза27.
Лимитирующие глюконеогенез ферментыГлюкоза
Pi
Глюкозо-6-фосфатаза
Глюкозо-6-фосфат
Pi
Фруктозо-1,6-бифосфатаза
Фруктозо-1,6-бифосфат
АТФ
CO2
ГТФ
Фосфоенолпируват
Фосфоенолпируваткарбоксикиназа
Оксалоацетат
CO2
АТФ
Пируваткарбоксилаза
Пируват
В печени ферменты регулируются на транскрипционном уровне: индуцируются катехоламинами,
глюкагоном, глюкокортикоидами и ингибируются инсулином
28.
Тканеспецифичные функции оксалоацетата (и пируваткарбоксилазы)глюкокортикоиды (стресс)
глюкагон (голодание)
катехоламины (работа, стресс)
Пируват
Пируваткарбоксилаза
Инсулин
(прием
пищи)
Оксалоацетат
цикл
Кребса
(везде)
Глюконеогенез
через
фосфоенолпируват
(печень, почки)
Липосинтез через
транспорт ацетилCoA в цитоплазму
и через малат –
поставщик
НАДФH
(печень,жир)
Образование
нейромедиаторов
глутамата и ГАМК
(ЦНС)
Стимуляция
секреции инсулина
(поджелудочная
железа)
В органах глюконеогенеза и липосинтеза
активен проксимальный промотор,
а в β-клетках поджелудочной железы –
дистальный
29.
ФосфоенолпируваткарбоксикиназаМитохондриальный фермент
экспрессируется конституитивно,
цитозольный изозим регулируется
гормонами.
оксалацетат фосфоенолпируват
В печени активация экспрессии
глюкокортикоидами, глюкагоном,
катехоламинами,
торможение инсулином
печень
глюконеогенез
адипоциты
В адипоцитах
глюкокортикоиды
тормозят экспрессию
гена PEPCK, способствуя
выходу ЖК в кровь
глицеронеогенез
(сохранение жирных кислот
в виде ТАГ в адипоцитах)
30.
Предполагаемый механизм тканеспецифичности действияглюкокортикоидов на транскрипцию цитозольной PEPCK.
Обозначения: P = PPAR ; R = RXR; G = GR; C = COUP-TF; H = HNF4; ASE =
специфичный для адипоцитов энхансер; GRU = глюкокортикоидчувствительная
единица; BTC = базальный транскрипционный комплекс; Ex1 = экзон 1 PEPCK.
Стрелками указаны направления прямых повторов PPRE
Адипоциты
Конечные эффекты:
+
+
жирная
кислота
Ex1
Блокада
глицеронеогенеза →
выход жирных
кислот в кровь
Ex1
Стимуляция
глюконеогенеза →
выход глюкозы в
кровь
P R
R P
G G
ASE
G G
BTC
GRU
Гепатоциты
+
C H
глюкокортикоид
G G
G G
GRU
+
BTC
31.
2 изозима: специфичный для печениспецифичный для мышц
Фруктозо-1,6-бифосфатаза
Фруктозо-1,6-бифосфат
Фруктозо – 6 фосфат
Глюкозо-6-фосфат
мышцы
Синтез гликогена
печень
Секреция глюкозы
32.
Оперативная регуляция активности фруктозо-1,6-бифосфатазы печеночного типаГлюкоза
Фруктозо-1,6-бифосфатаза
ПК-A
Фруктозо-2,6-бифосфат
АМФ
Недостаток энергии
Глюкагон
катехоламины
Глюкагон, катехоламины повышают экспрессию гена за счет
наличия в промоторе цАМФ-чувствительных элементов,
глюкокортикоиды оказывают небольшой стимулирующий эффект.
Инсулин оказывает ингибирующее действие.
33.
Глюкозо – 6 - фосфатазаГлюкозо -6-фосфат
Глюкоза
Полипептид с 9 трансмембранными доменами, встроенный в мембрану ЭР,
работающий в кооперации с транспортерами субстрата и продукта.
Обнаруживается в печени, почках, кишечнике.
34.
Пути гормональной регуляции экспрессии гена глюкозо-6-фосфатазы (G6Pase).PI3K – фосфатидилинозитид-3-киназа; PIP3 – фосфатидилинозитид-3,4,5-трифосфат; PDK1 PIP3 – зависимая киназа 1; PKB – протеинкиназа B; Foxo – транскрипционный фактор,
содержащий вилкоголовый блок O (Forkhead box O); IRS – инсулинчувствительная
последовательность; cAMP – циклический аденозинмонофосфат; PKA – протеинкиназа A;
CREB – белок, связывающий CRE; CRE - cAMP-чувствительный элемент; GR – рецептор
глюкокортикоидов; GRE – глюкокортикоидчувствительный элемент; P – фосфат; числами
отмечены положения нуклеотидов относительно старта транскрипции.
Инсулин
Катехоламины
Глюкагон
PI3K
PIP3
PDK1
Инсулин ингибирует
экспрессию гена
P
PKB
P
PKA
CREB
P
Foxo Foxo
IRS1 IRS2
CRE1
-196
GRE-A
cAMP
CRE2
-115
GRE-B
мРНК G6Pase
+1
GRE-C
GR
Глюкокортикоиды
Глюкокортикоиды,
катехоламины,
глюкагон стимулируют
экспрессию гена,
препятствуют действию
инсулина
G6Pase → болезнь Гирке (гипогликемия,
гепатомегалия (избыток гликогена))
35.
Дополнительные пути регуляции экспрессии глюкозо-6-фосфатазыIRS1- адапторный белок, субстрат 1 рецептора инсулина , FXR – рецептор Х фарнезоидов,
SHP-малый партнер гетеродимеризации, PGC-1 – коактиватор PPARγ (усиливает
транскрипционную активность HNF-4, FOXO и др.)
Голодание
АМФ
Адипонектин
AMPK
FXR
Желчные
кислоты
Инсулин
IRS1
SHP
Foxo
RXR
Инсулин
PGC1
цАМФ
Адреналин
глюкагон
G6Pase
36.
Активен в тканях синтенсивным биосинтезом
липидов: печень, адипоциты,
гонады
Пентозо-фосфатный путь
OH
O
H2 PO3 -O-CH2 -CH-CH-CH-CH-CH
OH OH
OH
НАДФ +
НАДФH
Глюкозо-6-Ф
Глюкозо-6-Фдегидрогеназа
OH
O
H2 PO3 -O-CH2 -CH-CH-CH-CH-C-OH
OH OH
OH
НАДФ +
НАДФH
6-Ф-Глюконатдегидрогеназа
CO2
O
H2 PO3 -O-CH2 -CH-CH-CH-CH2
OH OH
OH
синтез липидов
Глюкозо-6-Ф + 12НАДФ
SREBP1c
6-Ф-Глюконат
PI3K
инсулин
[промежуточные
продукты]
SREBP1c
PI3K
Рибулозо-5-Ф
синтез нуклеиновых кислот
6CO2 + 12НАДФH + Фн
Липосинтез, синтез пентоз, входящих в состав нуклеиновых кислот
инсулин
Xu-5-P
стереоизомер
37.
Гликогенез и гликогенолиз38.
Гликоген – 5% массы печени, что у человекаэквивалентно 70-90г глюкозы – эугликемия до
12 – 24 ч.
Гликогенсинтаза – 2 изозима
мышечного (активация инсулином
более важна) и печеночного типа
(активация глюкозой)
39.
Гормональная регуляция синтеза гликогена в мышце и печениGLUT4
Инсулин
Инсулин Катехоламины
глюкагон
PI3K
PKB
Глюкоза
Гексокиназа
Глюкозо-6-Ф
PKA
Глюкозо-1-Ф
УДФ-глюкоза
Глюкозо-6-Ф
Гликоген
-синтаза
GSK3
P
Каталитический
домен
активен
P
P
неактивная
неактивен
Фосфатаза
Гликоген
-синтаза
P
P
P
P
Гликоген
-синтаза
P
активная в
присутствии
глюкозо-6-Ф
Фосфорилирование N-конца GSK3 (киназа 3 гликогенсинтазы) формирует псевдосубстрат
активная
Гликоген
40.
АМФАТФ, АДФ, гл-6-Ф
3 изозима: мышечного,
печеночного и мозгового типа
Гликогенфосфорилаза
гликоген
глюкозо – 1- фосфат
глюкозо – 6 - фосфат
Регуляция активности гликогенфосфорилазы
гормоны
Киназа
фосфорилазы
Фосфатаза
Фосфорилаза b
неактивная
Фосфорилаза a
активная -гомотетрамер
Мутации субъединиц киназы
гликогенфосфорилазы –
наиболее частая причина
гликогенозов
41.
Phk – киназа фосфорилазы построена из трех регуляторных (α,β и δ) и каталитической (γ)субъединиц, причем каждая из них в ферменте представлена 4 молекулами, а каждая из субъединиц
представлена несколькими изоформами, что обеспечивает тканеспецифичность регуляции.
В отсутствие стимулов α- и β- субъединицы ингибируют активность γ.
Фосфорилирование α- и β- субъединиц ПК-А или в результате аутокатализа (аллостерическая
активация под действием АДФ в отсутствие внешних стимулов) снимает ингибирование.
Субъединица δ – конститутивно ассоциированный с ферментом кальмодулин, активирующий Phk
в присутствии кальция. В α- и β- субъединицах тоже есть участки зависимого от кальция связывания
«внешнего» кальмодулина (или тропонина С в мышцах), активирующего фермент в отсутствие ПК-А.
γ- субъединица включает каталитический (N) и регуляторный (С) домены. В регуляторном домене –
два сайта связывания кальмодулина.
Организация киназы фосфорилазы
α
Регуляция активности киназы фосфорилазы
Катехоламины
глюкагон
β
Ca
2+
CaM
γ
β
α
γ
Покой
Тропонин C
Ca2+
Катехоламины
Ca2+
ПК-A
β
α
δ
γ
активация
Снятие
ингибирования
42.
Регуляция обмена глюкозырежимом питания и физической нагрузкой
43.
Ксилулозо-5-фосфат в действии глюкозы на углеводный и липидный обмен в печениO
Глюкоза
Глюкоза
Пентозофосфатный шунт
Глюкокиназа
НАДФH
НАДФH
АДФ
Глюкозо-6-фосфат
а
олаз
т
е
к
с
Тран
PF2K/Pase
Фруктозо-6-фосфат
АТФ
Фосфофруктокиназа
Фруктозо-2,6АДФ
бифосфат
5
4
OH
2 1
HO-P-O-CH2-CH-CH-C-CH2OH
3
O
OH
O
ксилулозо-5-фосфат
АТФ
Фруктозо-1,6-бифосфат
а
ол
т
ке
нс
а
Тр
Глицеральдегид-3-фосфат
НАДH
Пируваткиназа
АТФ
Пируват
ChREBP →
↓толерантности
к глюкозе,
гиполипидемия
Ксилулозо-5-фосфат
PP2A
ChREBP
за
ACL ACC
Ацетил-КоА
FAS
Триглицериды
Цикл
Кребса
Обозначения: ACL - АТФ-цитратлиаза; ACC - ацетил-КоА-карбоксилаза; FAS - синтаза жирных кислот;
PP2A - протеинфосфатаза 2A; PF2K/Pase - 6-фосфофрукто-2-киназа/фруктозо-2,6-бифосфатфосфатаза;
простые стрелки - пути метаболизма, двойные стрелки - стимуляция.
44.
Регуляция режимом питанияЧеловек (покой)
CO2/O2 = 0,76
2/3 липидов и 1/3 углеводов
В мышце расход O2:
окисление
глюкозы 16%
Скелетная мышца
извлекает %
поступающей глюкозы:
Потребление глюкозы (покой)
покой
3-4%
скелетные
мышцы 17%
окисление
жирных кислот
84%
инсулин,
интенсивная
работа или
гипоксия 27%
мозг 62%
Прием пищи
сердце 12%
Инсулин
↓Глюкозы крови
ниже 3,3 мМ
Гематопоэтические клетки
Цитокины
Независимый от
инсулина механизм:
ненасыщенность
большинства GLUTs
↑Глюкозы крови
Инкретины:
глюкагоноподобный
пептид 1, вазоактивный
интестинальный пептид,
глюкагон, PACAP
Голодание
лактат (40-60%)
Экспрессия GLUT-1
Встраивание GLUT-1
↑Захвата глюкозы
Зависимый от
инсулина механизм:
встраивание GLUT-1 и
GLUT-4 в мембрану (в
мышце 75%→95%)
СТГ, глюкагон,
катехоламины,
глюкокортикоиды
↓Захвата глюкозы
↑Захвата глюкозы
45.
Интенсивная физическаянагрузка
Кратковременная
неинтенсивная физическая
активность
↓инсулина
↑глюкагона,
катехоламинов
глюкоза – основной поставщик
энергии в мышцах
Повышение потребления
мышцей ЖК и глюкозы
жирные
кислоты
глюкоза из
печени
Повышение окисления при сохранении
соотношения глюкоза/жирные кислоты
AMPK
сенсор энергообеспечения
встраивание
GLUT-4
46.
Тримерная активируемая АМФ киназа (AMPK) активируетсяфосфорилированием киназой AMPK (AMPKK) и образующимся при работе
АМФ, действующим прямо и через активацию AMPKK. Параллельно снимается
ингибирующее действие креатинфосфата, расходуемого при работе мышцы на
образование АТФ
АМФ
креатинфосфат
Фосфорилирование
субстратов
AMPKK
Повышение продукции
АТФ
P
каталитическая
субъединица
АМФ
γ
α
β
покой
Работа
Гипоксия
Рассопряжение
окисления и
фосфорилирования
работа
↑АМФ
AMPK
Активность регулируется
фосфорилированием и
аллостерической регуляцией
АМФ(+) и АТФ, креатинфосфатом (-)
↑захвата глюкозы
скелетной мышцей
47.
the tumor suppressor kinase complexCalcium-calmodulin
dependent protein kinase kinase β
Cardiovasc Pharm Open Access. 2015 August ; 4(3): .
48.
49.
За счет подавления биосинтеза и ускорения деградации малонил-CoA AMPKснимает его ингибирующее действие на транспорт жирных кислот в
митохондрии. MCD - малонил-CoA-декарбоксилаза; ACC - ацетил-CoA-карбоксилаза;
CPT - карнитинпальмитоилтрансфераза
Ацетил-CoA
P
AMPK
P
AMPK
ACC
ACC
MCD
MCD
неактивная
активная
активная
неактивная
Малонил-CoA
карнитин +
пальмитоил-CoA
CPT-1
наружная
мембрана
митохондрий
пальмитоилкарнитин
CPT-2
внутренняя
мембрана
митохондрий
карнитин +
пальмитоил-CoA
β-окисление
малонил-CoA - ингибитор фермента CPT-1 - карнитинпальмитоилтрансферазы
50.
51.
Эффекторы AMPKACC/MCD Нитроксидсинтаза Экспрессия
NOS
генов GLUT4,
гексокиназы,
β-окисление
ферментов
жирных
цГМФ
цикла
кислот
лимонной
встраивание
кислоты и
GLUT4 в
окисления
мембрану
жирных
кислот, белков
гликолиз
транспорта
электронов
Повышение энергообеспеченности
52.
53.
Translational Oncogenomics 2015:754.
World Journal of Surgical Oncology (2016) 14:1555. САХАРНЫЙ ДИАБЕТ
56.
Типы сахарного диабета, частота встречаемости,зависимость от пола и возраста
Частота
встречаемости
от всех типов
диабета
Возраст
появления
симптомов
Половая
зависимость
заболевания
Инсулинозависимый Инсулинонезависимый
сахарный диабет
сахарный диабет
типа I (ИЗСД)
типа II (ИНСД)
Юношеский
инсулинонезависимый сахарный
диабет (MODY)
25-30%
55-60%
15-20% от ИНСД
До 35 лет
После 35 лет
До 25 лет
Ж=М
Ж=М
Ж>М
MODY – matunity onset diabetes of the young
57.
Особенности механизмов возникновениясахарного диабета разного типа
MHCII - антигены главного комплекса
гистосовместимости человека HLA класса II,
участвующие в презентации антигенов
58.
Инфильтрациямоноцитами
Цитокины
Инфильтрация
цитотоксическими Тлимфоцитами, Т-супрессорами,
Т-хелперами
59.
Полигенный характер развитияинсулинорезистентности
Мутации:
Ген гликогенсинтазы,
Ген гормончувствительной липазы,
Ген бета3-адренорецепторов,
Ген фактора некроза опухолей альфа,
Ген разобщающего белка (UCP-1),
Ген транспортера глюкозы GLUT-4
Ген субстрата инсулинового рецептора (IRS-1),
Гены других компонентов сигнальных каскадов инсулина
60.
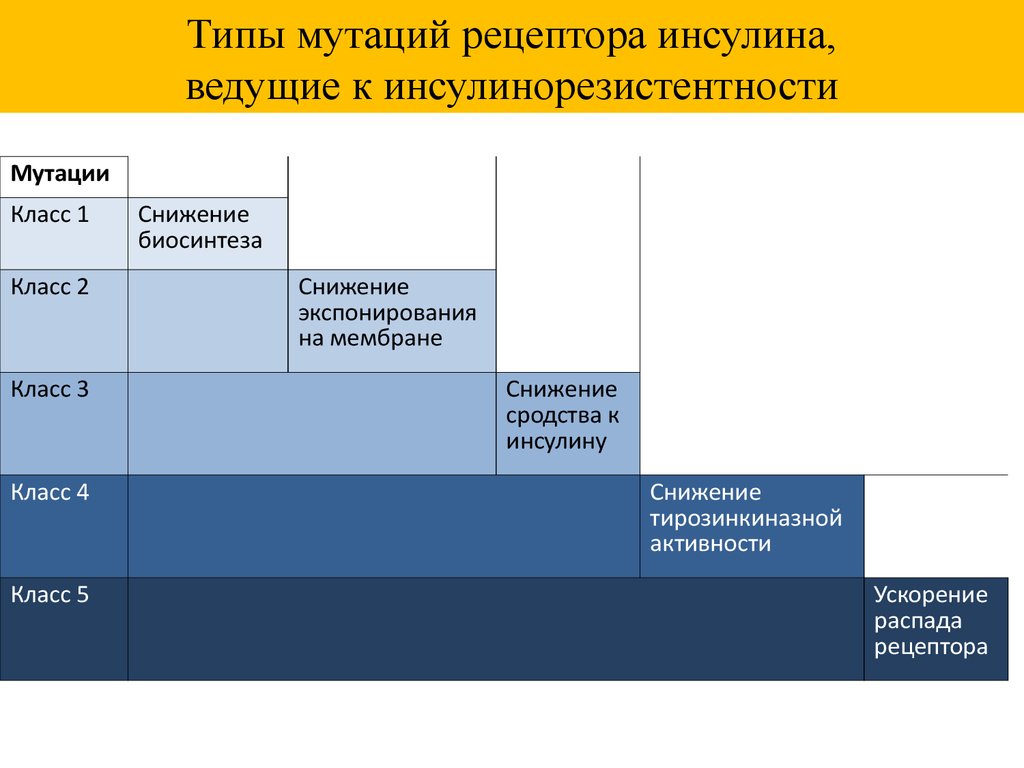
Типы мутаций рецептора инсулина,ведущие к инсулинорезистентности
Мутации
Класс 1
Класс 2
Класс 3
Класс 4
Класс 5
Снижение
биосинтеза
Снижение
экспонирования
на мембране
Снижение
сродства к
инсулину
Снижение
тирозинкиназной
активности
Ускорение
распада
рецептора
61.
Юношеский инсулинонезависимый сахарный диабет (MODY)Юношеский
инсулинонезависимый
сахарный диабет (MODY)
Участие
генетических факторов
Только генетические
Генетический(ие)
фактор(ы)
Мутации
единичных
генов,
обуславливающие развитие заболевания:
Мутация гена HNF*-4α (MODY1),
Мутация гена HNF*-1α (MODY3),
Мутация гена гексакиназы (MODY2)
Наличие аутоантител
Нет
Метаболические нарушения,
усиливающие предрасположенность
редко



























































 Биология
Биология Химия
Химия








