Похожие презентации:
Химия органических соединений. Углеводороды
1. Химия органических соединений
1Химия органических
соединений
2.
2му
о
дн
о
р
гле лету
у
по ске
Органические соединения
Ациклические
(алифатические)
Предельные
(насыщенные)
Непредельные
(ненасыщенные)
Алициклические
Циклические
Карбоциклические
Гетероциклические
Ароматические
3.
3R-
- Hal
-OH
галогенопроизводные
- NH2
амины (первичные)
- NO2
нитросоединения
- C ≡N
нитрилы
-C =O
H
-C – R
=
м
по льны
на
о
ци ппам
к
н
фу гру
спирты, фенолы
альдегиды
кетоны
-COOH
O
карбоновые кислоты
-COOR
сложные эфиры
- CONH2
амиды
- SO3H
сульфокислоты
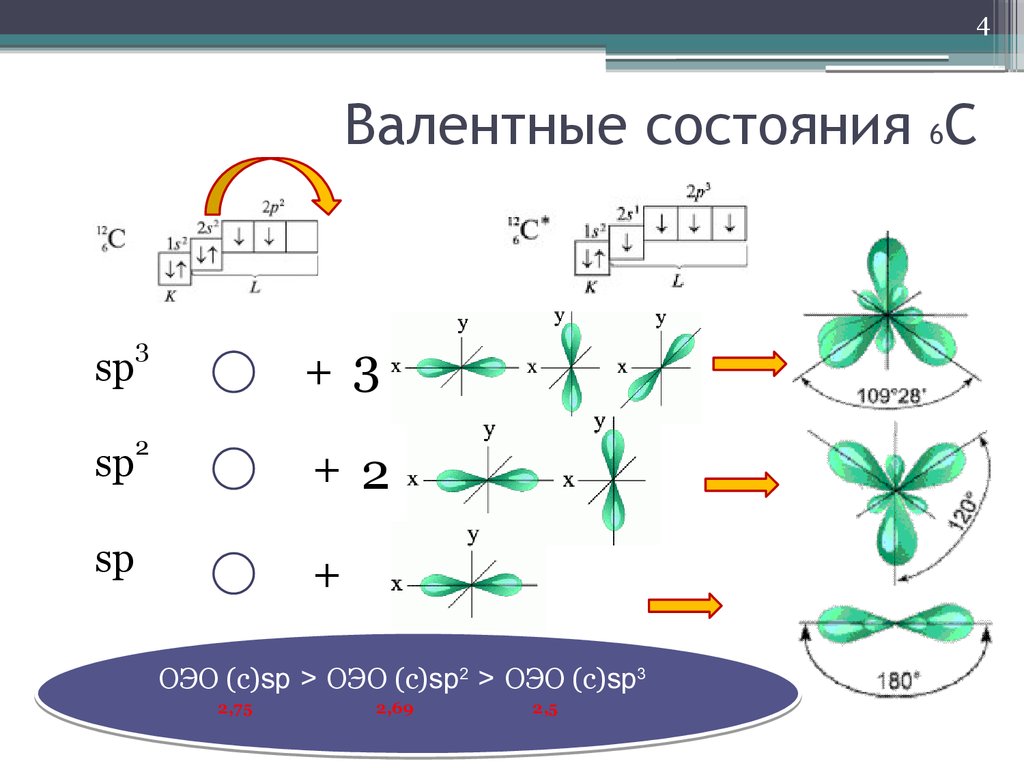
4. Валентные состояния 6С
4Валентные состояния 6С
sp
3
sp
2
+ 3
+ 2
sp
+
ОЭО (с)sp > ОЭО (с)sp2 > ОЭО (с)sp3
2,75
2,69
2,5
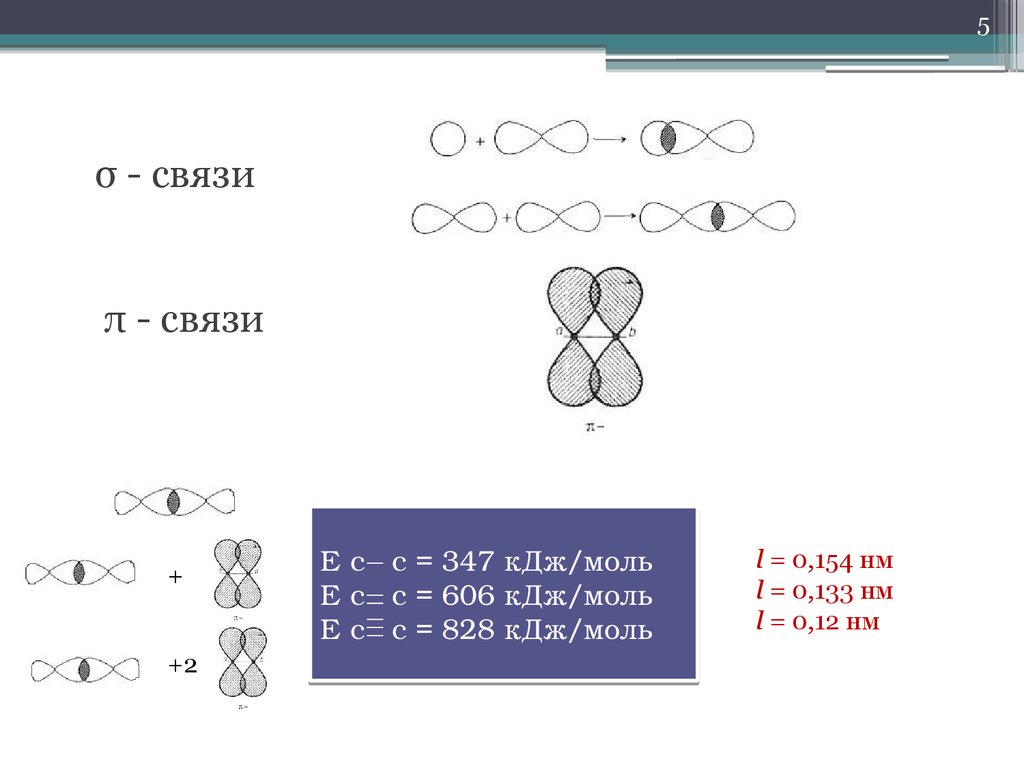
5.
5σ - связи
π - связи
+
+2
Е с с = 347 кДж/моль
Е с с = 606 кДж/моль
Е с с = 828 кДж/моль
l = 0,154 нм
l = 0,133 нм
l = 0,12 нм
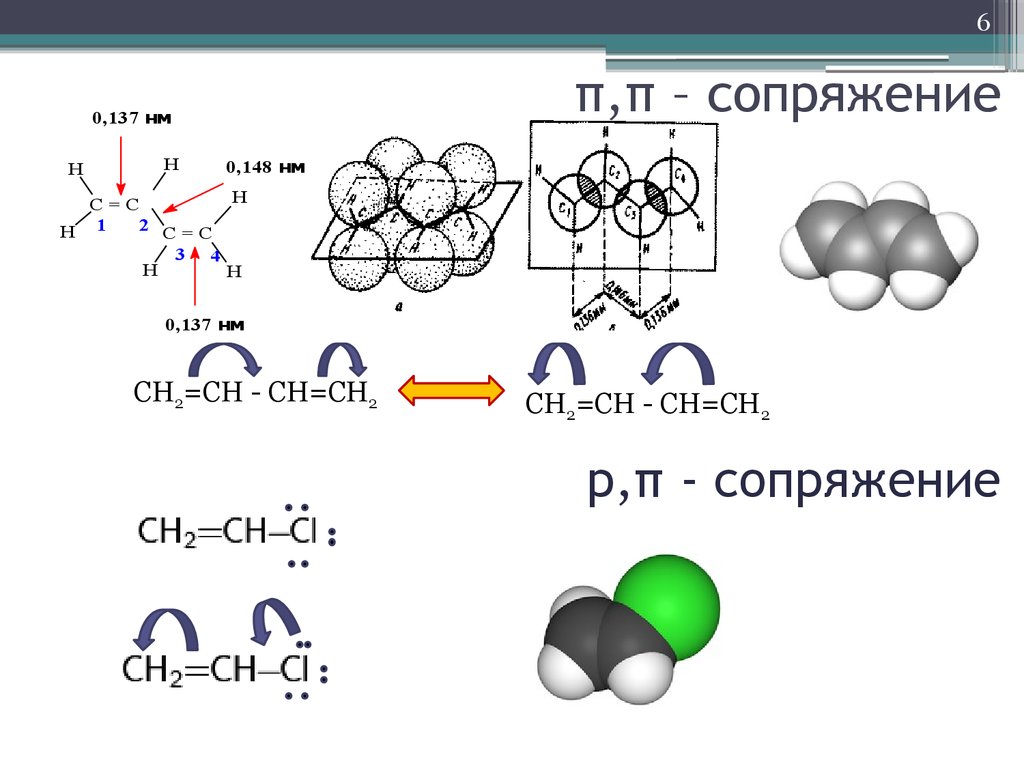
6. π,π – сопряжение
6π,π – сопряжение
0,137 нм
H
H
0,148 нм
H
C=C
2 C=C
H 1
3 4
H
H
0,137 нм
СН2=СН - СН=СН2
СН2=СН - СН=СН2
р,π - сопряжение
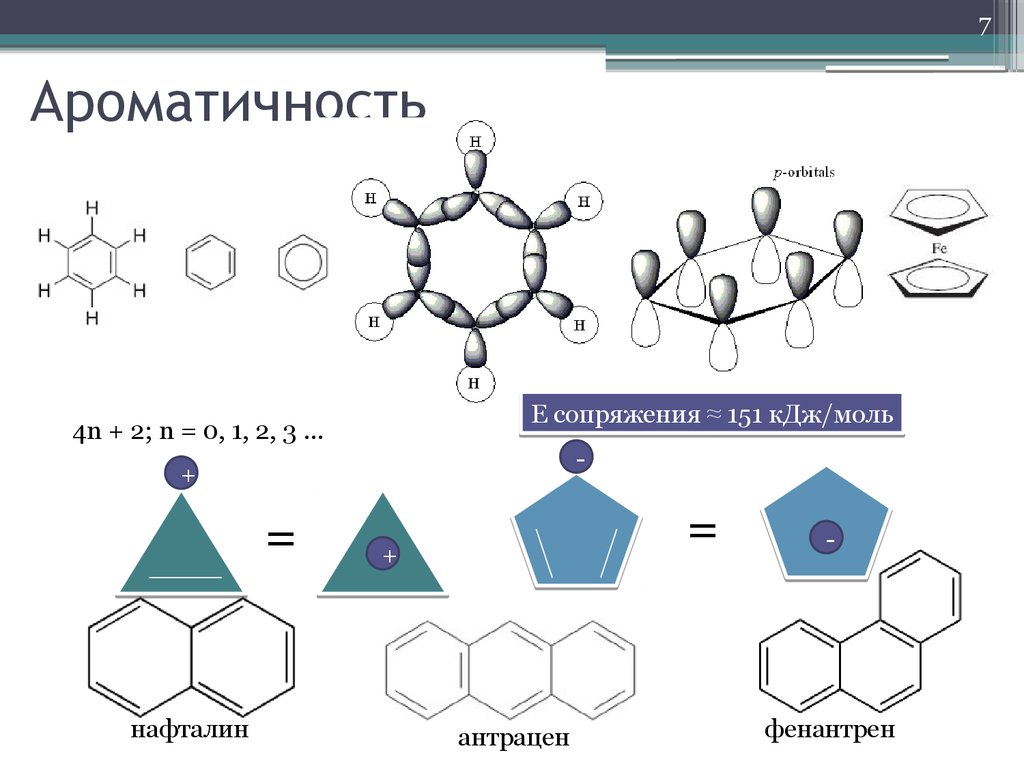
7. Ароматичность
7Ароматичность
Е сопряжения ≈ 151 кДж/моль
4n + 2; n = 0, 1, 2, 3 …
-
+
=
нафталин
=
+
антрацен
-
фенантрен
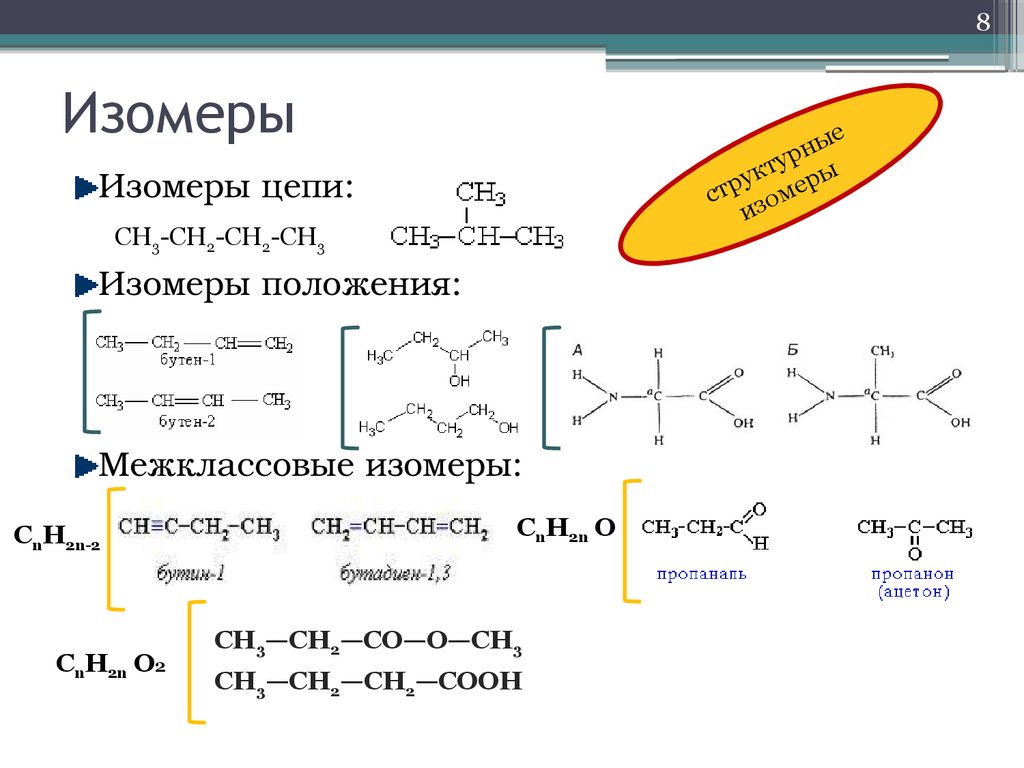
8. Изомеры
8Изомеры
ые
н
ур
т
к
у
ры
стр зоме
и
Изомеры цепи:
CH3-CH2-CH2-CH3
Изомеры положения:
Межклассовые изомеры:
CnH2n-2
CnH2n О2
CnH2n О
СН3—СН2—СО—О—СН3
СН3—СН2—СН2—СООН
9.
СтереоизомерыКонформационные (“поворотные”)
Конфигурационные:
• Энантиомеры (“зеркальные”)
• Диастереомеры
• σ—диастереомерия:
π—диастереомерия (геометрическая изомерия):
сте
еры
м
зо
и
о
ре
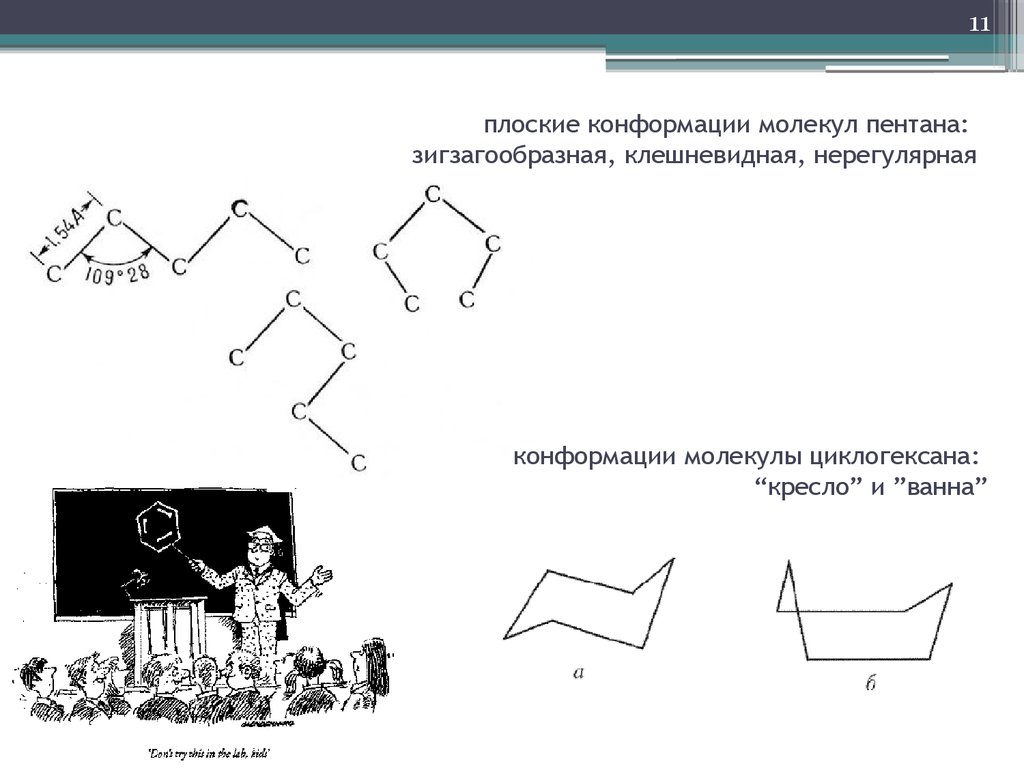
10. Конформеры
10Конформеры
11. плоские конформации молекул пентана: зигзагообразная, клешневидная, нерегулярная
11плоские конформации молекул пентана:
зигзагообразная, клешневидная, нерегулярная
конформации молекулы циклогексана:
“кресло” и ”ванна”
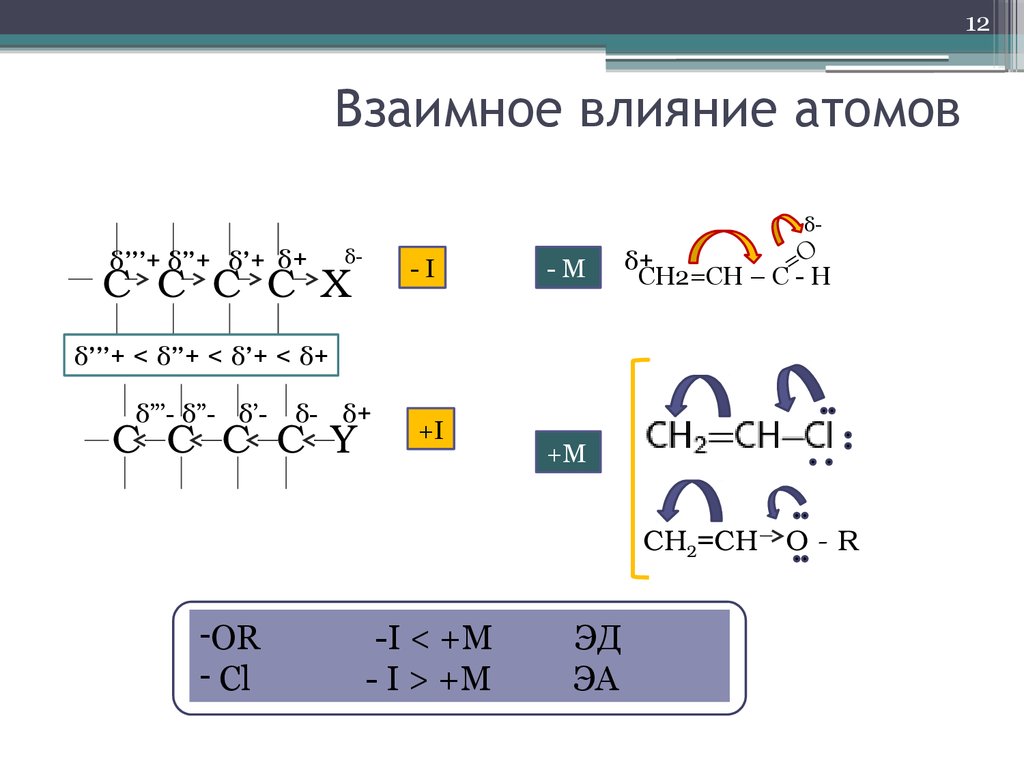
12. Взаимное влияние атомов
12Взаимное влияние атомов
δ-
δ’’’+ δ”+ δ’+ δ+
δ-
-I
С C C C X
-M
δ+
=O
CH2=CH – C - H
δ’’’+ < δ”+ < δ’+ < δ+
δ”’- δ”- δ’- δ- δ+
C C C C Y
+I
+M
CH2=CH O R
-OR
- Cl
-I < +M
- I > +M
ЭД
ЭА
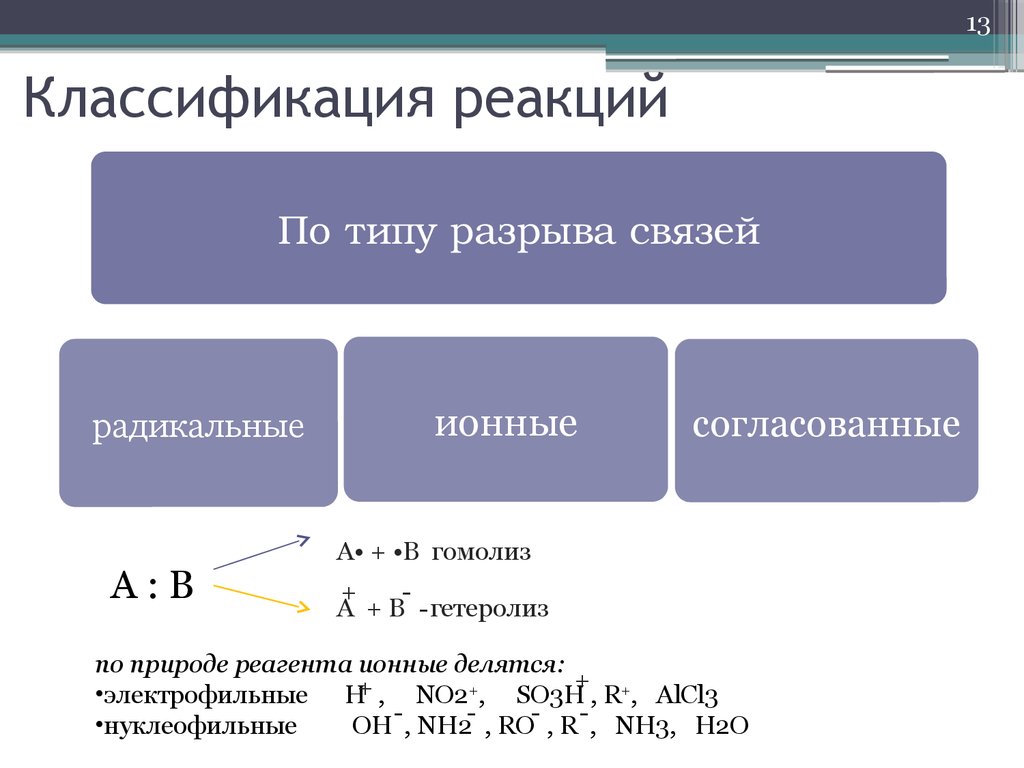
13. Классификация реакций
13Классификация реакций
По типу разрыва связей
радикальные
A:B
ионные
согласованные
A• + •B гомолиз
+
A + B - гетеролиз
по природе реагента ионные делятся:
+
•электрофильные H+ , NO2+, SO3H , R+, AlCl3
•нуклеофильные
OH , NH2 , RO , R , NH3, H2O
14.
14По конечному результату
реакции замещения S
реакции
присоединения - A
реакции
элиминирования - E
реакции
перегруппировки
реакции
окисления и
восстановления
По порядку реакции (молекулярности)
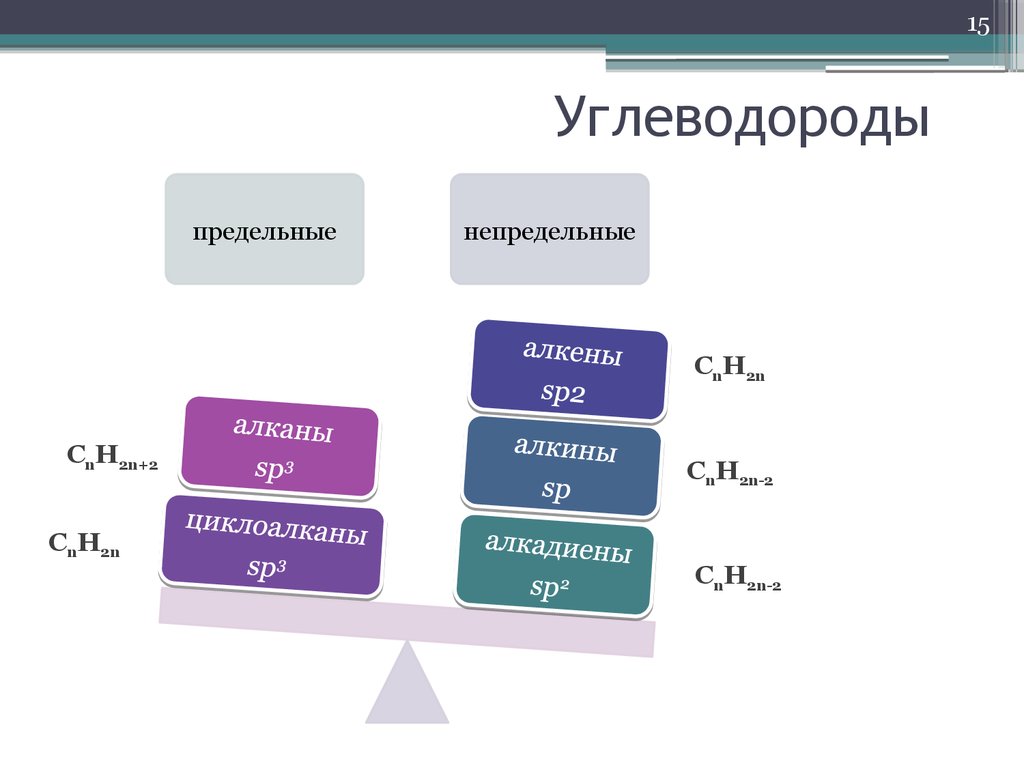
15. Углеводороды
15Углеводороды
предельные
непредельные
CnH2n
CnH2n+2
CnH2n-2
CnH2n
CnH2n-2
16. Механизм радикального замещения SR (sp³)
16Механизм радикального замещения SR (sp³)
1. инициирование ( T, hν, радиация)
2. рост цепи
3. обрыв цепи
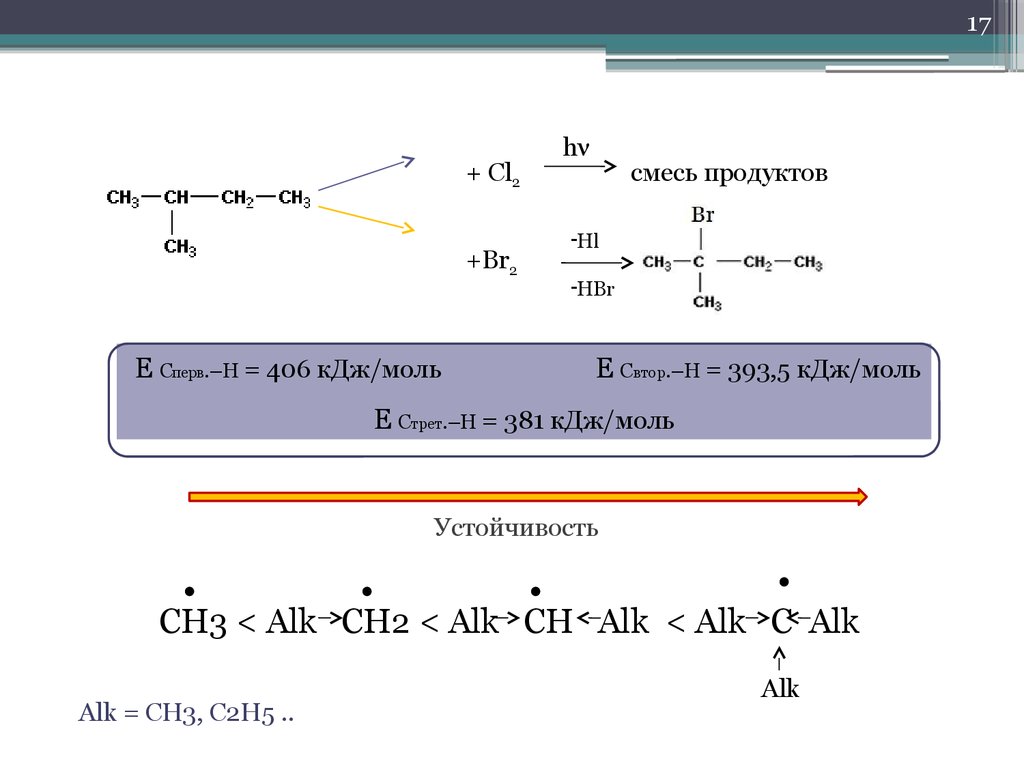
17.
17hν
+ Cl2
смесь продуктов
-Hl
+Br2
-HBr
Е Сперв.–Н = 406 кДж/моль
E Cвтор.–Н = 393,5 кДж/моль
Е Стрет.–Н = 381 кДж/моль
Устойчивость
CH3 < Alk CH2 < Alk CH Alk < Alk C Alk
Alk = CH3, C2H5 ..
Alk
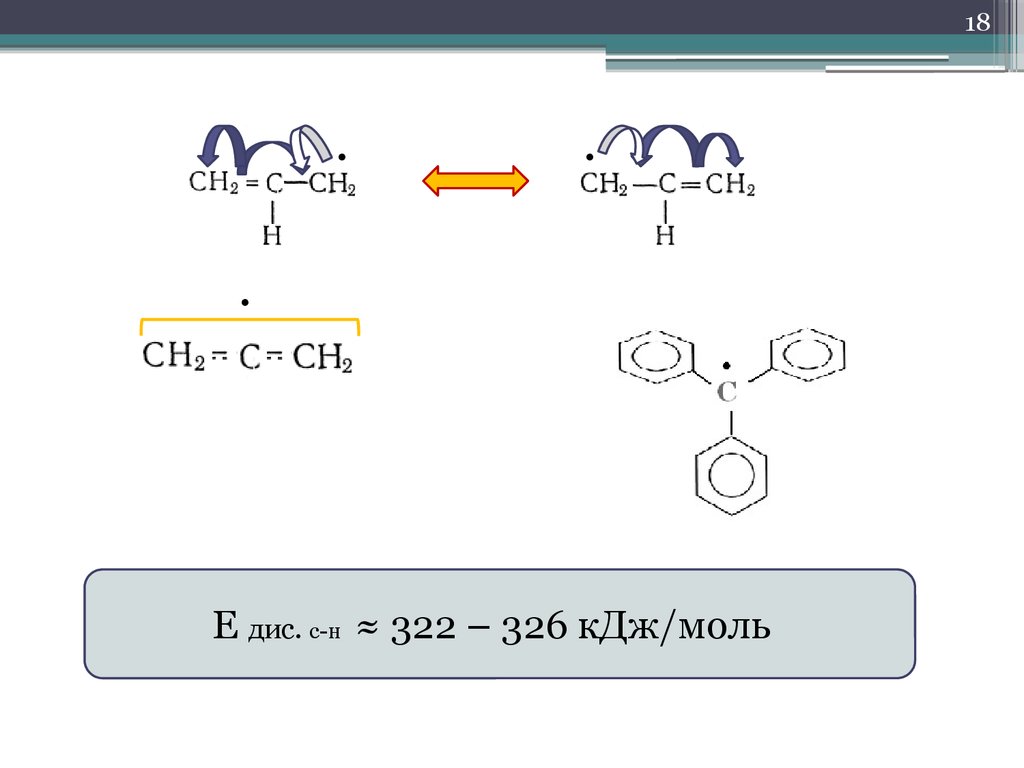
18.
18Е дис. с-н ≈ 322 – 326 кДж/моль
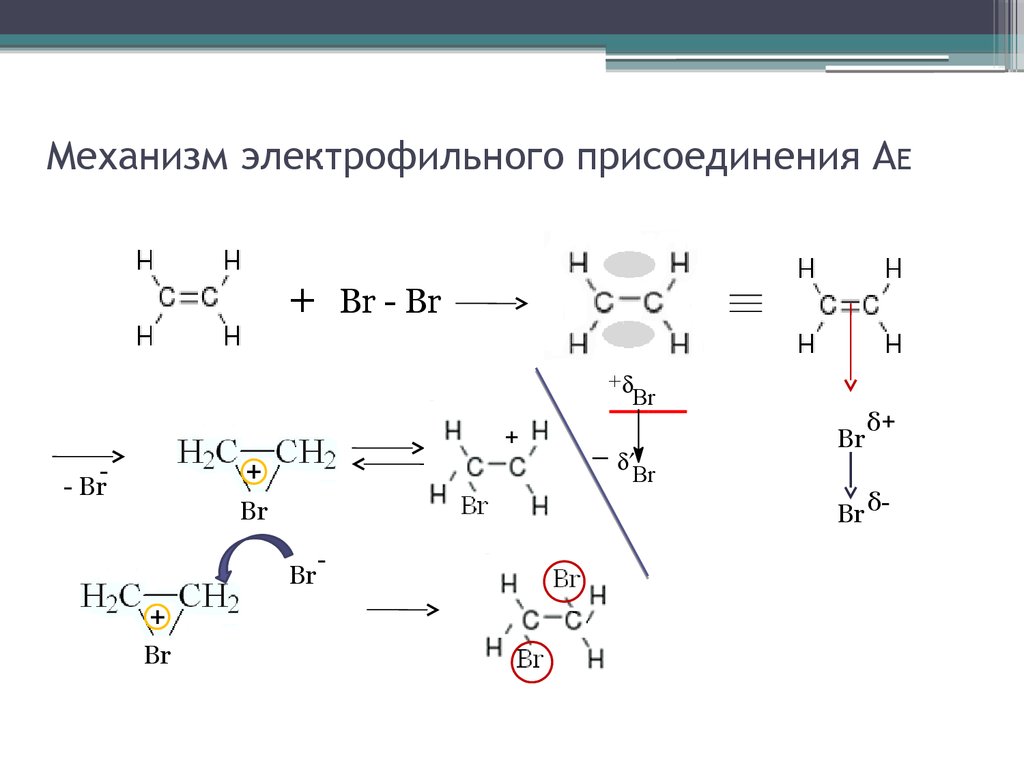
19. Механизм электрофильного присоединения АE
+Br - Br
+
Br
+
+
- Br
Br
Br
+
Br
-
Br
Br
δ+
Br δ-
20.
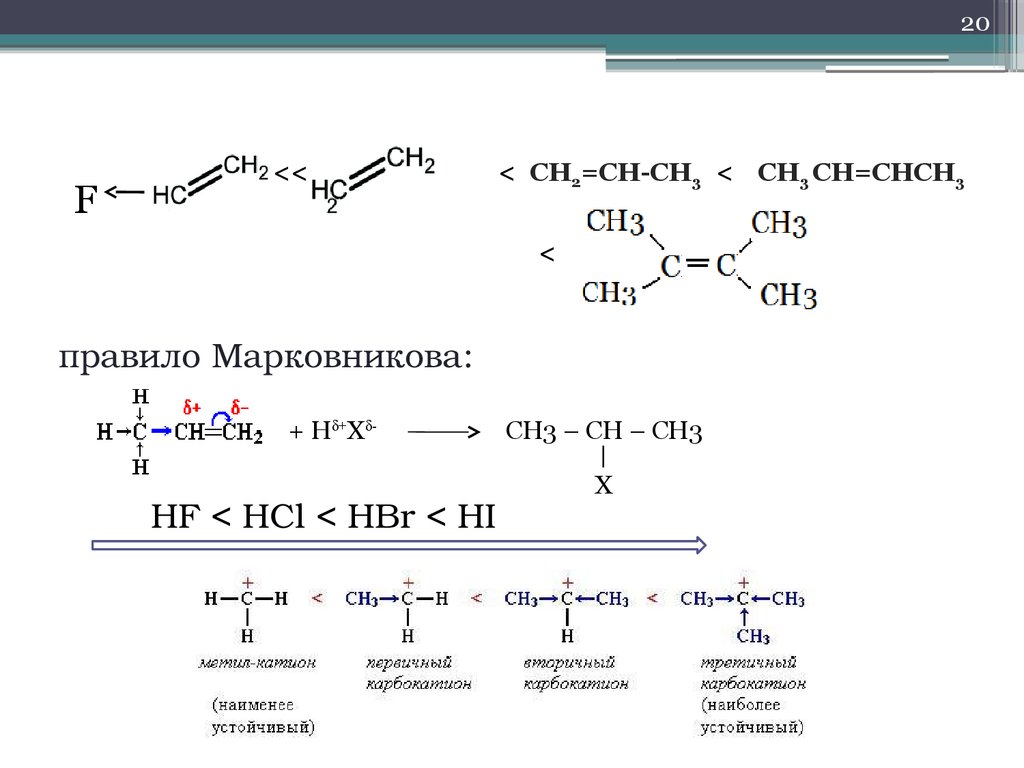
20F
<<
< СН2=СН-СН3 < СН3 СН=СНСН3
<
правило Марковникова:
+ Hδ+Xδ-
HF < HCl < HBr < HI
CH3 – CH – CH3
X
21. AR (против правила Марковникова)
21AR (против правила Марковникова)
22. AE (кислотный катализ)
22AE (кислотный катализ)
CH3 – CH = CH2 + H2O
+
CH3 – CH = CH2 + H
+
H CH3 – CH(OH) – CH3
+
CH3 – CH – CH3
карбкатион
HOH
23. Окисление алкенов
23Окисление алкенов
“мягкое”
окисление
“жесткое”
окисление
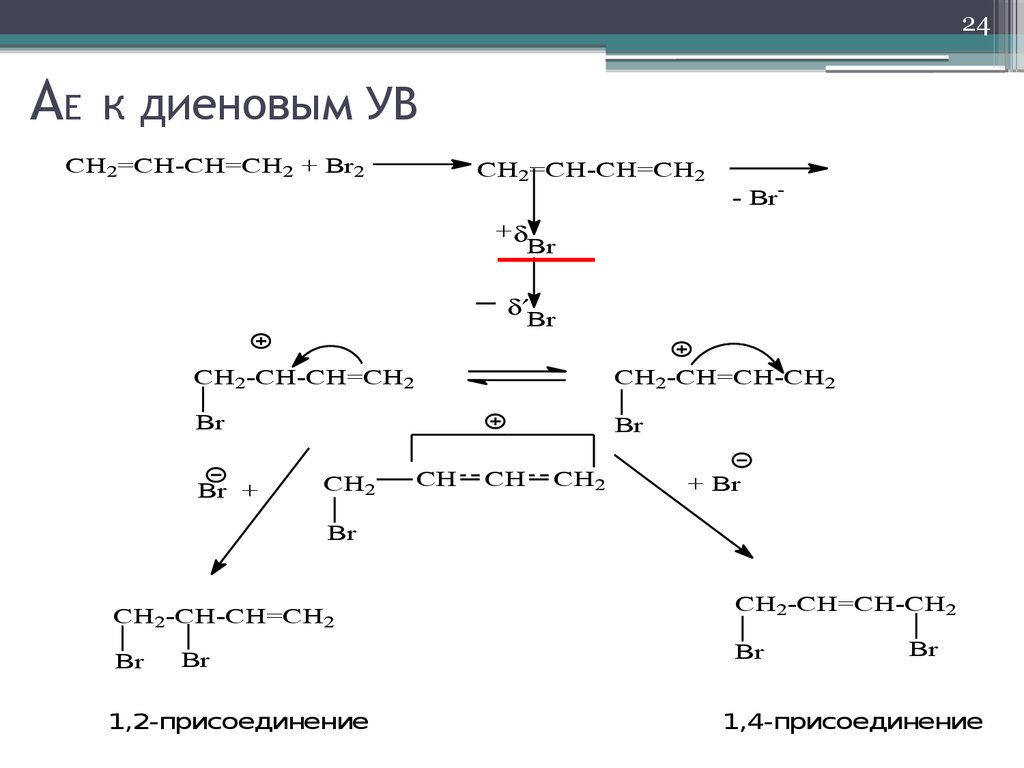
24. AE к диеновым УВ
24AE
к диеновым УВ
CH2=CH-CH=CH2 + Br2
CH2=CH-CH=CH2
- Br-
+
Br
Br
CH2-CH-CH=CH2
CH2-CH=CH-CH2
Br
Br
Br +
CH2
CH
CH
CH2
+ Br
Br
CH2-CH-CH=CH2
Br
Br
1,2-присоединение
CH2-CH=CH-CH2
Br
Br
1,4-присоединение
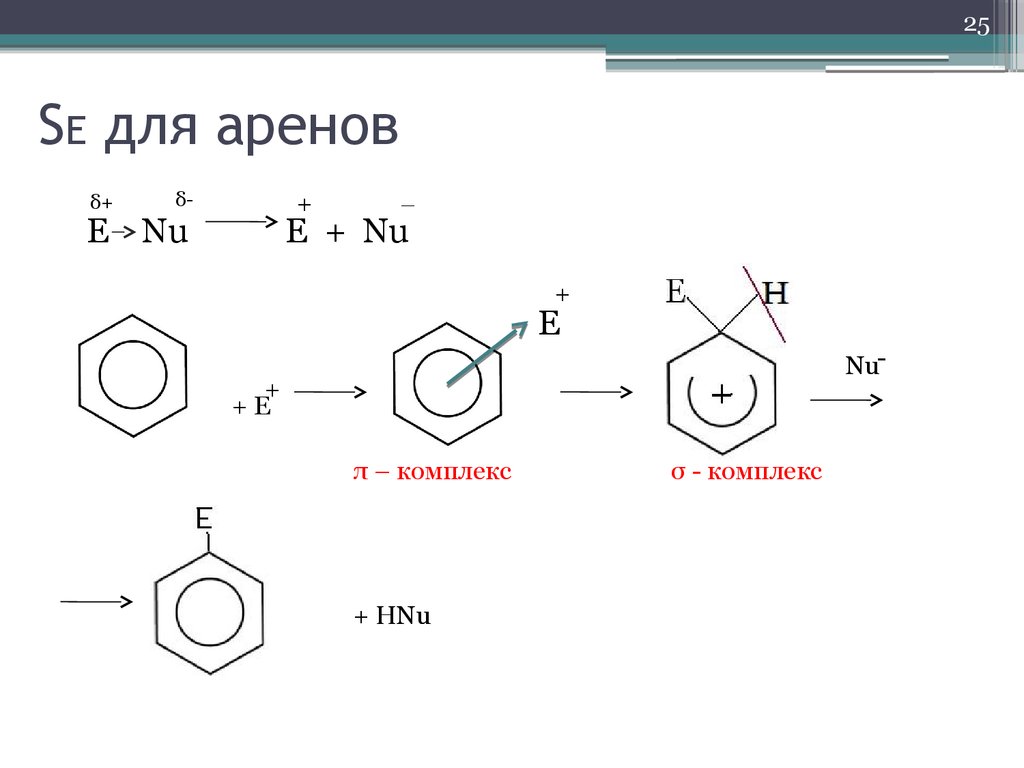
25. SE для аренов
25SE для аренов
δ+
δ-
+
E Nu
–
E + Nu
+
E
Nu-
+
+E
π – комплекс
+ HNu
σ - комплекс
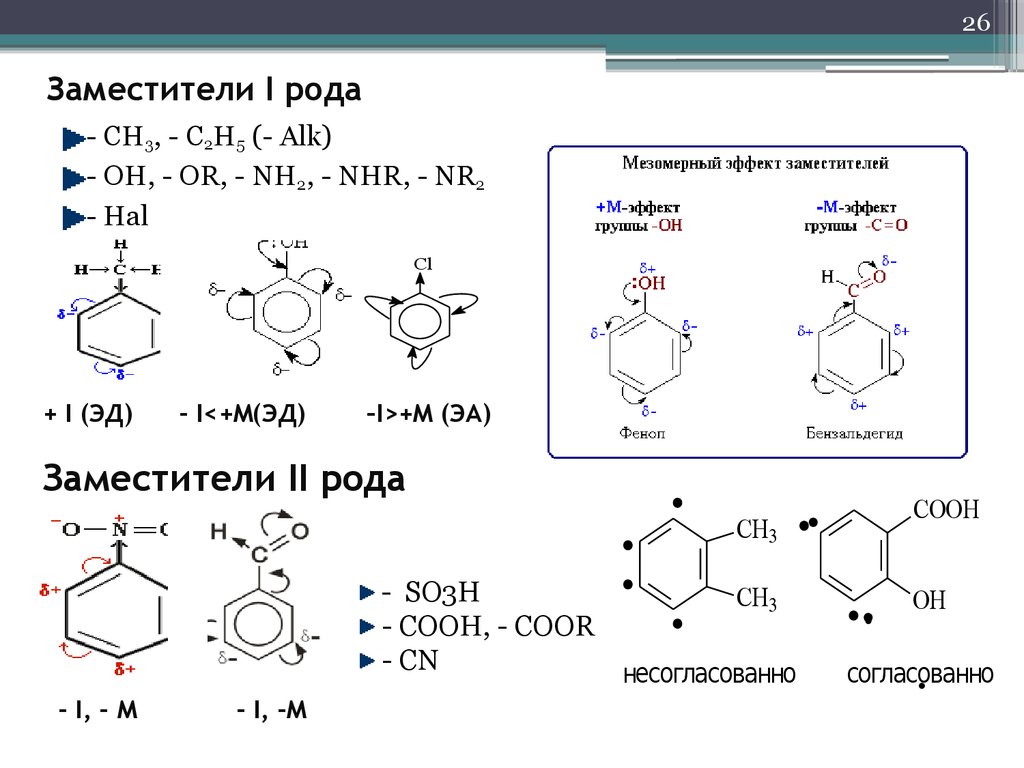
26. Заместители I рода
26Заместители I рода
- CH3, - C2H5 (- Alk)
- OH, - OR, - NH2, - NHR, - NR2
- Hal
Cl
+ I (ЭД)
- I<+M(ЭД)
–I>+M (ЭА)
Заместители II рода
CH3
- SO3H
CH3
- COOH, - COOR
- CN
несогласованно
- I, - М
- I, -M
COOH
OH
согласованно
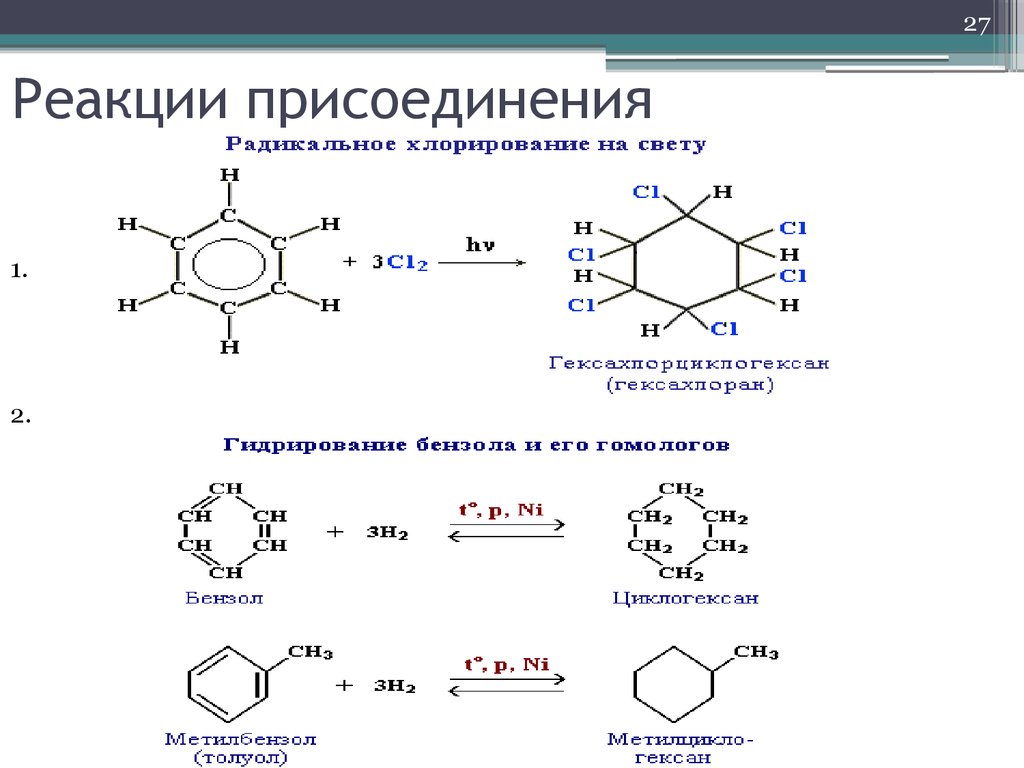
27. Реакции присоединения
27Реакции присоединения
1.
2.
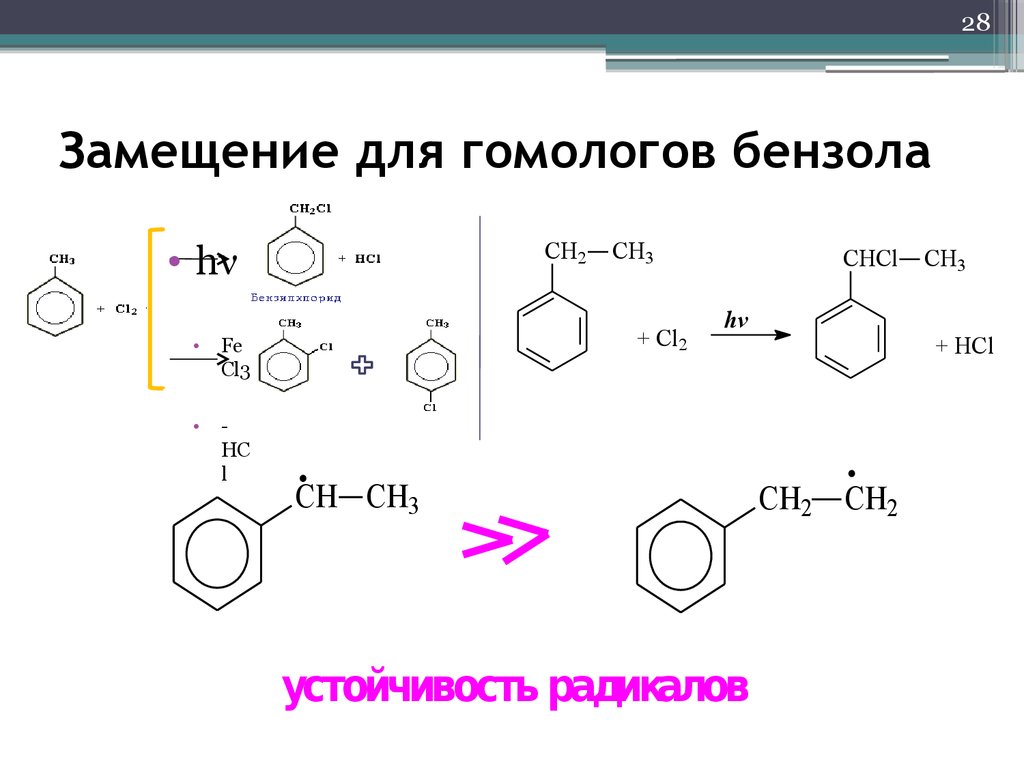
28. Замещение для гомологов бензола
28Замещение для гомологов бензола
• hν
Fe
Cl3
HC
l
CH2
CH3
+ Cl2
CHCl
hv
CH CH3
устойчивость радикалов
CH3
+ HCl
CH2 CH2
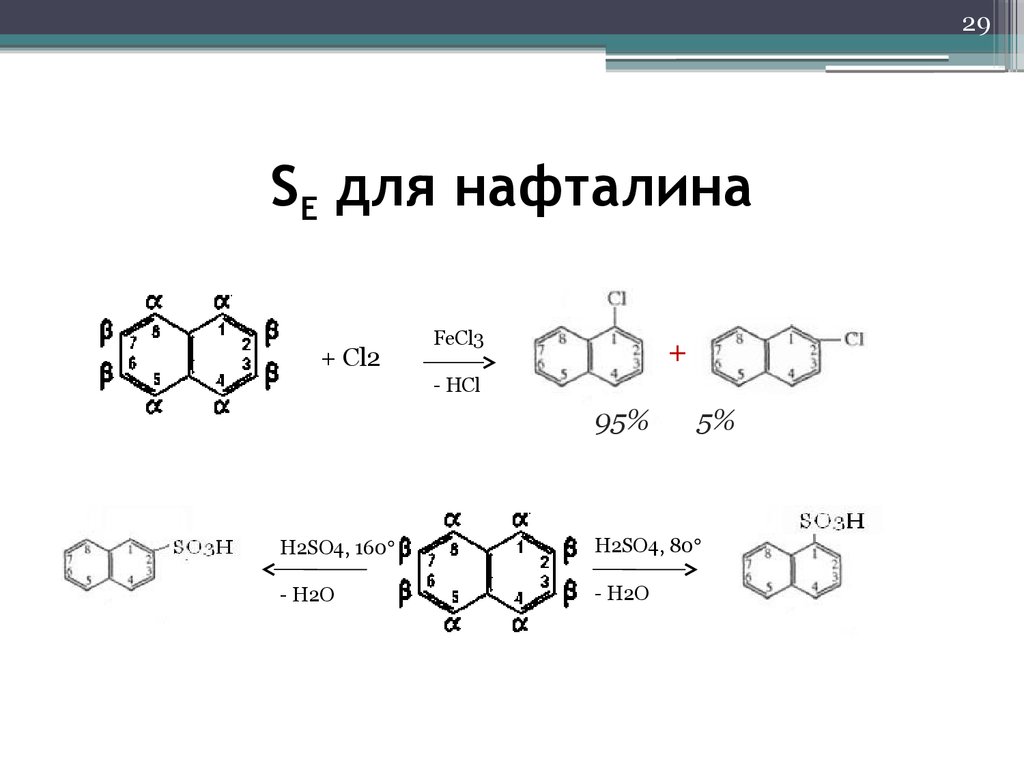
29. SE для нафталина
29SE для нафталина
+ Сl2
FeCl3
+
- HCl
95%
5%
H2SO4, 160
H2SO4, 80
- H2O
- H2O
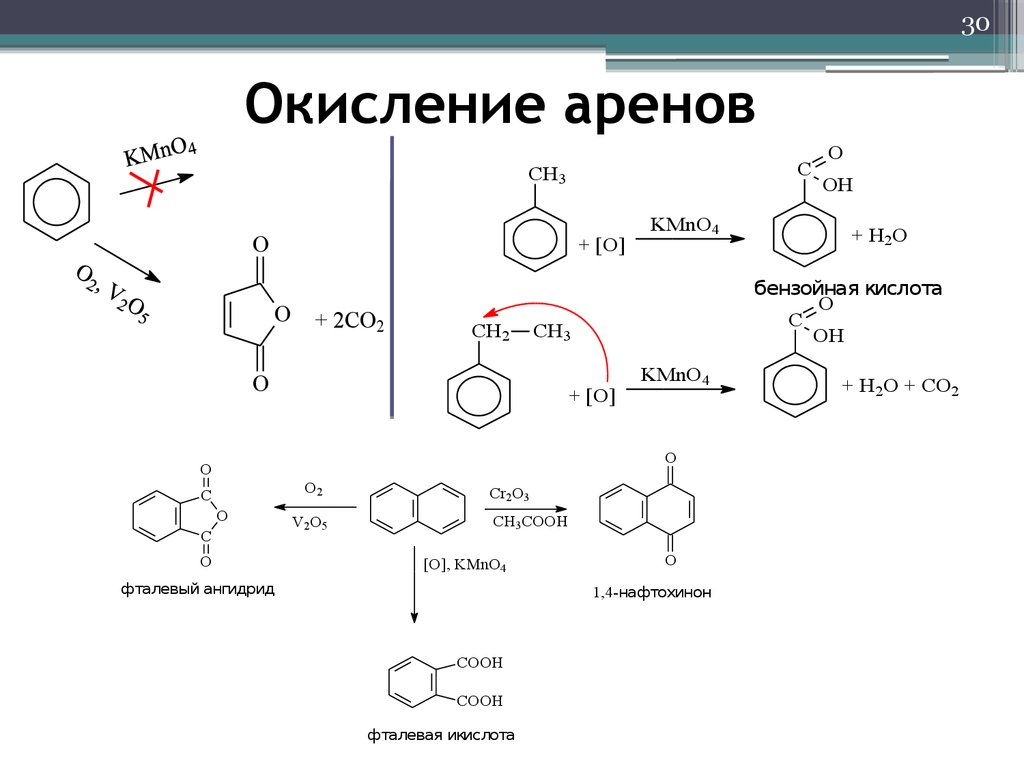
30. Окисление аренов
30Окисление аренов
C
CH3
O
+ [O]
O
+ 2CO2
CH2
KMnO4
+ [O]
KMnO4
O
O
O2
C
O
C
O
V 2O 5
Cr2O3
CH3COOH
[O], KMnO4
фталевый ангидрид
O
1,4-нафтохинон
COOH
COOH
фталевая икислота
OH
+ H2 O
бензойная кислота
O
C
OH
CH3
O
O
+ H2O + CO2
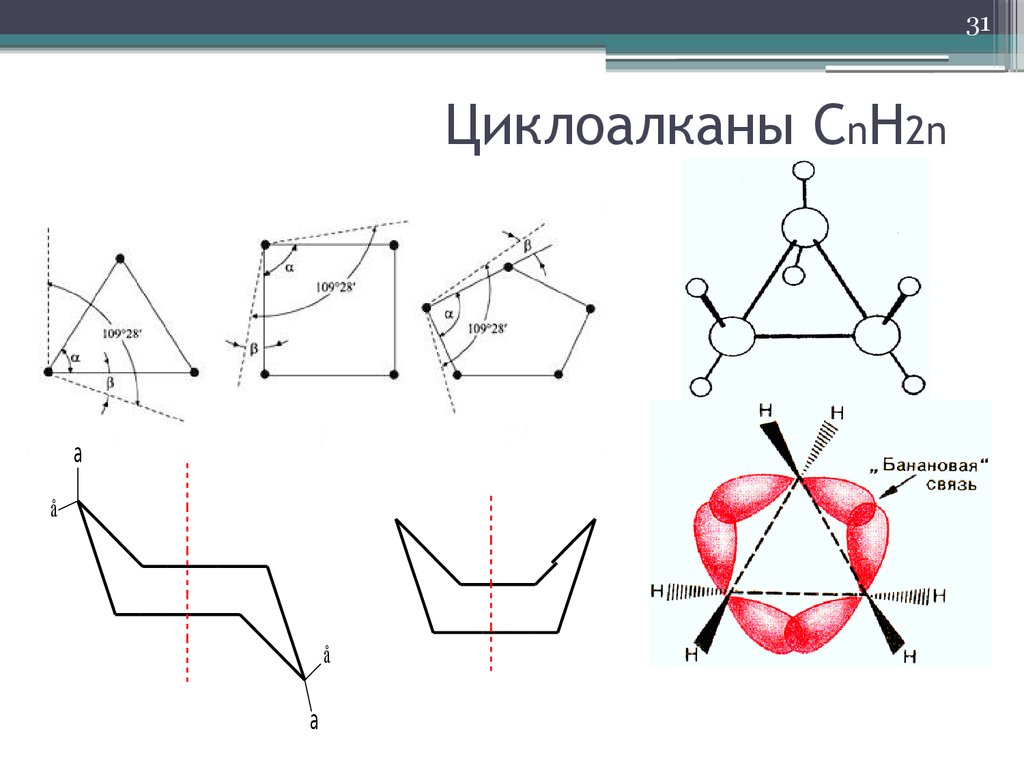
31. Циклоалканы СnH2n
31Циклоалканы СnH2n
а
å
å
а
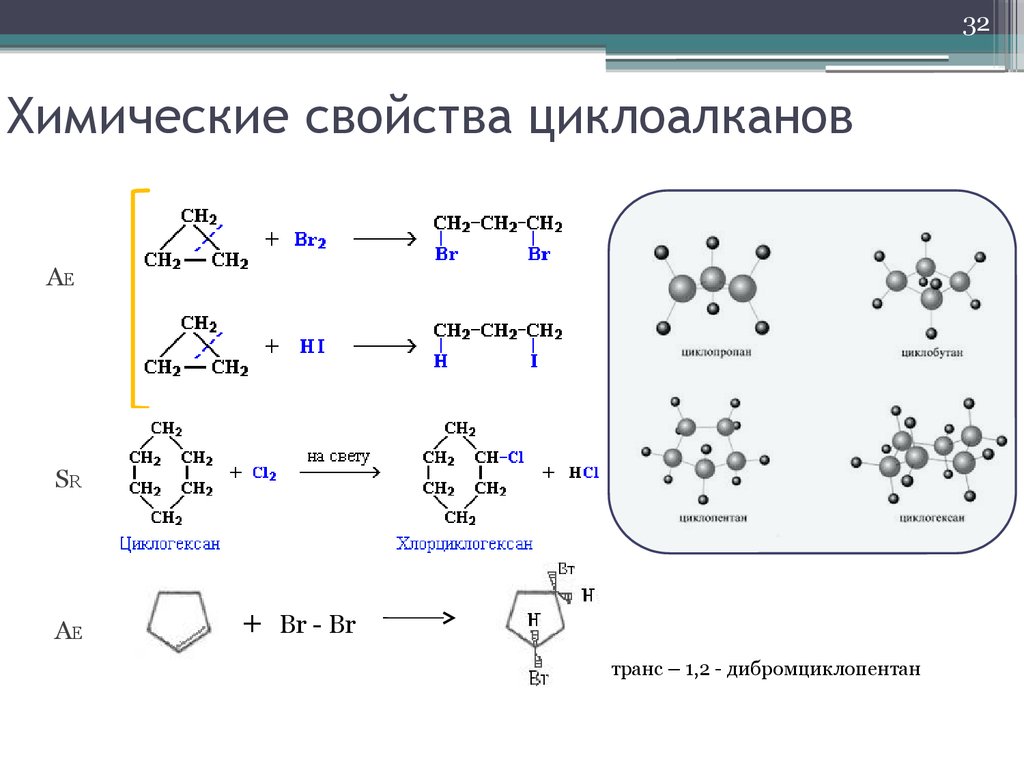
32. Химические свойства циклоалканов
32Химические свойства циклоалканов
AE
SR
AE
+
Br - Br
транс – 1,2 - дибромциклопентан
33.
33С
п
о
б
и
с
а
а
з
н
в
м
и
е
и
н
а
.
.
)
=











 Химия
Химия








