Похожие презентации:
Кремний и его соединения
1. Кремний и его соединения
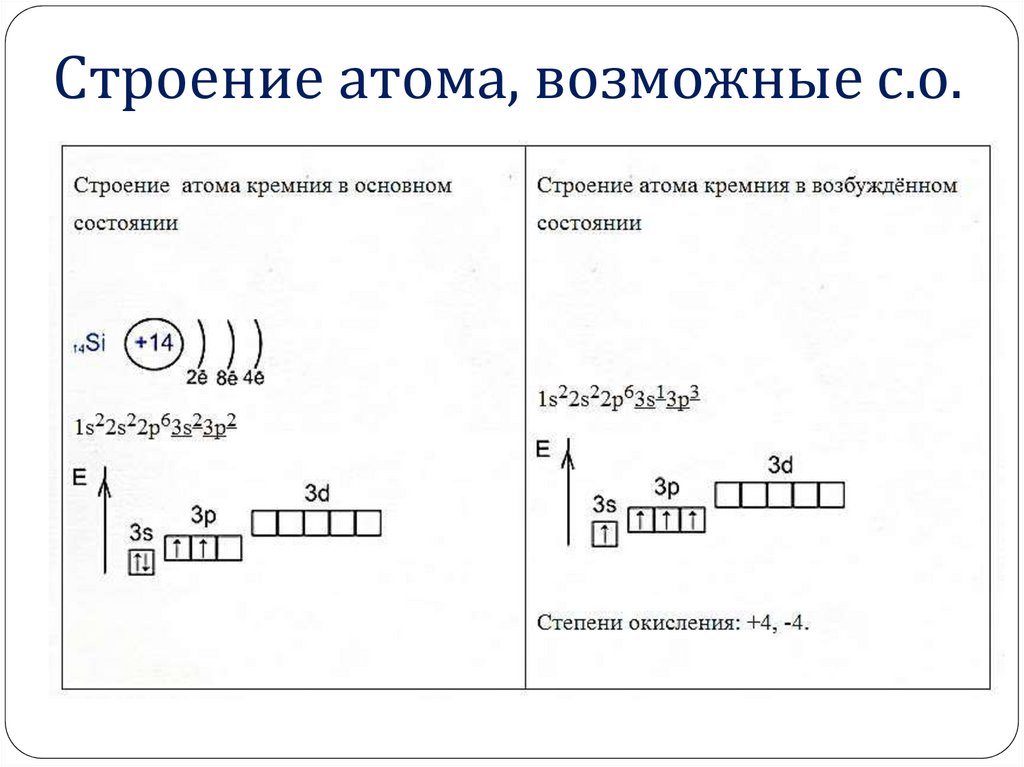
2. Строение атома, возможные с.о.
3. Распространение кремния в природе Второй по распространённости элемент в земной коре после кислорода (27,6% по массе). В
свободном виде не встречается.4. Химические свойства кремния:
Кристаллический кремнийинертен,
аморфный
реакционноспособен.
химически
более
I. Окислительные свойства (с.о. -4).
1) С металлами:
-4
Si0 + 2Mg →Mg2Si
силицид магния
5. II. Восстановительные свойства (с.о. +4).
1) С кислородомSi0 + O2 → Si+4O2
оксид кремния (IV)
2)
Со фтором (без нагревания):
Si0 + 2F2 → Si+4F4
6. 3) С углеродом:
0+4
Si + С →SiС
карбид кремния (IV),
карборунд
SiC - карборунд - твёрдый; используется для
точки и шлифовки.
7.
4) С кислотами не реагирует, толькос плавиковой кислотой
Si+4HF → SiF4+2H2
Растворяется только в смеси азотной и
плавиковой кислот:
3Si+4HNO3+18HF→3H2[SiF6]+4NO+ 8H2O
8. 5) Со щелочами (при нагревании):
Si0 + 2NaOH + H2O → Na2Si+4O3+ 2H2Видеоопыт: «Взаимодействие кремния
со щелочами»
9.
6)С оксидами металлов при
высокой температуре:
Si0 + 2FeO → 2Fe + SiO2
Si0 + 2MgO → 2Mg + SiO2
7)
0
С водой
Si + 2H2Oпар→ SiO2 +2H 2
10.
8)С водородом не взаимодействует
Силан (SiH4) получают
взаимодействием силицидов
металлов с кислотами или водой:
Mg2Si + 4HCl → SiH4↑ + 2MgCl2
Mg2Si + H2О→ SiH4↑ + 2Mg(ОН)2
Видеоопыт «Получение силана»
11. Получение кремния:
1)Промышленный способ – нагреваниеугля с песком:
2C + SiO2 → Si + 2CO
2)Лабораторный
песка с магнием:
способ – нагревание
2Mg + SiO2 → Si + 2MgO
Видеоопыт «Нагревание
песка с магнием»
12. Применение кремния
Кремнийшироко
используется
в
электронике
как
полупроводник,
для
изготовления солнечных батарей.
Добавки кремния к сплавам повышают их
коррозионную стойкость.
13. Оксид кремния (IV) (SiO2)n
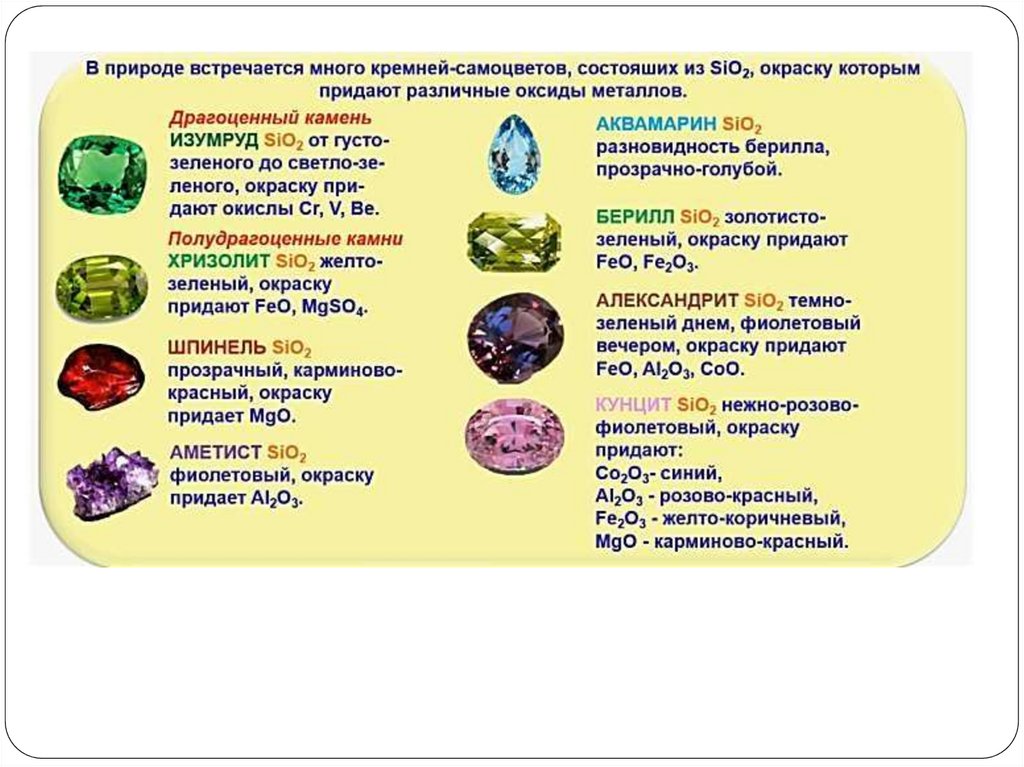
14. SiO2 - кварц, горный хрусталь, аметист, агат, яшма, опал, кремнезём (основная часть песка)
15.
16.
17.
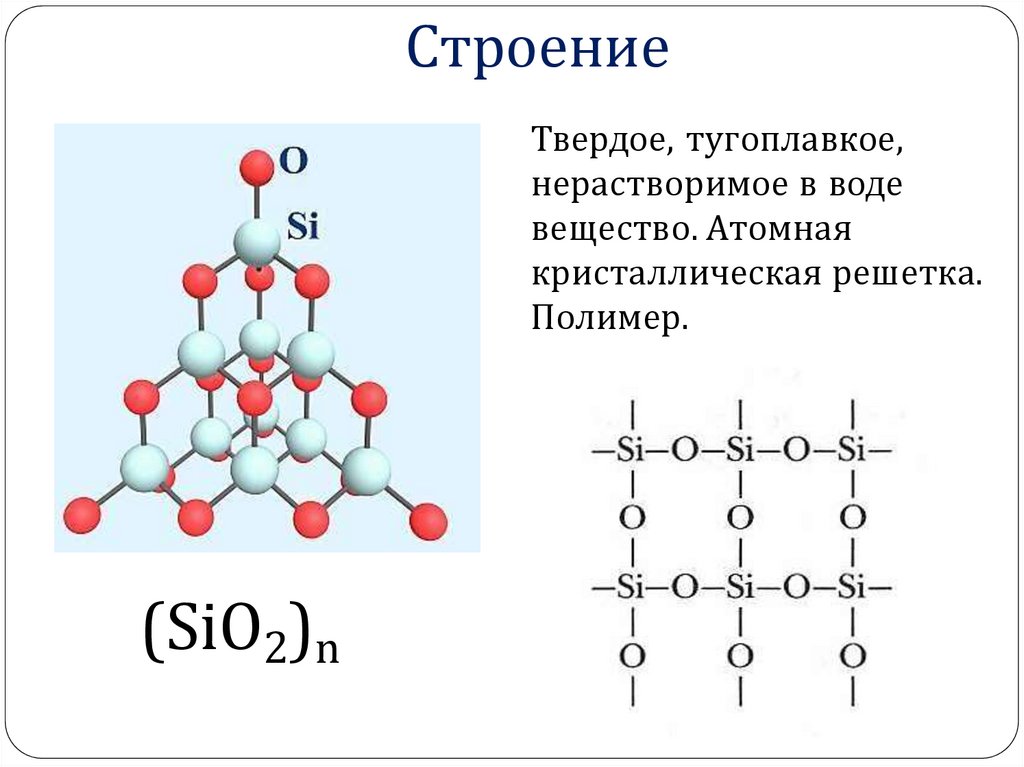
18. Строение
Твердое, тугоплавкое,нерастворимое в воде
вещество. Атомная
кристаллическая решетка.
Полимер.
(SiO2)n
19. Химические свойства оксида кремния (IV):
I. Кислотный оксид1) С основными оксидами:
t
2)
SiO2 + CaO → CaSiO3
Со щелочами:
SiO2 + 2NaOH →Na2SiO3 + H2O
20. II. Специфические:
1) С водой не реагирует2) С солями более летучих кислот:
SiO2 + CaCO3 → CaSiO3 + CO2
SiO2 + K2CO3 → K2SiO3 + CO2
21. Применение оксида кремния (IV)
1. В стекольной промышленности.2. Строительный материал.
3. Получение кварцевого стекла.
22. Кремниевая кислота
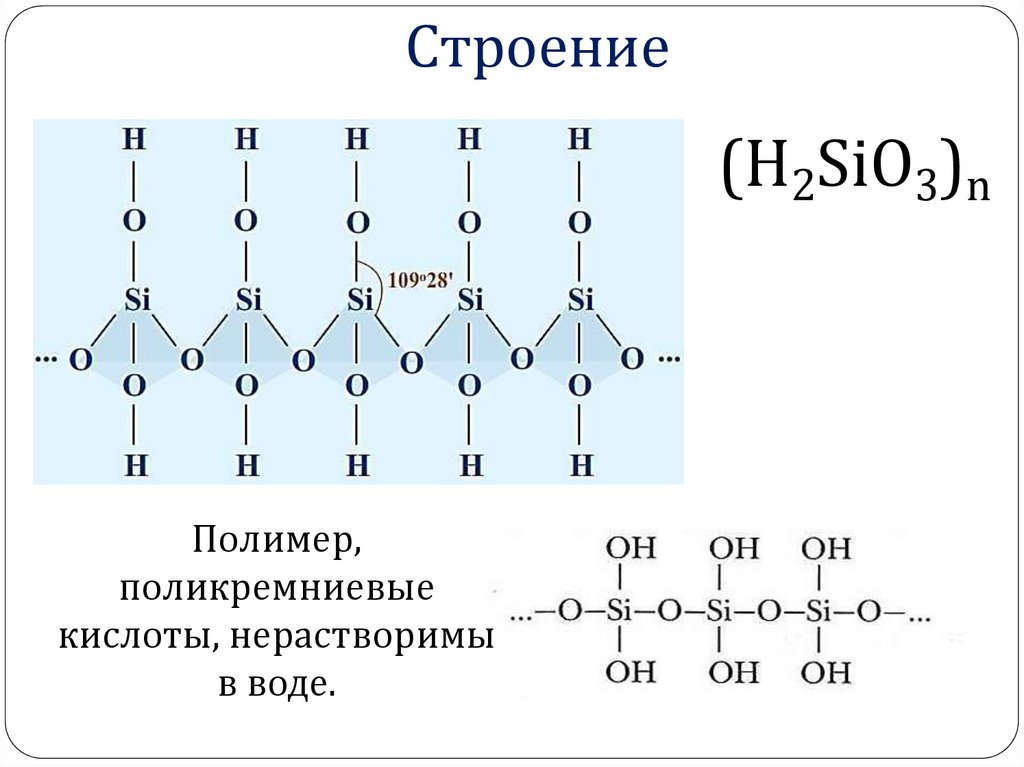
(Н2SiO3)n23. Строение
(Н2SiO3)nПолимер,
поликремниевые
кислоты, нерастворимы
в воде.
24. Получение кремниевой кислоты:
Получение: действие сильных кислот насиликаты
Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓
Видеоопыт
«Получение
кремниевой
кислоты»
25. Химические свойства кремниевой кислоты:
H2SiO3 - очень слабая (слабее угольной),непрочная, в воде нерастворима (образует
коллоидный раствор), не имеет кислого
вкуса (не диссоциирует).
При нагревании разлагается:
H2SiO3 → H2O + SiO2
Силикагель – обезвоженная кремниевая
кислота, пористое вещество.
26. Соли кремниевой кислоты:
Силикаты: нерастворимые вещества (кромесиликатов щелочных металлов).
1)С кислотами
(качественная реакция
на силикат-ион SiO32-)
Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓
2) с солями (↓)
Na2SiO3+CaCl2 → 2NaCl+CaSiO3↓
3)Гидролиз по аниону,
среда щелочная
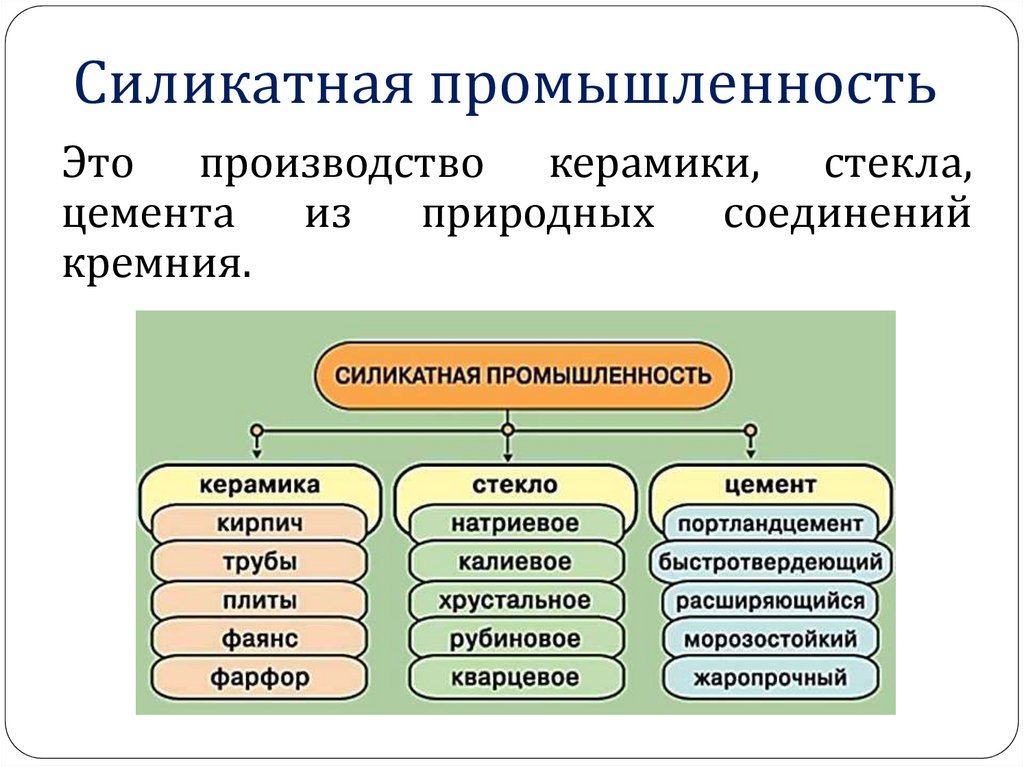
27. Силикатная промышленность
Это производство керамики, стекла,цемента
из
природных
соединений
кремния.
28.
СтеклоСырье: песок , сода и
известняк
29.
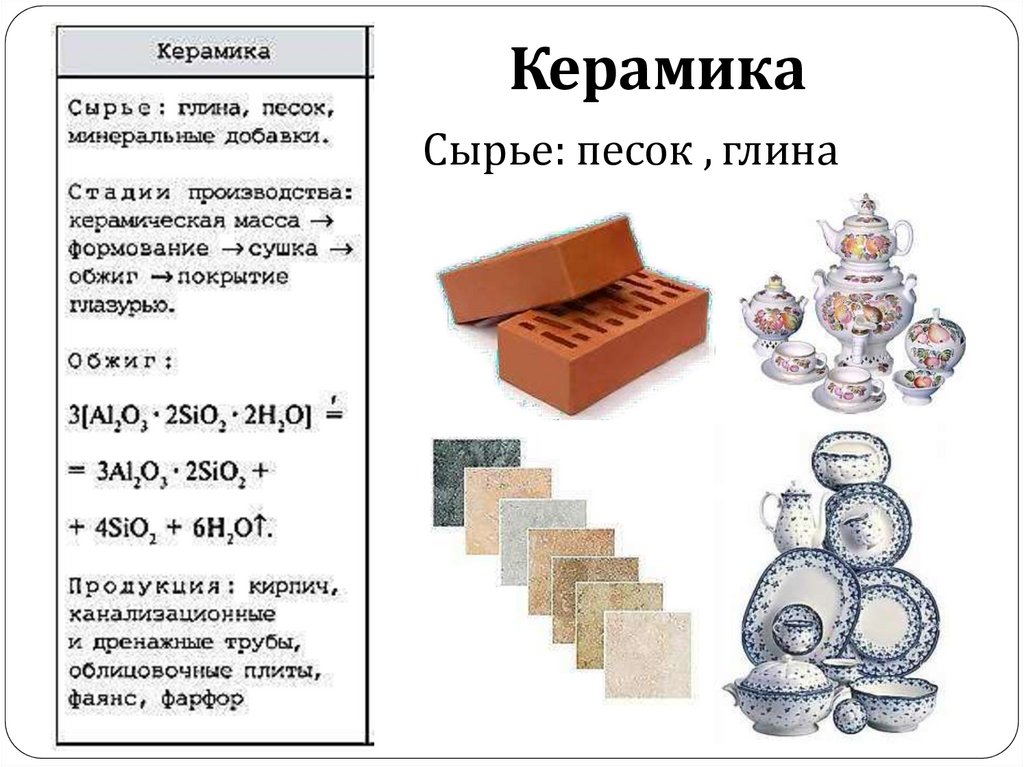
КерамикаСырье: песок , глина
30.
ЦементСырье: глина,
известняк
























 Химия
Химия








