Похожие презентации:
Термодинамические и кинетические основы превращений энергонасыщенных систем
1. ФГБОУ ВО «КАЗАНСКИЙ НАЦИАОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ» КАФЕДРА «ТИП и КМ»
Термодинамические и кинетическиеосновы превращений
энергонасыщенных систем
лектор профессор кафедры ТИП и КМ
Бурдикова Т.В.
2.
Любое вещество обладает энергией – общей количественной меройразличных форм движения и взаимодействия материальных частиц
(тел), способных превращаться друг в друга. Вопросы превращения
веществ с выделением энергии, взаимное превращение форм и обмен
энергией изучают главным образом термодинамика и физическая химия.
Та часть полного запаса энергии, которая не связана с положением
системы в поле внешних сил и с движением системы как единого целого
относительно окружающей среды, а является собственной энергией,
зависящей от внутреннего состояния системы, называется внутренней
энергией.
Термодинамическое определение внутренней энергии как величины,
приращение которой ( U) в процессе равно сообщенной системе теплоте
(Q), сложенной с работой (A), совершенной над системой внешними по
отношению к ней силами. В общем случае изменение внутренней
энергии, которой система обменивается с внешней средой [приобретает
или передает путем теплопередачи (теплоты) и совершения работы],
равно алгебраической сумме теплоты и работы.
3.
U U 2 U 1 Q AВ термодинамике рассматривают лишь теплоту (теплообмен) и работу.
Теплота, количество теплоты – энергетическая характеристика процесса
теплообмена, измеряемая количеством энергии, которое получает (отдает) в
процессе теплообмена рассматриваемое тело (система).
Теплообмен – микрофизическая форма передачи энергии путем появления
или увеличения интенсивности ненаправленного (хаотического) движения
частиц.
Работа – макрофизическая форма передачи энергии путем появления или
увеличения интенсивности направленного движения частиц. Количество
передаваемой энергии называют работой процесса или работой.
работа может быть направлена на пополнение любого вида энергии
(электрической, магнитной и т.д.), теплота же без преобразования ее в работу
может только пополнять внутреннюю энергию.
Наряду с внутренней энергией для характеристики изобарных процессов
(p=const) удобнее пользоваться энтальпией.
Из 1-го закона термодинамики следует, что если в этих условиях совершается
лишь работа преодоления внешнего давления (работа расширения от V1 до V2,
т о dQ=dU+pdV=d(U+pV).
Функция U+pV=H, называемая энтальпией (от греческого «энтальпо» –
нагреваю), есть функция состояния системы, т.к. U – функция состояния при
V=const, а р и V – параметры состояния (термин введен Оннесом в 1909 г.).
4.
вытекающем из (1), Q = U – A не зафиксированы.Тепловые эффекты процессов, изучаемые в термохимии, эффекты химических реакций, в том
числе реакций образования веществ (Qp и QV), от условий образования не зависят. Эти условия в
выражениях для Qp и QV зафиксированы (p и V=const). Из этого вытекает следующее определение [4]:
если процесс протекает необратимо (как это имеет место в условиях превращения ЭМ) и при
постоянном объеме или давлении, причем образующиеся продукты имеют ту же температуру, что и
исходные вещества, то теплоту, выделяемую или поглощаемую при этом процессе, называют тепловым
эффектом.
В термохимии тепловые эффекты в открытой системе наряду с условиями T, p, V=const относят к
стехиометрическим количествам реагентов. В этих условиях эффект процесса подчиняется закону
Гесса, не зависит от промежуточных стадий (от пути перехода) и определяется лишь начальным и
конечным состоянием системы, т.е. изменением функций состояния U и H. Если он протекает без
совершения полезной работы (против электрических, магнитных и других сил), то численно тепловой
эффект QV, T = - U, а Qр, T = - Н. Связь тепловых эффектов выражается зависимостью . Величина
(объемная энергия) зависит от количества газов в ходе реакции ( n): Qp = QV + nRT. Если
реакция протекает в конденсированной фазе, то различие между Qp и QV незначительно, а при
n=0 Qр = QV.
Положительные тепловые эффекты – следствие убыли энтальпии или внутренней энергии
системы. При этом U иногда называют внутренней энергией системы при постоянном объеме, а
Н – внутренней энергией при постоянном давлении
Внутренняя энергия и энтальпия являются такими видами (формами) энергии, которые в
отличие от механической, электрической и других не могут полностью переходить в иные виды
энергии. Они включают составляющую свободной энергии, которая в обратимом
изотермическом процессе полностью переходит в работу (F при V=const и G при p=const), и
связанную энергию, не переходящую в работу (TS). Таким образом:
где F – энергия Гельмгольца; G – энергия Гиббса;
S – энтропия.
5.
ХЭ – энергия внутримолекулярная, один из видов энергии, составляющихвнутреннюю энергию вещества. Она сосредоточена в химической связи.
Химическая связь (ХС) может быть не только внутримолекулярной, но и
межмолекулярной. Разрыв ХС, как и их образование, – химический
процесс, результат химических реакций. химическая энергия – энергия
химических превращений вещества (системы), обусловленных, прежде
всего, образованием и разрывом химических связей.
Внутренняя энергия есть суммарная энергия молекул и молекулярного
взаимодействия, то химическая энергия – внутримолекулярная,
складывается из кинетической энергии движения электронов и их
взаимодействия друг с другом и с атомным ядром. Уровень химической
энергии соединения принимают однозначно как энергию его
образования. Энтальпия образования веществ является мерой их
химической энергии. Разность между энергией, затраченной на разрыв
связей в исходной системе (веществе), и энергией, полученной при
образовании молекул продуктов реакции, и составляет энергетический
эффект реакции.
6.
Удельную энергию, выделяемую в зоне химических реакций при взрыве,определяют как удельную химическую энергию взрывчатого вещества
или энергию взрыва. Аналогично энергию химических превращений и
других видов ЭМ (разложение, горение порохов, ракетных топлив,
пиротехнических составов и др.), преобразованную в специфические
формы в соответствии с назначением ЭМ, также рассматривают как ХЭ.
Величина энергии связи С С изменяется от 326 (в этане) до 506
кДж/моль(в бензоле), а связи С О от 313 (в спиртах) до 702 кДж/моль (в
СО2). В некоторых кристаллах сильная водородная связь составляет 120…
250 кДж/моль. Уровень энтальпии образования исследованных
энергетических соединений, способных к термическим превращениям,
составляет от 400 до 1600 кДж/моль (4500…5800 кДж/кг). Полагают, что в
пределе стандартная удельная энтальпия образования и соответственно
удельная химическая энергия вещества может достигать 10000 кДж/моль.
7.
Классификация энергетических материалов8.
Теплоты образования и разложения оказывают влияние на возможностьсгорания смеси, содержащей данный компонент, температуру горения,
чувствительность состава к механическим и тепловым импульсам, его
взрывчатые свойства. Для обеспечения возможности горения смесей,
увеличения тепловыделения и получения более высоких температур при
горении желательно использовать компоненты с малой теплотой образования
и разлагающиеся с выделением тепла (хлорат и перхлорат калия, нитрат и
перхлорат аммония и т.д.). Стандартная теплота образования вещества при
постоянном давлении равна по величине и противоположна по знаку
стандартной энтальпии образования ( Н0, кДж/моль).
Очень высокой чувствительностью обладают хлоратные составы, несколько
меньшей – перхлоратные и еще меньшей – нитратные. Теплоты образования и
разложения могут быть определены расчетным или экспериментальным
методами. При низких температурах нитрат натрия разлагается до NaNO 2 и
О2, а при температуре выше 6000С – до Na2O, N2 и O2. При более высоких
температурах или в присутствии сильных восстановителей разложение может
сопровождаться образованием атомарного натрия. Коэффициент Демидова в
первом случае равен 5,32, во втором – 2,13, в третьем – 1,81. Соответственно
теплота разложения составляет: -107,33, -258,86 и -466,91 кДж/моль; теплота,
затрачиваемая для выделения 1 моля кислорода: -107,33, -103,52 и -155,64
кДж.
9.
К=
,
Ae
E
RT
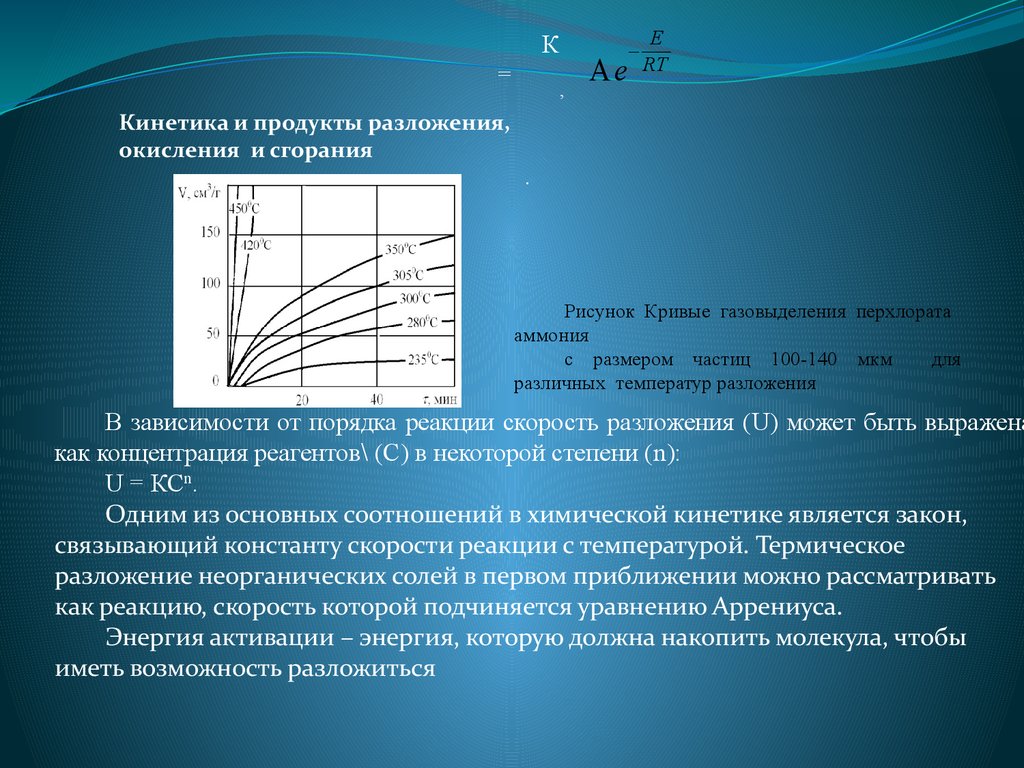
Кинетика и продукты разложения,
окисления и сгорания
.
Рисунок Кривые газовыделения перхлората
аммония
с размером частиц 100-140 мкм
для
различных температур разложения
В зависимости от порядка реакции скорость разложения (U) может быть выражена
как концентрация реагентов\ (С) в некоторой степени (n):
U = КСn.
Одним из основных соотношений в химической кинетике является закон,
связывающий константу скорости реакции с температурой. Термическое
разложение неорганических солей в первом приближении можно рассматривать
как реакцию, скорость которой подчиняется уравнению Аррениуса.
Энергия активации – энергия, которую должна накопить молекула, чтобы
иметь возможность разложиться
10.
Если при температурах Т1 и Т2 значения констант скорости реакции равны К 1 и К2, тэнергия активации будет равна
19,155 (lg K 1 lg K 2)
E=
1 / Т 2 1разложения
/ T1
Энергия активации
,.
различных солей отличается весьма
существенно. Для перхлората калия она равна 230 кДж/моль, а для перхлората
аммония 126 кДж/моль.
Строят график зависимости lg K (1/T). Тангенс угла наклона полученной
прямой равен энергии активации (с противоположным знаком), поделенной
на величину R.
Для формально-кинетического анализа процессов топохимического
разложения предложено большое количество теоретических зависимостей
(степенных, экспоненциальных и др.), построенных на предположениях о
различных законах образования и роста реакционных ядер. Наиболее общий
характер имеет уравнение Ерофеева,:
α = 1 – exp(-Кτn),
где α – доля прореагировавшего вещества; К – константа скорости
реакции; τ – время разложения. При n = 1 реакция имеет первый порядок,
при этом скорость реакции пропорциональна массе непрореагировавшего
вещества. При n > 1 реакция находится в кинетической области. При больших
значениях n скорость реакции мало зависит от скорости
зародышеобразования и определяется ростом существующих ядер. При n < 1
уравнение Ерофеева описывает процессы разложения, лимитируемые
диффузией.
11. Три группы окислителей
– вещества, полностью разлагающиеся в твердом состоянии с образованием толькогазообразных или газообразных и конденсированных продуктов (топохимическое
разложение). К ним относятся (NН4)2Сr2O7, NH4ClO4, NOClO4, NO2ClO4, КМnO4,
Рb(NO3)2, СаСО3, МgСО3, SrСО3, ВаСО3, РbО2, Рb3O4, МnО2, СаО2, SrO2, С2Cl6;
– вещества, разложение которых начинается после плавления и полностью протекает
в жидкой фазе или после испарения. К ним относятся NH 2OH·НNО3, LiNO3, КNО3,
RbNO3, CsNO3, N2H5NO3, LiClO4, CN3H6ClO4, NaClO3, NH3OHClO4, ВаСrO4, РbСrO4,
К2Сr2О7, Na2SO4, WO3, МоО3;
– вещества, разложение которых начинается ранее или одновременно с процессом
плавления (исходное вещество в процессе разложения может находиться как в
твердой, так и жидкой фазе). К ним относятся N 2H4·2НNO3, Sr(NO3)2, Ва(NО3)2,
N2H5C(NO2)3, NaNO3, NH4NO3, NаС1O4, КС1O4, RbСlO4, СsСlO4, N2H5ClO4, Ва(С1O3)2,
КСlO3, Fe2O3, Fe3O4, СuО, Сr2О3, СrО3, ВаO2, СаSO4, ВаSO4, С6Cl6.
12.
Теплота сгорания – количество тепла, выделяющееся при сгорании единицы массыгорючего в атмосфере кислорода или воздуха. Обозначается обычно Hu (кДж/кг). Ее
можно определить сжиганием в калориметрической бомбе или рассчитать по
формулам:
.
Hu = 103Q1 (для простого вещества),
где Q1 – количество тепла, выделяющееся при сгорании 1 г элемента. Q1 = , где
Q – теплота образования оксида, кДж/моль; n – число атомов элемента, входящего
в молекулу оксида; А – атомная масса элемента;
где ∑Q – сумма теплот образования продуктов сгорания 1 моля горючего; Qг –
теплота образования 1 моля горючего; Мг – молекулярная масса горючего.
Hu = 103
Q Qг
Мг
(для сложного вещества),
Наибольшей теплотой сгорания обладают литий, бериллий, бор, алюминий,
водород, углерод, сплавы металлов (алюминия с магнием, магния с кремнием и др.), а
также органические и неорганические вещества, содержащие водород. По величине
Hu этим горючим значительно уступают титан и цирконий.
13.
ni 1000Следует
М
учитывать количество тепла, выделяющееся с единицы объема горючего (обычно
с 1 л).
По величине Hu горючие располагаются в ряд: Н, Ве, В, Li, С, А1, Si, Мg, Т1, Zr. По
объемной теплоте сгорания их расположение изменяется: В, Ве, А1, Тi, Zr, Si, Мg и т.д.
Расчет условной формулы на 1 кг производят следующим образом. Подсчитывают
количество молей каждого элемента в 1 кг вещества аi по формуле
аi = 1000 ni/|M
где ni – число атомов данного элемента в молекуле вещества; М – молекулярная
масса вещества.
В качестве примера рассчитаем условную формулу на 1 кг для нафталина (С10Н8).
Содержание молей углерода в 1 кг нафталина равно = 78,0189, а водорода = 62,4152.
Отсюда условная формула нафталина на 1 кг соответствует С78,0189Н62,4152.
14. Расчеты коэффициентов Демидова
Коэффициент Демидова для окислителя равен числу грамм вещества,выделяющего 1 г окислительного агента. Подсчитывают его по реакции
разложения окислителя (для условий горения). Нитрат натрия
разлагается по схеме
2NaNO3 → Na2O + N2 + 2,5О2,
т.е. при разложении 170 г нитрата натрия выделяется 80 г кислорода, а
для выделения 1 г кислорода требуется = 2,13 г нитрата натрия.
Следовательно, для нитрата натрия КД = 2,13.
Коэффициент Демидова для горючего – количество грамм горючего,
сгорающего за счет 1 г окислительного агента. Например, для сгорания
48 г магния, требуется 32 г кислорода, т.е. КД для магния равен = 1,52.
15. Окисление металлов
aМе + О2 MeaOb.– диффузия атомов металла к границе металл – оксид;
– ионизация металла с образованием ионов металла и электронов;
– диффузия ионов металла и электронов от границы металл – оксид через
оксидную пленку к поверхности раздела оксид – газ;
– химическое взаимодействие металл – кислород на поверхности оксидной
пленки;
– адсорбция кислорода на границе оксид – газ;
– взаимодействие оксид – газ;
– ионизация адсорбированного кислорода;
– диффузия ионов кислорода через оксидную пленку к поверхности
металла;
– химическая реакция металла с кислородом на границе металл – оксид.
16. Закономерности окисления металлов
mτ = К 1или
mτ + A1 = К1 ,
где mτ – величина, характеризующая изменение металлического образца
(привес, толщина оксидной пленки и т.д.) за время ; К1 – константа
скорости реакции; А1 – постоянная.
Если на металле образуется плотная защитная оксидная пленка, то
окисление в начальный период протекает с высокой скоростью, но по мере
роста пленки она быстро уменьшается, и зависимость mτ(τ) имеет
параболический mτ2 = K2 + A2, кубический mτ3 = K3 + A3 или
логарифмический mτ = K4lg( + 0) + A4 законы (где К2, К3, К4 – константы
скорости реакции; А2, А3, А4 – постоянные). Как правило, в этом случае
скорость окисления лимитируется скоростью диффузии.
17. Теории окисления Вагнера и Кабрера-Мотта
теории Вагнера и Кабрера–Мотта. Теория Вагнера-для толстых пленококсидов. В соответствии с ней анионы, катионы и электроны перемещаются
по дефектным местам (междуузлиям и вакансиям) кристаллической
решетки оксида. Теория Кабрера–Мотта объясняет механизм образования
тонких пленок. Таким образом, граница оксид – газ заряжается
отрицательно, а граница металл – оксид соответственно положительно. При
наличии электрического поля высокой напряженности катионы
перемещаются к границе оксид – газ и взаимодействуют с ионами кислоро
да.

















 Физика
Физика








