Похожие презентации:
Химические элементы
1.
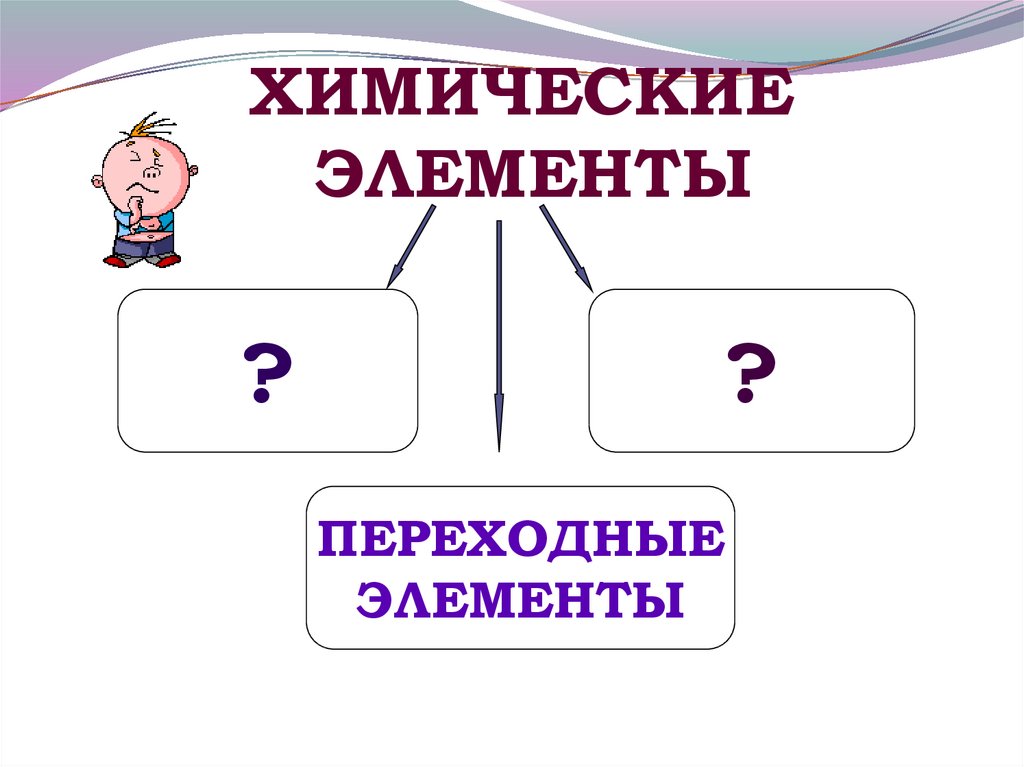
ХИМИЧЕСКИЕЭЛЕМЕНТЫ
?
?
ПЕРЕХОДНЫЕ
ЭЛЕМЕНТЫ
2. Ме - nẽ→ Ме+n неМе + nẽ→ Ме-n металлы отдают неМе принимают электроны внешние электроны
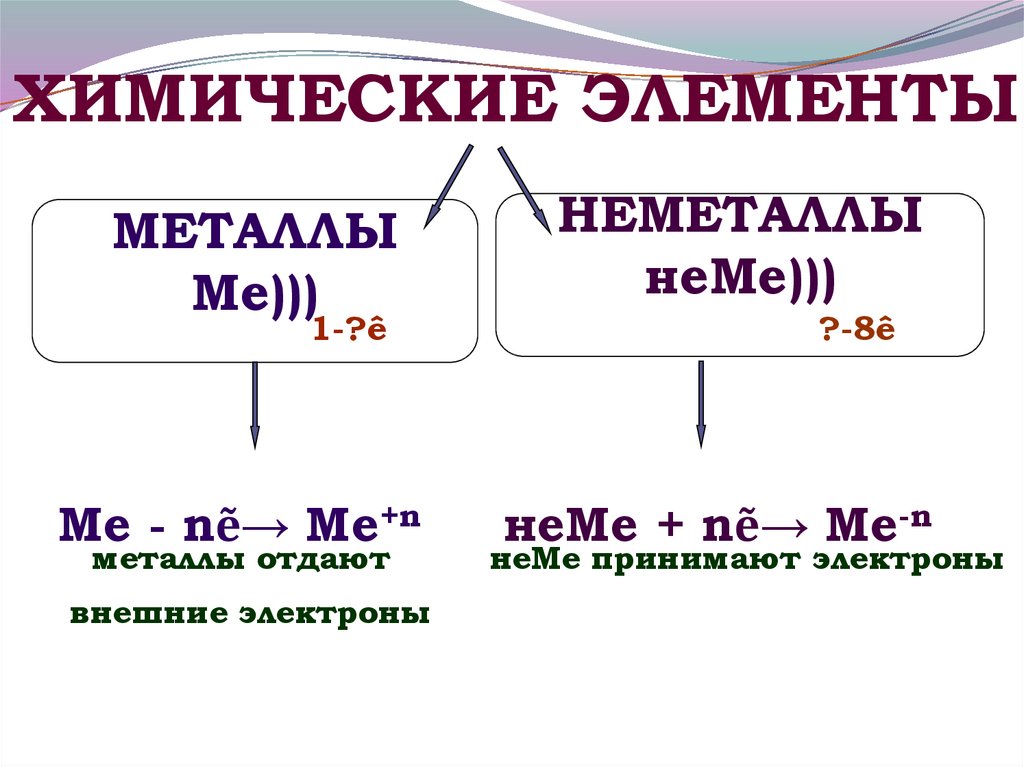
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫМЕТАЛЛЫ
Ме)))
1-?ê
Ме - nẽ→ Ме+n
металлы отдают
внешние электроны
НЕМЕТАЛЛЫ
неМе)))
?-8ê
неМе + nẽ→ Ме-n
неМе принимают электроны
3. КАКИЕ ВЕЩЕСТВА ЯВЛЯЮТСЯ СЛОЖНЫМИ? ОБЪЯСНИТЕ СВОЙ ВЫБОР.
Углекислый газАзот
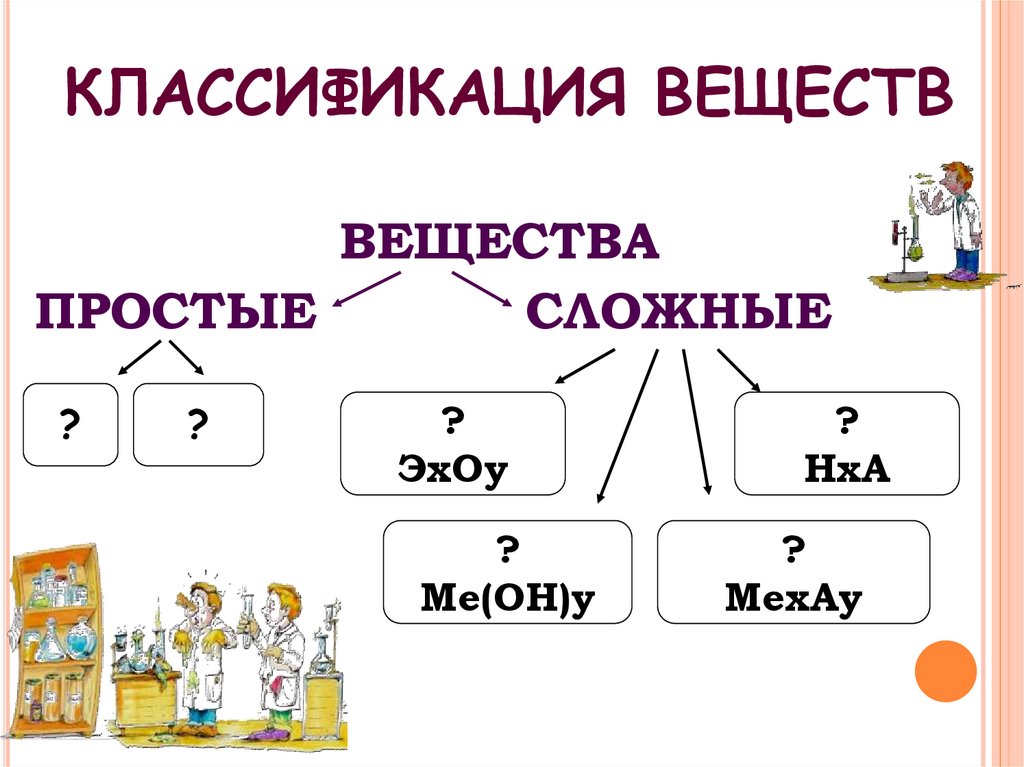
4. КЛАССИФИКАЦИЯ ВЕЩЕСТВ
ВЕЩЕСТВАПРОСТЫЕ
СЛОЖНЫЕ
?
?
?
ЭхОу
?
Ме(ОН)у
?
НхА
?
МехАу
5. КЛАССИФИКАЦИЯ ВЕЩЕСТВ
ВЕЩЕСТВАПРОСТЫЕ
СЛОЖНЫЕ
Ме
неМе
Оксиды
ЭхОу
Основания
Ме(ОН)у
Кислоты
НхА
Соли
МехАу
6.
СТРОЕНИЕВЕЩЕСТВА.
ХИМИЧЕСКАЯ
СВЯЗЬ.
7.
ХИМИЧЕСКАЯ СВЯЗЬ- возникает благодаря
взаимодействию между
электронами различных
атомов.
8. Электроотрицательность. Виды химической связи.
Э.О. – свойство атомов данного элементаоттягивать на себя электроны от атомов
других элементов.
Чем больше э.о. тем активнее неметалл, а
чем меньше тем активнее металл.
9. ИЗМЕНЕНИЕ ЭО АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
ПО ГРУППЕПО ПЕРИОДУ
По периоду слева направо ЭО возрастает.
Т.к. увеличивается количество электронов
на последнем энергетическом уровне и заряд
ядра, следовательно радиус атома уменьшается,
атому становится легче притянуть электроны.
По группе сверху в низ ЭО убывает.
Т.к. увеличивается количество энергетических
уровней, следовательно радиус атома
увеличивается,атому тяжелее притянуть
Электроны.
10. ВИДЫ ХИМИЧЕСКИХ СВЯЗЕЙ
Ионная (И.С.)Металлическая (Ме.С.)
Образуется между Ме и неМе
Образована атомами Ме
Ковалентная (К.С.)
Ковалентная
неполярная
(КНС)
Образуется между
одинаковыми неМе
Ковалентная
полярная
(КПС)
Образуется между
разными неМе,
реже между Ме и неМе
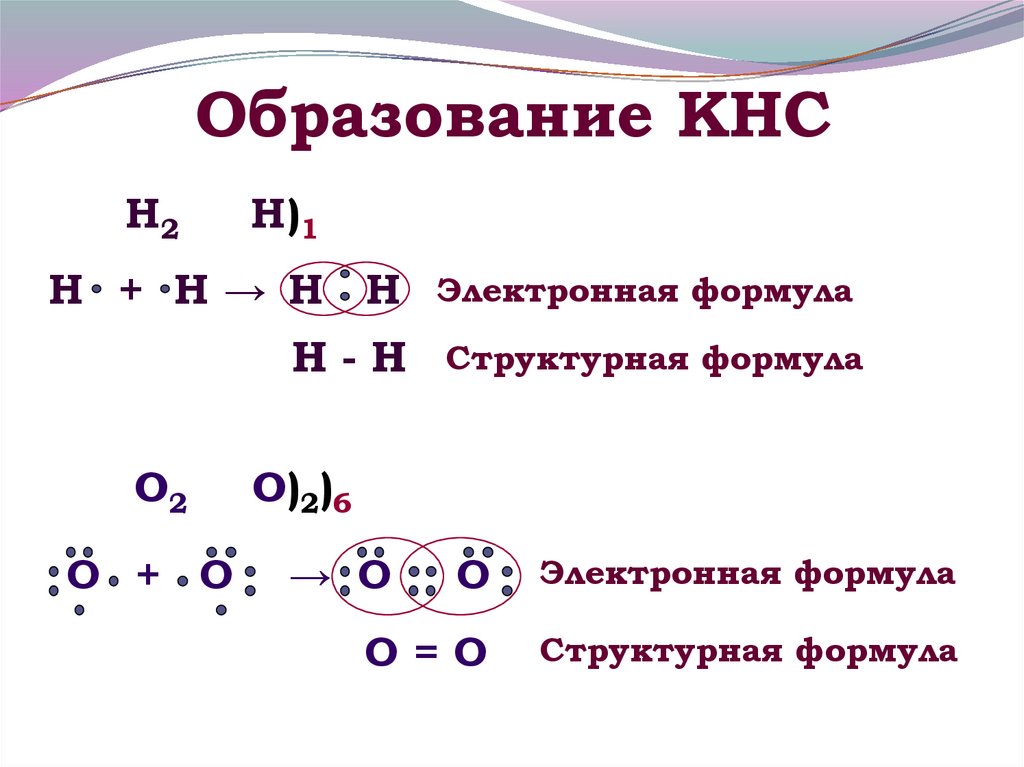
11. Образование КНС
Н2Н)1
Н + Н→ Н Н
Электронная формула
Н - Н Структурная формула
О2
О + О
О)2)6
→ О
О
Электронная формула
О=О
Структурная формула
12. Образование КПС
HClН)1
Cl)2 )8 )7
Н + Cl → Н Cl
Электронная
формула
H2O
Н
Н
+ O
Н)1
→
Hδ+ → ClδСтруктурная
формула
O)2 )6
Н
Н O
Hδ+ → Oδ- ← H
δ+
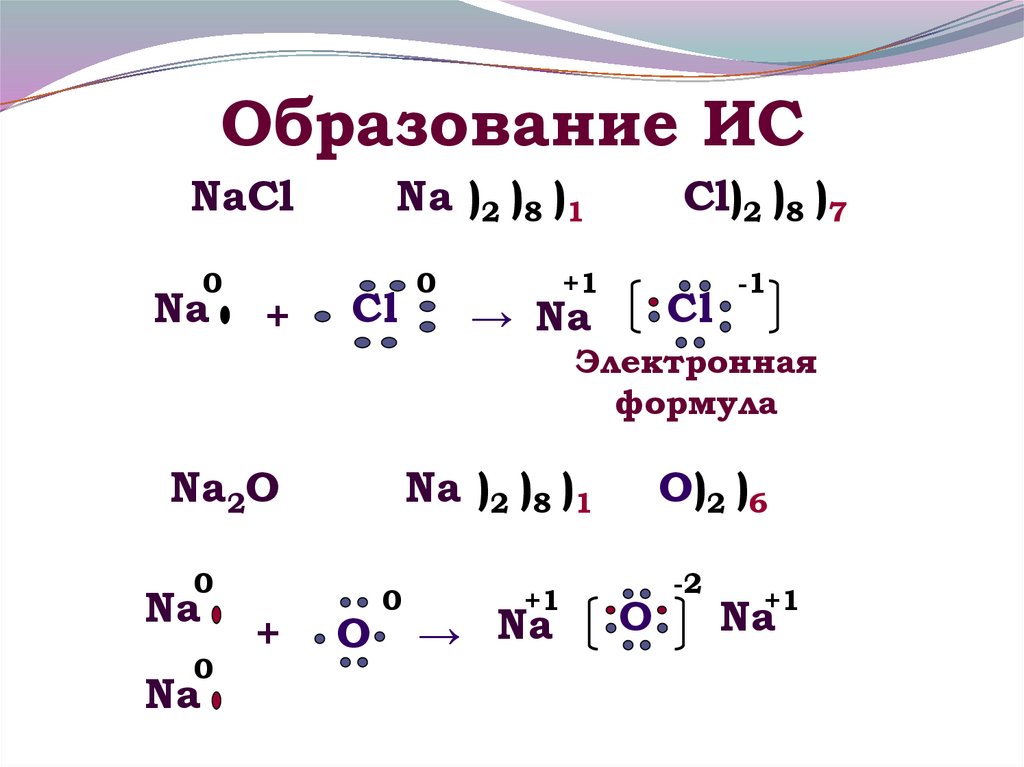
13. Образование ИС
NaCl0
Na
+
Na )2 )8 )1
Cl
0
Cl)2 )8 )7
+1
Cl
→ Na
-1
Электронная
формула
Na2O
Na )2 )8 )1
0
Na
0
Na
+
O
0
+1
→ Na
O)2 )6
O
-2
Na+1








 Химия
Химия








