Похожие презентации:
Интеграция надлежащей инженерной практики (GEP) в фармацевтическую систему качества
1.
Интеграция надлежащей инженернойпрактики (GEP)
в фармацевтическую систему качества
2.
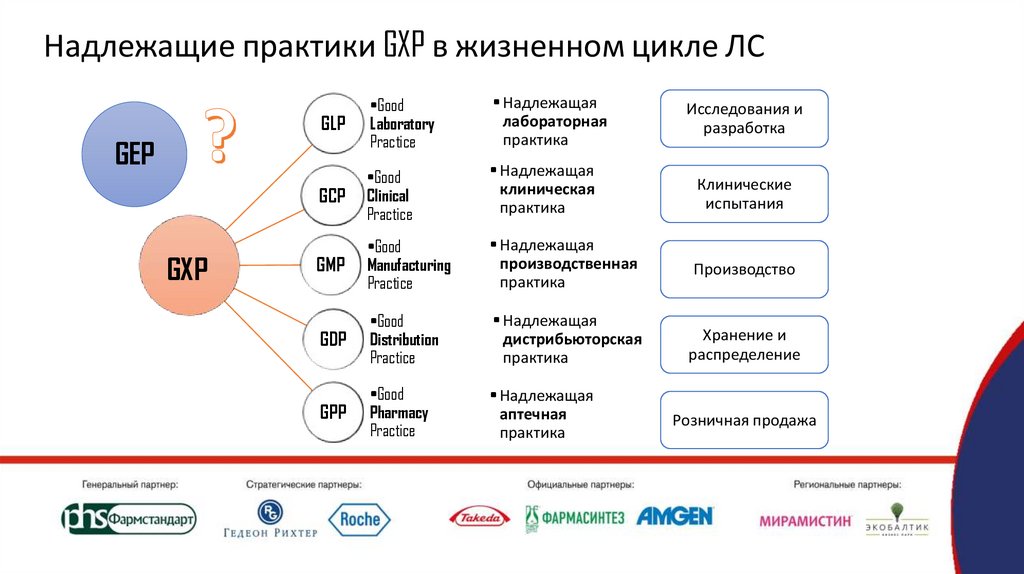
Надлежащие практики GXP в жизненном цикле ЛСGLP
•Good
Laboratory
Practice
• Надлежащая
лабораторная
практика
GCP
•Good
Clinical
Practice
• Надлежащая
клиническая
практика
Клинические
испытания
GMP
•Good
Manufacturing
Practice
• Надлежащая
производственная
практика
Производство
GDP
•Good
Distribution
Practice
• Надлежащая
дистрибьюторская
практика
Хранение и
распределение
GPP
•Good
Pharmacy
Practice
• Надлежащая
аптечная
практика
GEP
GXP
Исследования и
разработка
Розничная продажа
3.
Определения GMP и GEPНадлежащая производственная практика (GMP)
Часть менеджмента качества, которая гарантирует, что продукция постоянно производится и контролируется по
стандартам качества, соответствующим ее назначению, а также в соответствии с требованиями регистрационного
досье, протокола клинических исследований или спецификации на эту продукцию
EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use
EudraLex, Vol. 4
Надлежащая инженерная практика (GEP)
Cовокупность установленных инженерных методов и стандартов, которые применяются на протяжении жизненного цикла
проекта с целью предоставления оптимальных и экономически эффективных инженерных решений
ISPE Baseline Pharmaceutical Engineering Guide.
Vol.5. Commissioning and Qualification. 1st Edition.- ISPE, 2001.
4.
Цели и соотношение GEP и GXPGEP
• Предоставление оптимальных и
экономически эффективных решений
GXP
• Качество, безопасность и
эффективность лекарственных средств
GEP
GXP
5.
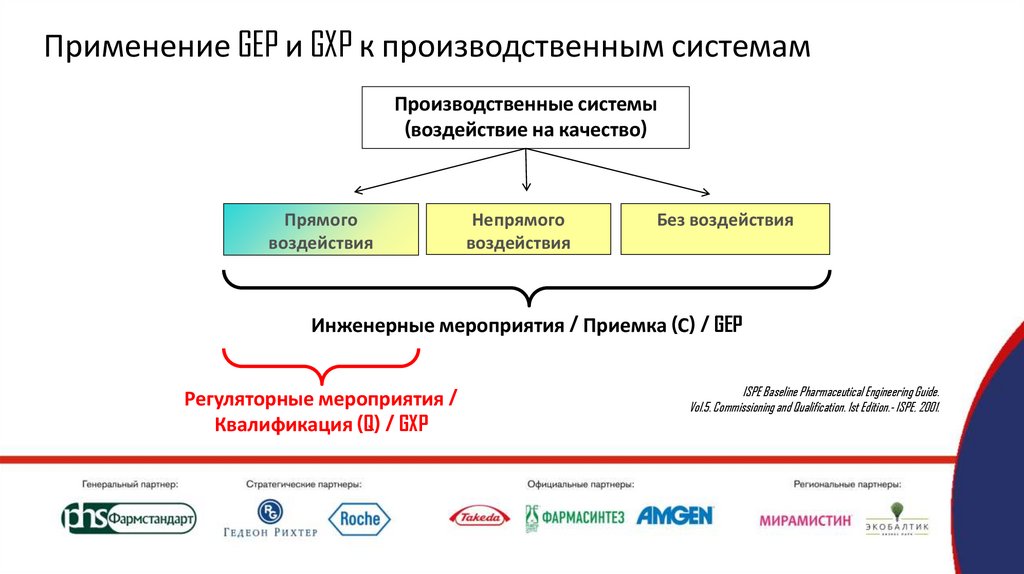
Применение GEP и GXP к производственным системамПроизводственные системы
(воздействие на качество)
Прямого
воздействия
Непрямого
воздействия
Без воздействия
Инженерные мероприятия / Приемка (С) / GEP
Регуляторные мероприятия /
Квалификация (Q) / GXP
ISPE Baseline Pharmaceutical Engineering Guide.
Vol.5. Commissioning and Qualification. 1st Edition.- ISPE, 2001.
6.
GEP в жизненном цикле производственных системНАДЛЕЖАЩАЯ ИНЖЕНЕРНАЯ ПРАКТИКА
Знания о
продукте
Знания о
процессе
Требования
Регуляторные
требования
Корпоративные
требования
к качеству
Разработка
спецификации
и проектирование
Верификация
Приемка
и выпуск
Эксплуатация
и непрерывное
улучшение
УПРАВЛЕНИЕ РИСКАМИ
ЭКСПЕРТИЗА ПРОЕКТА
УПРАВЛЕНИЕ ИЗМЕНЕНИЯМИ
ASTM E2500: Стандартное руководство по разработке спецификации, проектированию и верификации
фармацевтических и биофармацевтических производственных систем и оборудования
7.
Применение GEP и GMP к критической производственной системеGEP
GXP
• Инженерные
• Эффективность
• Регуляторные
• Качество ЛС
Критическая производственная система (воздействие на качество ЛС)
8.
Ключевые элементы, подтверждающие наличие GEPРуководство по надлежащей инженерной практике
Формулирование требований к оборудованию и системам в URS
Применение методов управления проектами
Изложение методов выполнения инженерных мероприятий в письменных процедурах
Наличие и поддержание записей о выполнении инженерных мероприятий
Программы и планы ТО, разработанные на основе оценки всех аспектов оборудования
(исполнение, критичность, функции и др.)
Мониторинг эффективности использования производственных систем, проведения ТО и других
инженерных мероприятий, включая анализ тенденций
Контроль затрат на проведение инженерных мероприятий
Управление всеми фазами жизненного цикла производственных систем
Внутренние аудиты состояния инженерного менеджмента
Управление поставщиками оборудования, сменных частей и услуг
9.
Общие области и инструменты GEP и GXPПроведение оценки рисков для качества (RA/IA)
Спецификации требований пользователя (URS)
Экспертиза и квалификация проекта (DR/DQ)
Приемка и квалификация оборудования и систем (FAT/SAT, IQ/OQ)
Эксплуатация и ТО оборудования
Система документации и записи
Управление изменениями
Мониторинг и контроль выполнения
Проведение внутренних аудитов
Управление поставщиками
Непрерывное улучшение
10.
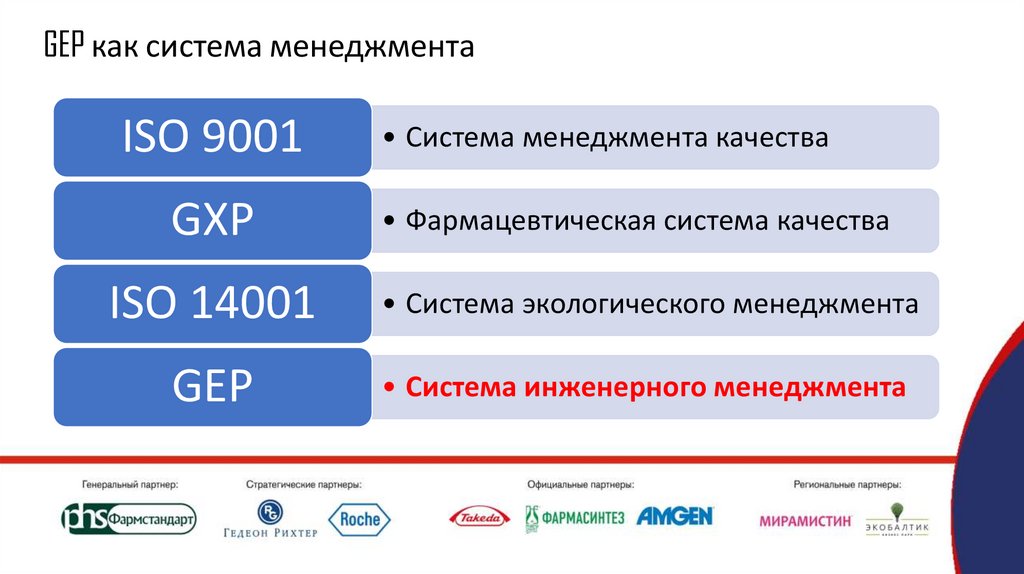
GEP как система менеджментаISO 9001
GXP
• Система менеджмента качества
• Фармацевтическая система качества
ISO 14001
• Система экологического менеджмента
GEP
• Система инженерного менеджмента
11.
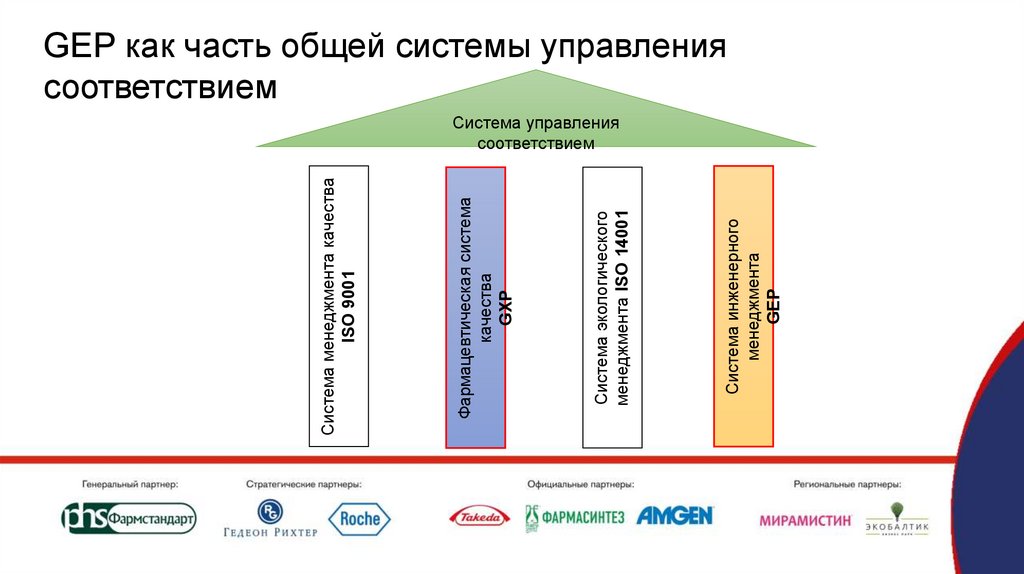
Система инженерногоменеджмента
GEP
Система экологического
менеджмента ISO 14001
Фармацевтическая система
качества
GXP
Система менеджмента качества
ISO 9001
GEP как часть общей системы управления
соответствием
Система управления
соответствием
12.
Пример интеграции GEP и СМК (NNE Pharmaplan)QMS
GEP
Our
Model
Процедуры
СМК
(63)
Стандарты и Руководства
GEP (около 400 статей)
Our Wiki
13.
Преимущества внедрения GEP• «Гладкое» выполнение проектов
• Оптимизация затрат на инженерные мероприятия и технические средства
• Достижение и поддержание высокого качества проектов
• Поддержание надлежащей эксплуатации и ТО производственных систем
• Поддержка регуляторных мероприятий (GXP)
• «Синергетическое» использование ресурсов в управлении









 Медицина
Медицина








