Похожие презентации:
Химические реакции. Тепловой эффект
1. Тема Урока: Химические реакции, Тепловой эффект
ТЕМА УРОКА:ХИМИЧЕСКИЕ
РЕАКЦИИ,
ТЕПЛОВОЙ ЭФФЕКТ
Преподаватель:
Ярмагаметова Ханифа Фахрединовна
2. Цель урока:
ЦЕЛЬ УРОКА:Обеспечить развитие представлений учащихся
о законе сохранения энергии.
Организовать деятельность учащихся по
применению знаний закона сохранения
энергии в разнообразных ситуациях.
3.
Количество теплоты, которое выделяется илипоглощается при химической реакции,
называют тепловым эффектом реакции.
Тепловой эффект обозначается Q и измеряется
в Дж или кДж.
4. Классификация химических реакций по тепловому эффекту
КЛАССИФИКАЦИЯХИМИЧЕСКИХ
РЕАКЦИЙ ПО ТЕПЛОВОМУ ЭФФЕКТУ
идут с выделением энергии
S + O2 = SO2 – Q
идут с поглощением энергии
N2 + O2 = 2NO – Q
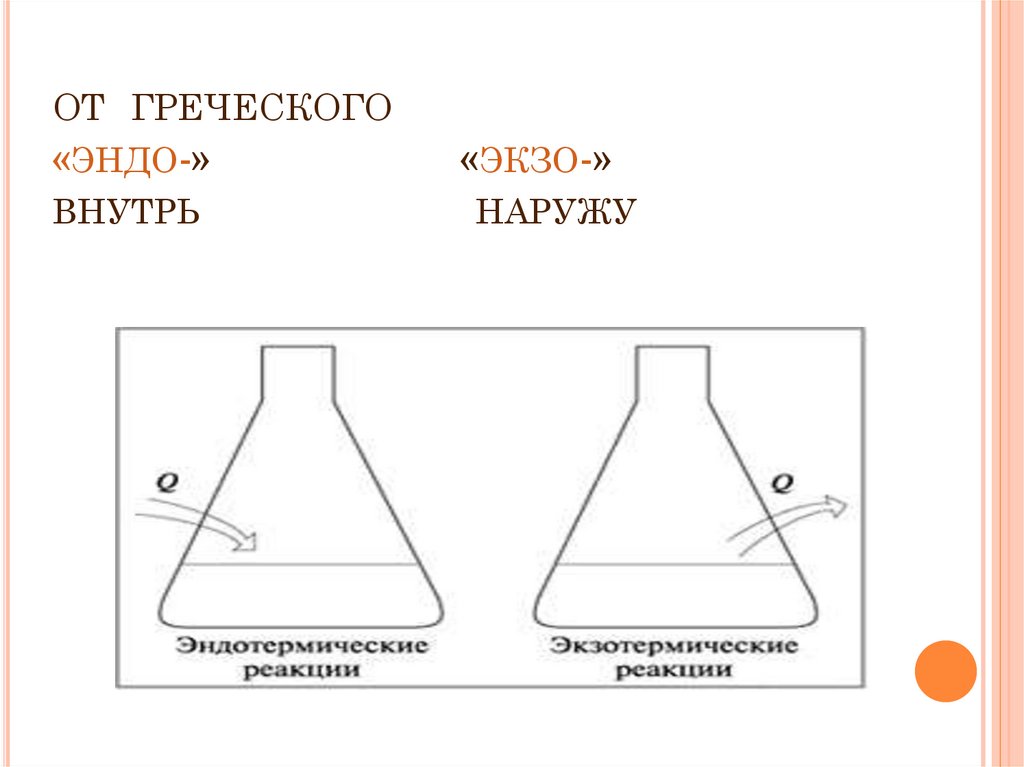
5. от греческого «эндо-» «экзо-» внутрь наружу
ОТ ГРЕЧЕСКОГО«ЭНДО-»
ВНУТРЬ
«ЭКЗО-»
НАРУЖУ
6.
Химические уравнения, в которых указываетсятепловой эффект, называют термохимическими.
Например:
2HgO —> 2Hg + O2 – 180 кДж,
С(тв) + O2(г) —> СO2(г) + 394 кДж
7. Герман Иванович Гесс
ГЕРМАН ИВАНОВИЧ ГЕСС-Российский академик
-Основоположник термохимии
Термохимия
— раздел химии, в
задачу которого входит определение и
изучение тепловых эффектов реакции
8. Алгоритм решения задач по термохимическому уравнению
АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ ПОТЕРМОХИМИЧЕСКОМУ УРАВНЕНИЮ
Кратко записать условия задачи (“дано”).
Записать термохимическое уравнение реакции
(ТХУ), одной чертой в уравнении реакции
подчеркнуть то, что известно и то, что необходимо
определить.
Провести вспомогательные вычисления. m=M*v
Составить пропорцию, используя вспомогательные
вычисления и условия задачи, и решить ее.
Записать ответ.
9. Заполни пропуски
ЗАПОЛНИ ПРОПУСКИ1. Реакции, протекающие с выделением теплоты и
света называются реакциями …..
а) разложения;
б) эндотермические;
в) экзотермические
г)замещения
10.
2. Какие схемы можно назватьтермохимическими уравнениями реакций?
а) 2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
б) 2 H2 + O2 = 2 H2О + 572 кДж
в) 2 H2(г) + O2(г) = 2 H2О(ж)
11.
3. Какая запись, соответствует эндотермическойреакции?
а) С(тв) + O2(г) = СO2(г) + 394 кДж
б) СаСO3 = СO2 + СаО – 310 кДж
г) Н2 + I2 = 2HI – 52 кДж
д) 3Fe + O2 = Fe3O4 + 118 кДж
12.
4. Приведены уравнения реакций:1. С+О2 = СО2 + 402,24кДж
2. 2HgO = 2Hg + О2 -180кДж
Определите тип, к которому относятся данные
реакции.
А) обе реакции экзотермические
Б) обе реакции эндотермические
В) А – эндотермическая, а Б – экзотермическая
Г) А – экзотермическая, а Б – эндотермическая
13. Домашнее задание
ДОМАШНЕЕ ЗАДАНИЕЧто происходит с энергией при разрыве химических связей?
Что происходит с энергией при образовании химических
связей?
Что мы можем наблюдать при выделении энергии (теплоты)?
Как называются реакции, идущие с выделением теплоты?
Что мы можем наблюдать при поглощении энергии (теплоты)?
Как называются реакции, идущие с поглощением теплоты?
Как называется теплота (энергия) образующаяся при
химических реакциях?
Как записать в уравнение химической реакции выделяющуюся
теплоту? Поглощающуюся теплоту?
Для чего необходимо знать тепловой эффект химической
реакции?
14. Литературы:
ЛИТЕРАТУРЫ:Нурахметов Н.2016г стр.69













 Химия
Химия








