Похожие презентации:
Окислительновосстановительные реакции. 9 класс
1.
Тема урока: «Окислительновосстановительные реакции»«
Кто-то теряет, а кто-то находит.»
2.
Повторение изученного ранееЧто такое атом?
Что такое ион?
Чем отличается ион от атома?
Какие типы реакций вам
знакомы?
Что такое степень окисления?
Как определять степень
окисления?
3.
Правила вычисления степени окисления(СО) элементов:
4.
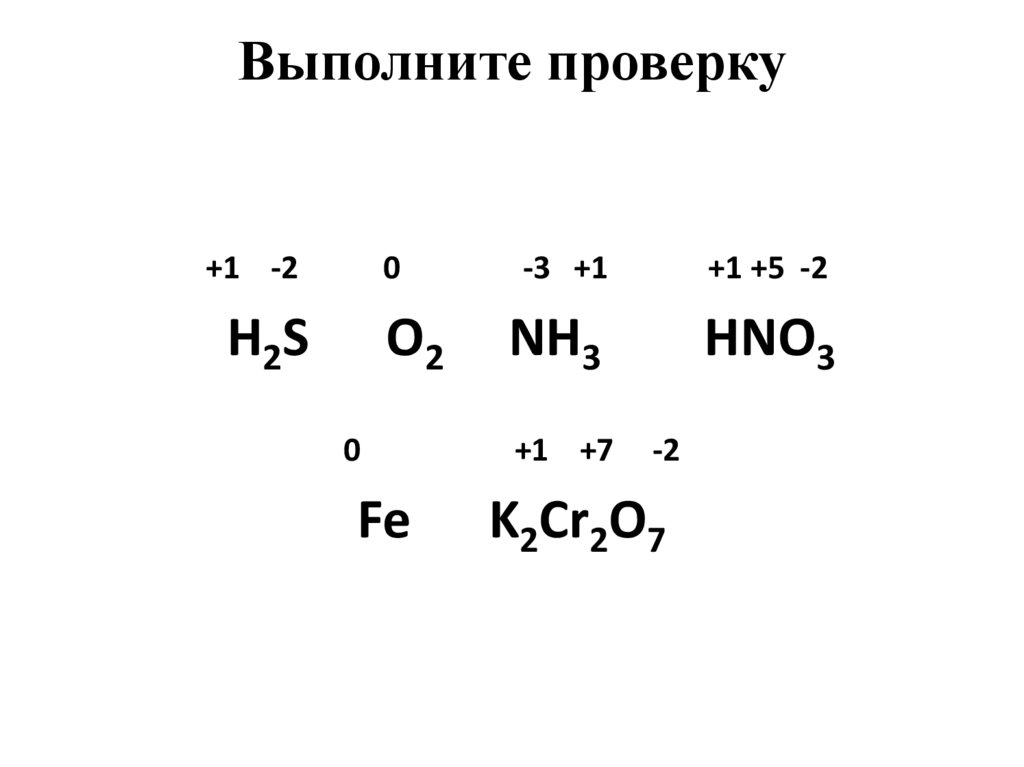
Задание № 1Определите степени окисления атомов
химических элементов по формулам их
соединений:
H2S, O2, NH3, HNO3, Fe, K2Cr2O7
5.
Выполните проверку+1 -2
0
H2S
O2
0
Fe
-3 +1
+1 +5 -2
NH3
HNO3
+1 +7
-2
K2Cr2O7
6.
Расставьте степени окисления элементов в реакциях.Сравните, как ведут себя степени окисления в
процессе реакции.
+1
+1
-1
-2 +1
+1
-1
+1
-2
HCl + NaOH = NaCl + H2O
+1 -1
0
+2
-1
0
Окислительновосстановительная
2
реакция
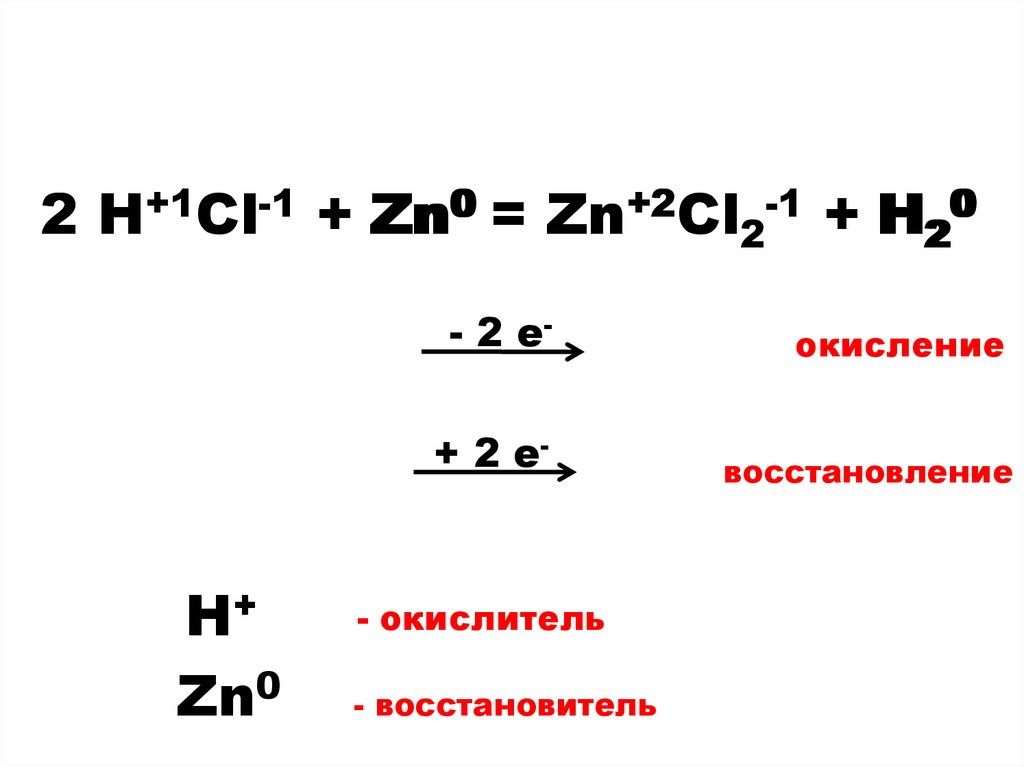
2 HCl + Zn = ZnCl2 + H
Реакции, в которых происходит изменение степеней
окисления, называются
окислительно-восстановительными
7.
2 H++1Cl-1 + Zn0 = Zn+2Cl2-1 + H2200H+
Zn0
- 2 е-
окисление
+ 2 е-
восстановление
- окислитель
- восстановитель
8.
Окисление – процесс отдачи электронов.Восстановление – процесс присоединения
электронов.
Окислитель – элемент, принимающий
электроны.
Восстановитель – элемент, отдающий
электроны.
9.
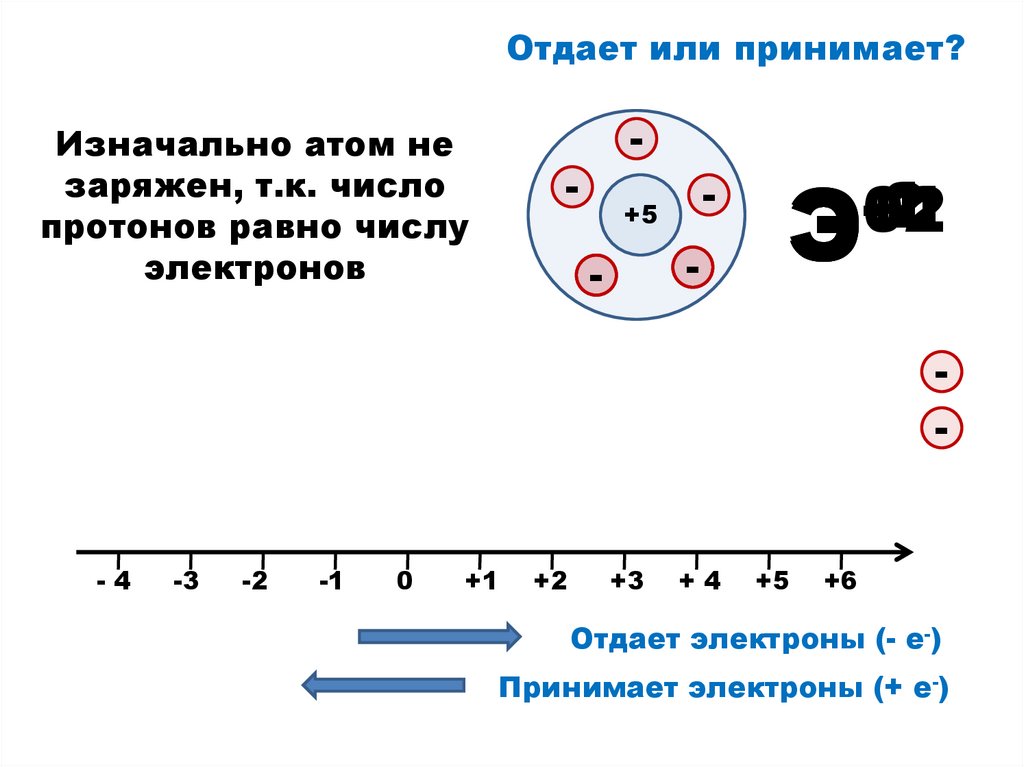
Отдает или принимает?Изначально атом не
заряжен, т.к. число
протонов равно числу
электронов
-
-
-
+5
-
-
-2
-1
+1
+2
0
Э
-
-4
-3
-2
-1
0
+1
+2
+3
+4
+5
+6
Отдает электроны (- е-)
Принимает электроны (+ е-)
10.
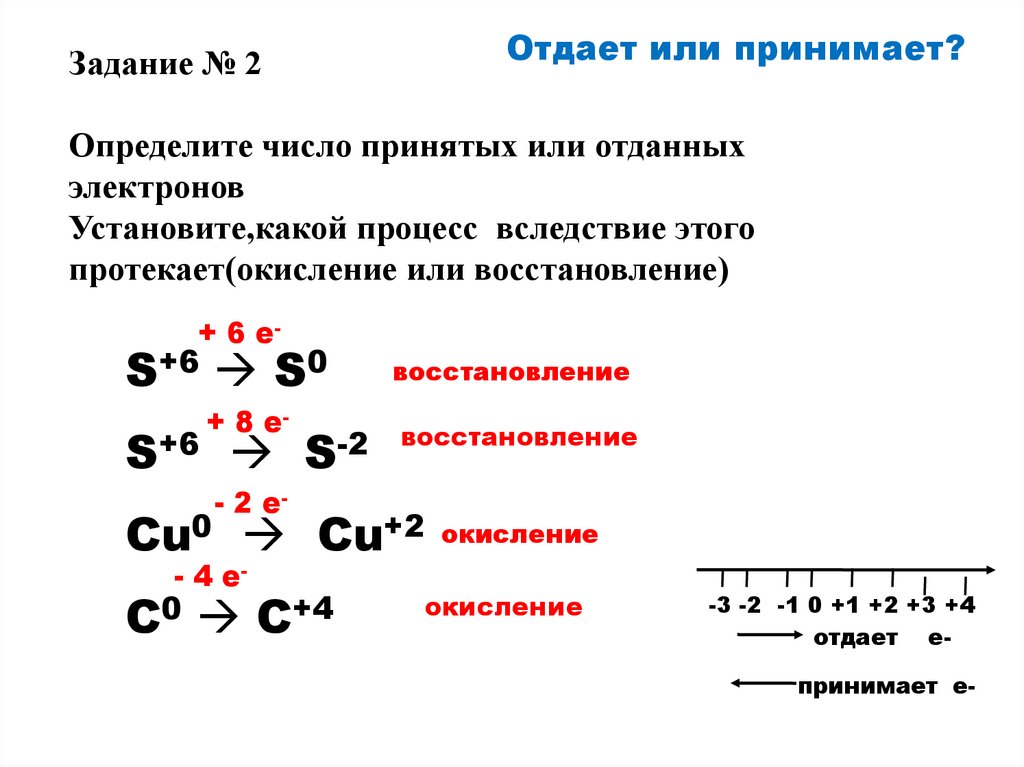
Отдает или принимает?Задание № 2
Определите число принятых или отданных
электронов
Установите,какой процесс вследствие этого
протекает(окисление или восстановление)
+ 6 e-
S+6 S0
S+6
+ 8 e-
S-2
- 2 e-
восстановление
восстановление
Cu0 Cu+2
- 4 e-
C0
C+4
окисление
окисление
-3 -2 -1 0 +1 +2 +3 +4
отдает епринимает е-
11.
Какая польза от теории ОВР?Например, расстановка коэффициентов в
сложных уравнениях – метод электронного
баланса (составление схемы)
+1 -1
+1
+7 -2
+2
-1
+1 -1
0
+1 -2
16 HCl +2 KMnO4 =2 MnCl2 +2 KCl +5 Cl2+ 8 H2O
Mn+7
+5е
2Cl-1
-2е
Mn+2
Cl20
Mn+7 – окислитель
Сl -1 – восстановитель
2
Восст-ие
5
окисление
10
12.
Алгоритм составления уравнений ОВР исхемы электронного баланса
(записать в тетрадь)
1. Записать схему реакции и
определить степень окисления атомов,
2. Составить схемы эл. баланса с
указанием числа отданных и принятых
электронов,
3. Подобрать НОК и рассчитать
коэффициенты,
4.Указать окислитель и восстановитель и
название процессов,
5. Перенести эти коэффициенты в
уравнение ОВР и подобрать коэффициенты
перед формулами других веществ.
13.
№1Карбонат кальция+соляная кислота=
CaCO₃ + 2HCl(разб.) → CaCl₂ + CO₂↑ + H₂O
№2
Нитрат серебра + Медь=
AgNO3 + Cu → Cu(NO3)2 + Ag↓
Задание: найти окислительновосстановительную реакцию и уравнять ее
методом электронного баланса
14.
ОВР в быту15.
Горение газа на кухнеГаз метан горит бесцветным пламенем с образованием
воды и углекислого газа
СН4+2О2=СО2+2Н2О
16.
Отбеливание тканиПри обработке персолью отбеливание
происходит за счет окисления
загрязнений
2H2O2=2H2O+O2.
Для того чтобы образующийся
кислород не улетучивался
из емкости, лучше
держать ее
закрытой.
17.
Коррозия металлаПри взаимодействии железа и кислорода
образуется ржавчина.
4Fe+ 2O2= 2Fe2O3
18.
Вывод:Мы часто сталкиваемся с окислительновосстановительными реакциями в быту:
• при горении газа;
• при коррозии металлов;
• при отбеливании ткани
• при промывания ран.
19.
Задание №31. Из приведенных схем уравнений реакций
выпишите те, которые можно отнести к ОВР
2. в реакциях ОВР составьте схему
электронного баланса
• СаСО3
=>
СаО + СО2
• KMnO4 > K2 MnО4 + MnО2 + О2
• CuS + О2 =>
СuО + SО2
















 Химия
Химия








