Похожие презентации:
Растворы. Общие свойства растворов
1. РАСТВОРЫ Общие свойства растворов
ЛитератураКоровин Н.В. Общая химия. ─ М.: Высш.
шк., 2000. ─ 558 с., §§ 8.1, 8.3
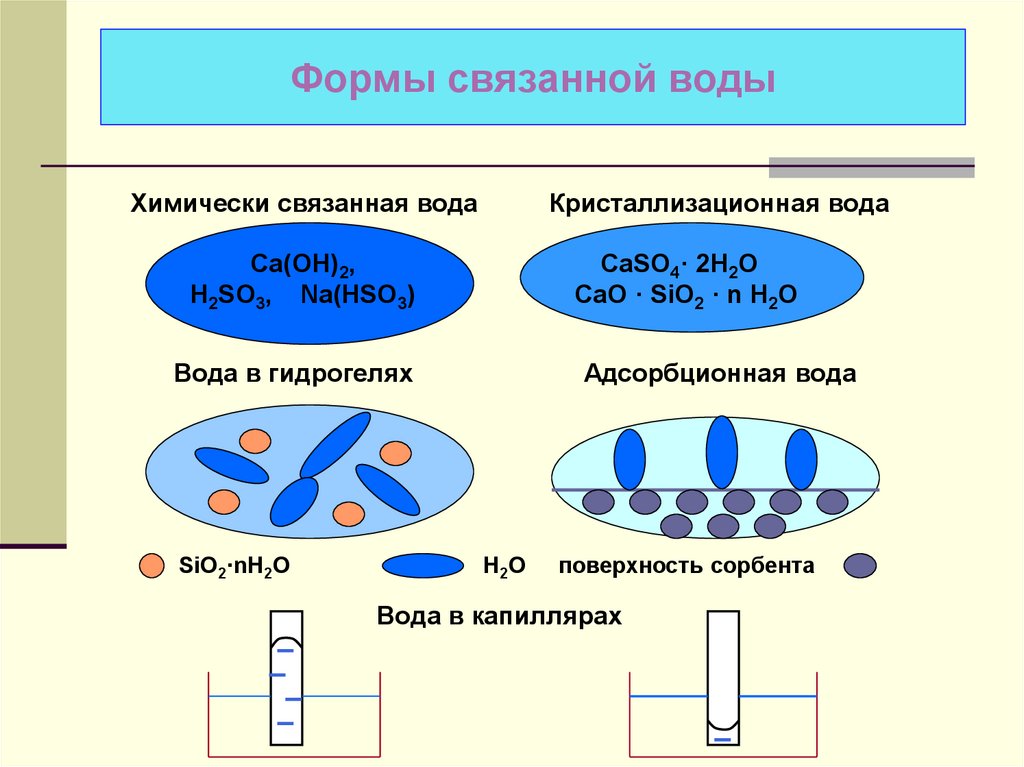
2. Формы связанной воды
Химически связанная водаКристаллизационная вода
Са(ОН)2,
H2SO3, Na(HSO3)
CaSO4· 2H2O
CaO · SiO2 · n H2O
Вода в гидрогелях
SiO2·nH2O
Адсорбционная вода
H2O
поверхность сорбента
Вода в капиллярах
3. Термодинамика растворения
Δ G растворения < 0Δ G растворения = Δ Н растворения ─ Т· Δ S растворения
Δ Н растворения ─ изменение энтальпии при образовании раствора;
Т ─ температура образования раствора;
Δ S растворения ─ изменение энтропии при образовании раствора
Δ Н растворения = Δ Н1
Δ Н1
+
Δ Н2
+
Δ Н3
─ изменение энтальпии разрыва химических связей (Δ Н1 > 0);
Δ Н2 ─ изменение энтальпии сольватации (Δ Н1 < 0);
Δ Н3 ─ изменение энтальпии диффузии (Δ Н3 > 0)
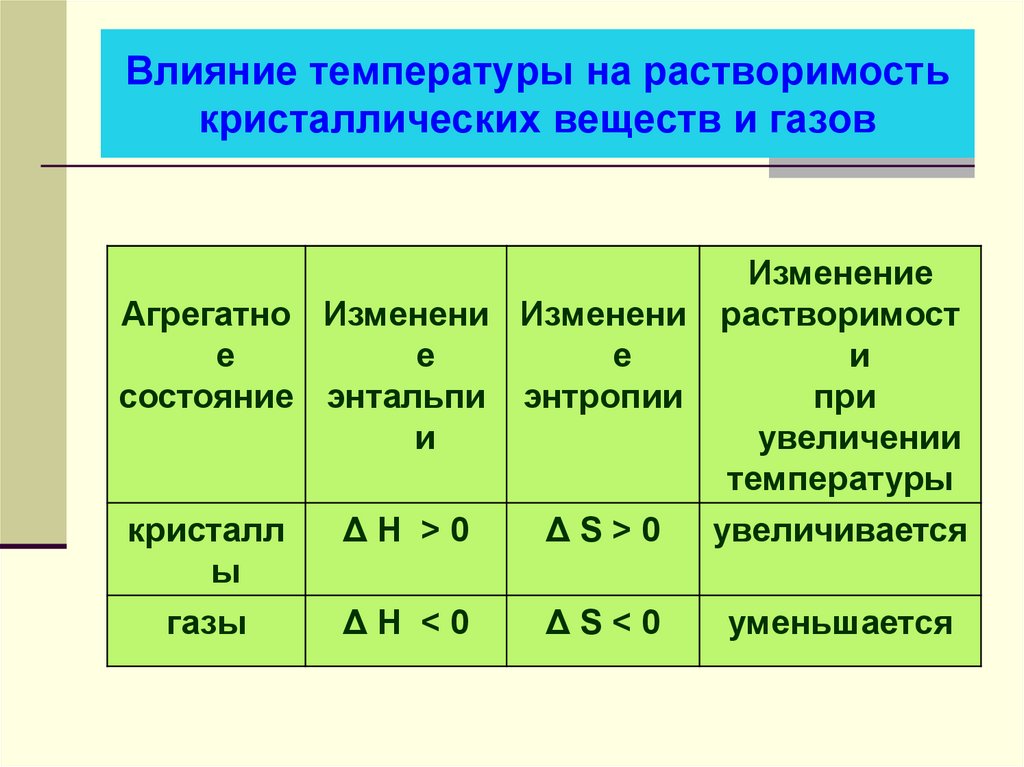
4. Влияние температуры на растворимость кристаллических веществ и газов
ИзменениеАгрегатно Изменени Изменени растворимост
е
е
е
и
состояние энтальпи энтропии
при
и
увеличении
температуры
кристалл
ΔН >0
ΔS>0
увеличивается
ы
газы
ΔН <0
ΔS<0
уменьшается
5. Растворимость
растворениеРастворяемое вещество (фаза) <==============> Раствор
образование фазы
Раствор, в котором устанавливается равновесие между
растворением и образованием ( осаждением,
кристаллизацией, выделением) вещества,
называется насыщенным, а концентрация такого раствора
─ растворимостью
Хорошо растворимое ─ 1 г/100 г растворителя
Малорастворимое ─ (1 …0,001) г/100 г растворителя
Нерастворимое ─ менее 0,001 г/100 г растворителя
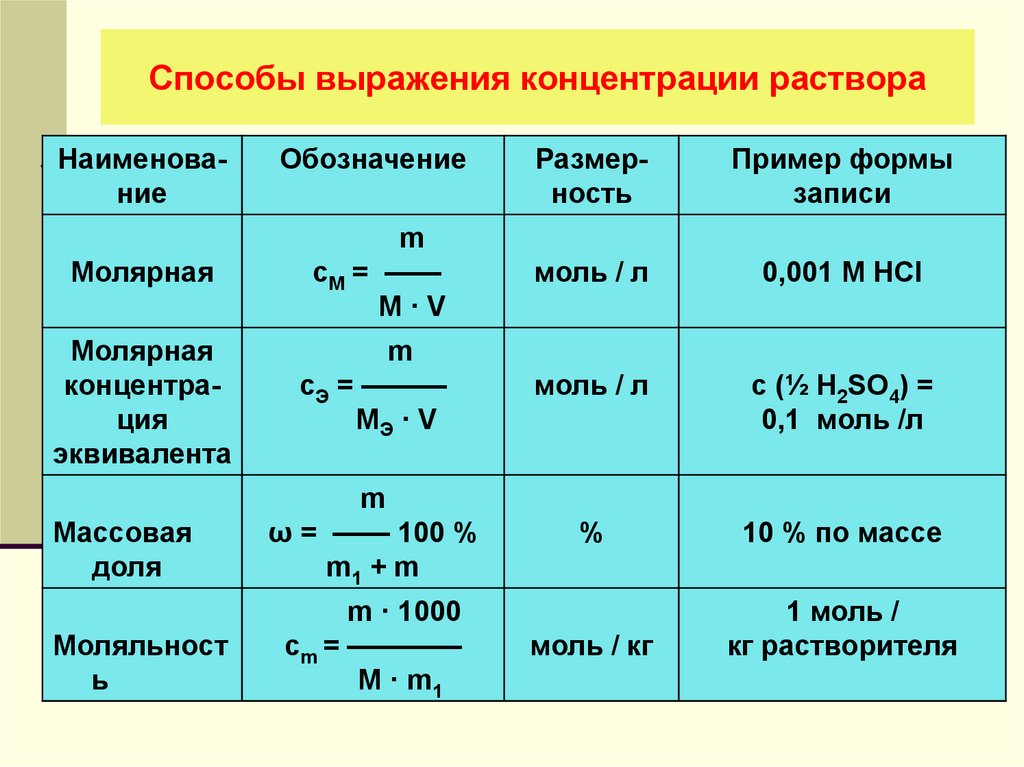
6. Способы выражения концентрации раствора
НаименованиеРазмерность
Пример формы
записи
Молярная
m
сМ = ——
M·V
моль / л
0,001 M HCl
Молярная
концентрация
эквивалента
m
сЭ = ———
МЭ · V
моль / л
c (½ H2SO4) =
0,1 моль /л
m
ω = —— 100 %
m1 + m
%
10 % по массе
моль / кг
1 моль /
кг растворителя
Массовая
доля
Моляльност
ь
Обозначение
m · 1000
сm = ————
M · m1
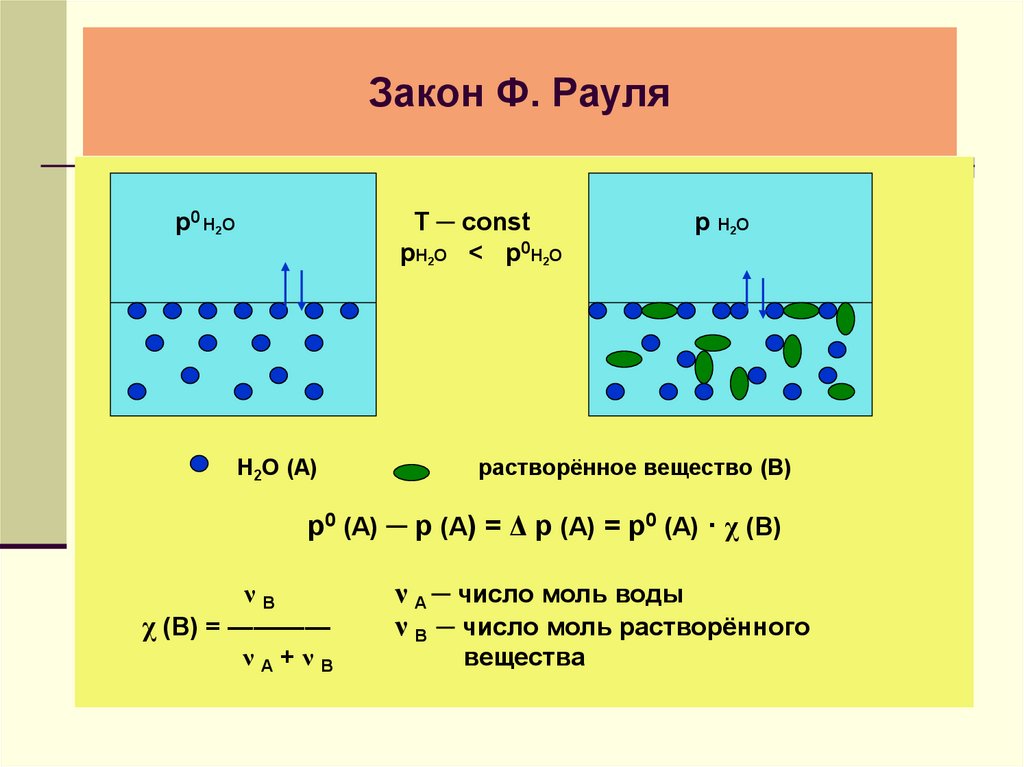
7. Закон Ф. Рауля
р0 Н2ОТ ─ const
рН2О < р0Н2О
Н2О (А)
р Н2О
растворённое вещество (В)
р0 (А) ─ р (А) = Δ р (А) = р0 (А) · χ (В)
νВ
χ (В) = ————
νА+νВ
ν А ─ число моль воды
ν В ─ число моль растворённого
вещества
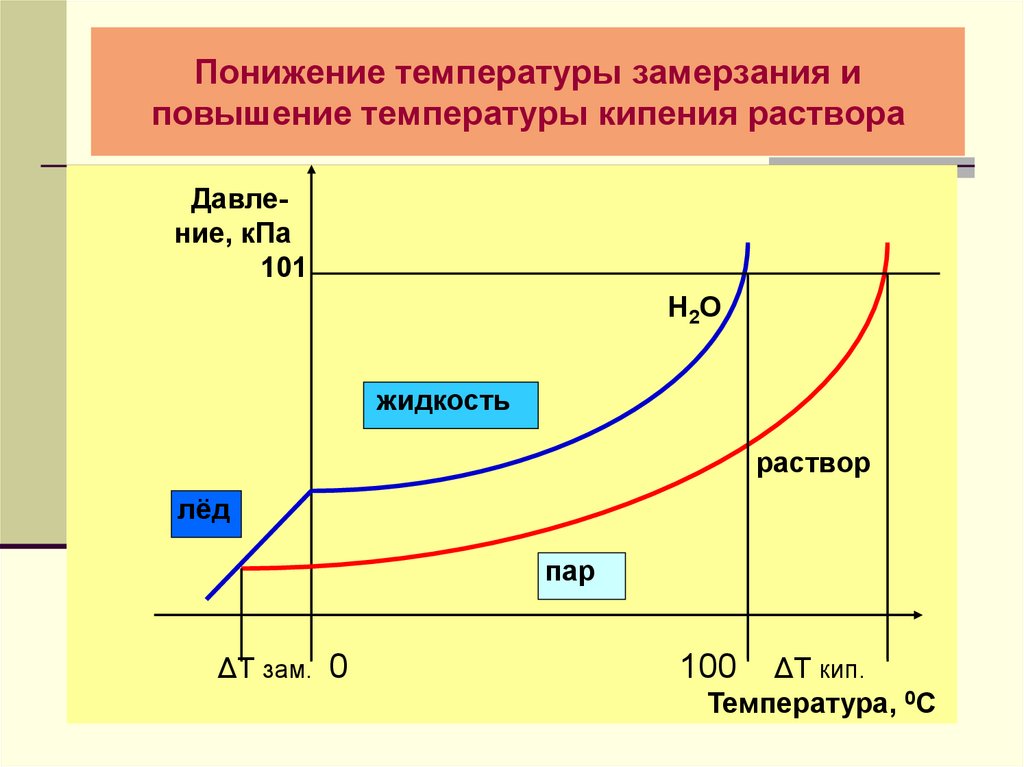
8. Понижение температуры замерзания и повышение температуры кипения раствора
Давление, кПа101
Н 2О
жидкость
раствор
лёд
пар
ΔТ зам. 0
ΔТ кип.
Температура, 0С
100
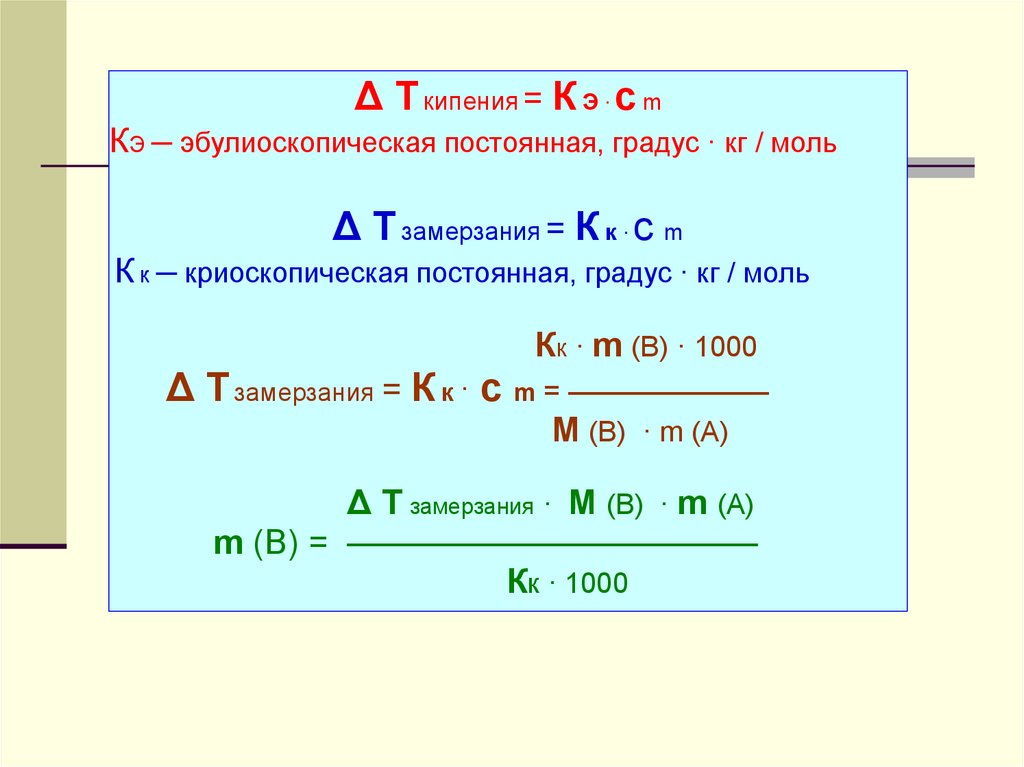
9.
Δ Т кипения = К Э · с mКЭ ─ эбулиоскопическая постоянная, градус · кг / моль
Δ Т замерзания = К к · с m
К к ─ криоскопическая постоянная, градус · кг / моль
Кк · m (В) · 1000
Δ Т замерзания = К к · с m = ———————
M (В) · m (А)
Δ Т замерзания · M (В) · m (А)
m (В) = ————————————
Кк · 1000
10.
Рассчитать массу хлорида натриянеобходимую для удаления с дорожного полотна
льда массой, соответствующей 50 кг жидкой воды,
если криоскопическая постоянная воды равна
1,86 градус · кг/ моль.
Температура окружающей среды минус 5 0С.
5 градус · 58,5 г/моль · 50 кг
m (NaCl) = ————————————— = 7,8 кг.
1,86 градус · кг/ моль · 1000
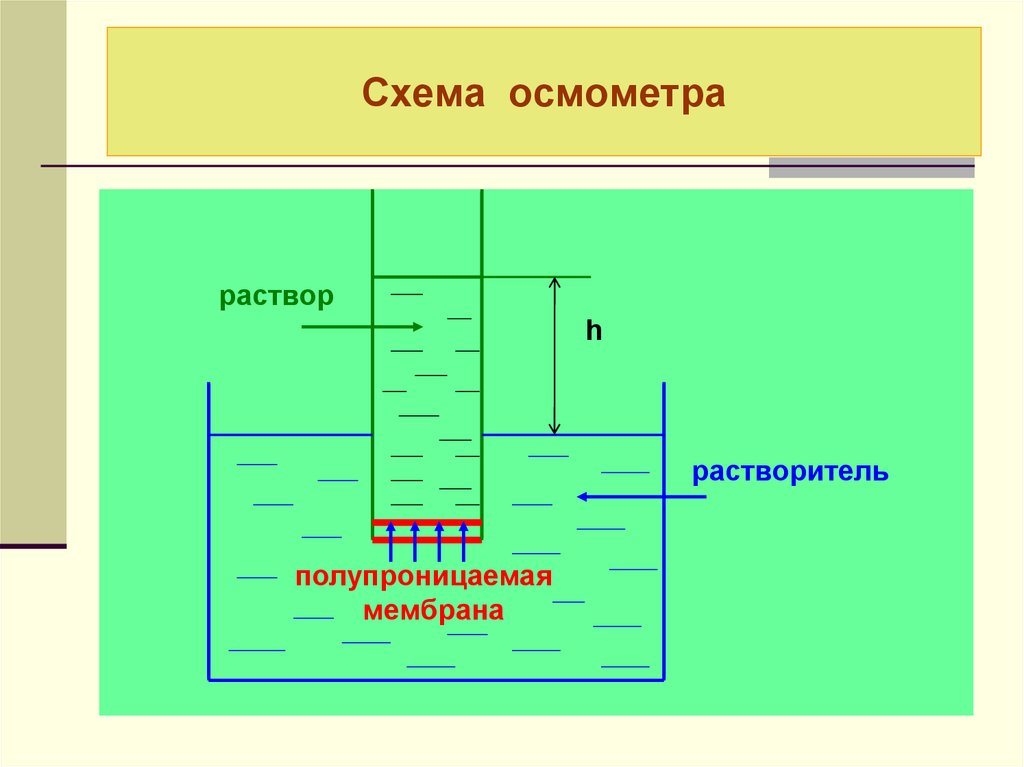
11. Схема осмометра
растворh
растворитель
полупроницаемая
мембрана
12. Закон Вант-Гоффа
Осмотическое давление пропорциональноконцентрации раствора и температуре
π = cм R T
Пример. Вычислить осмотическое давление раствора
глюкозы при 25 0С, если концентрация раствора
0,5 моль/л.
π = 0,5 моль/л · 8,31 (л · кПа)/( К · моль) · 298 К = 1238 кПа
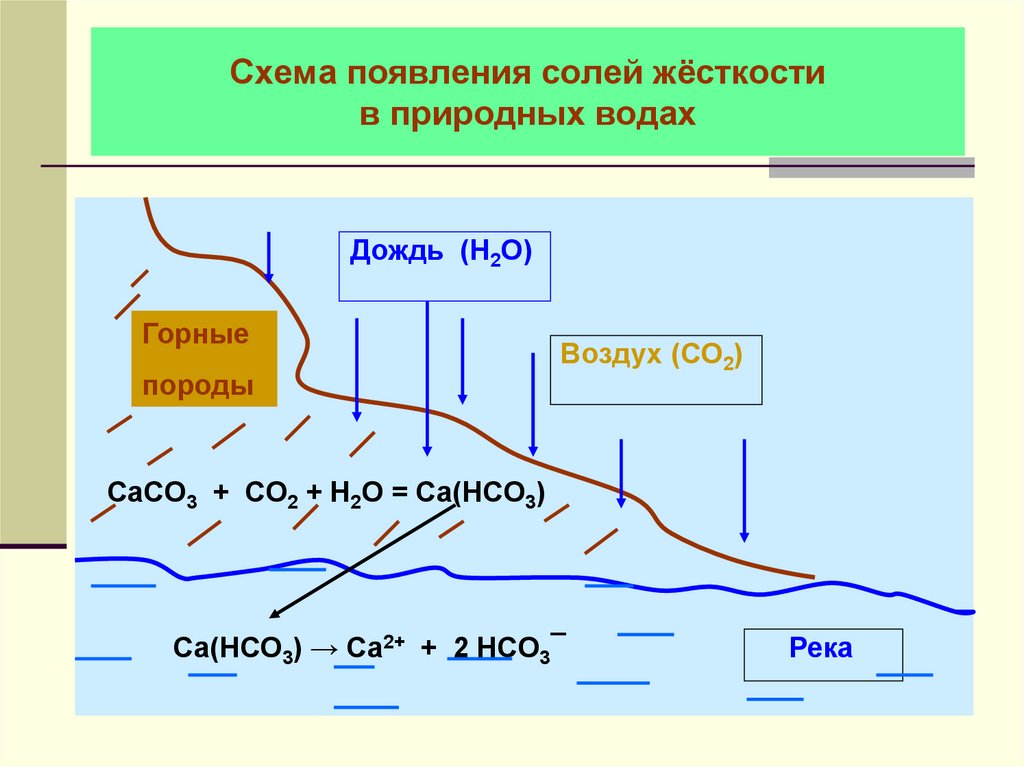
13. Схема появления солей жёсткости в природных водах
Дождь (Н2О)Горные
породы
Воздух (СО2)
CaCO3 + СО2 + Н2О = Са(НСО3)
Са(НСО3) → Са2+ + 2 НСО3¯
Река
14. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
ЛитератураКоровин Н.В. Общая химия. ─ М.: Высш. шк.,
2000. ─ 558 с., §§ 8.4
15. Формулы для расчёта осмотического давления и изменения температур кипения и замерзания растворов
ФакторФормулы для расчёта
неэлектролит
электролит
π = cм R T
π = i · cм R T
Повышение
температуры
кипения
Δ Т кипения =
Δ Т кипения =
= Кэ · с m
= i ·Кэ · с m
Понижение
температуры
замерзания
ΔТ
ΔТ
Осмотическое
давление
замерзания
= Кк · с m
замерзания
= i · Кк · с m
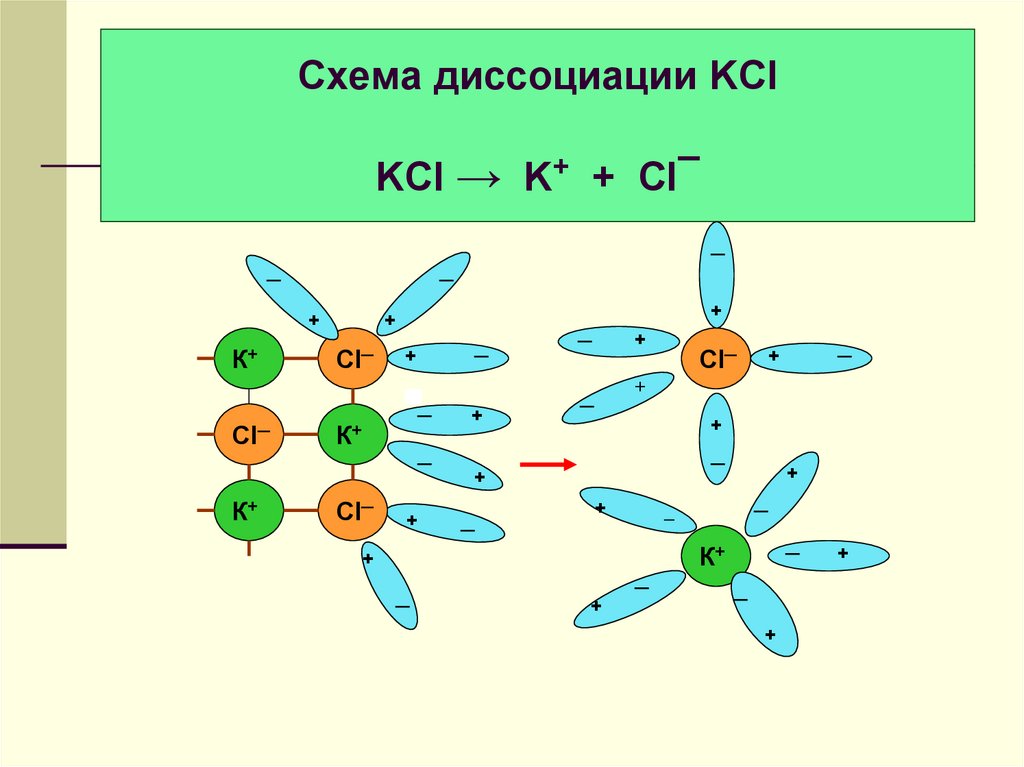
16. Схема диссоциации KCl KCl → K+ + Cl¯
──
─
+
К+
Cl─
+
+
Cl─
─
+
─
К+
─
К+
Cl─
+
+
─
+
Cl─
+
─
+
─
+
─
+
+
─
─
─
К+
+
─
─
+
─
+
─
+
+
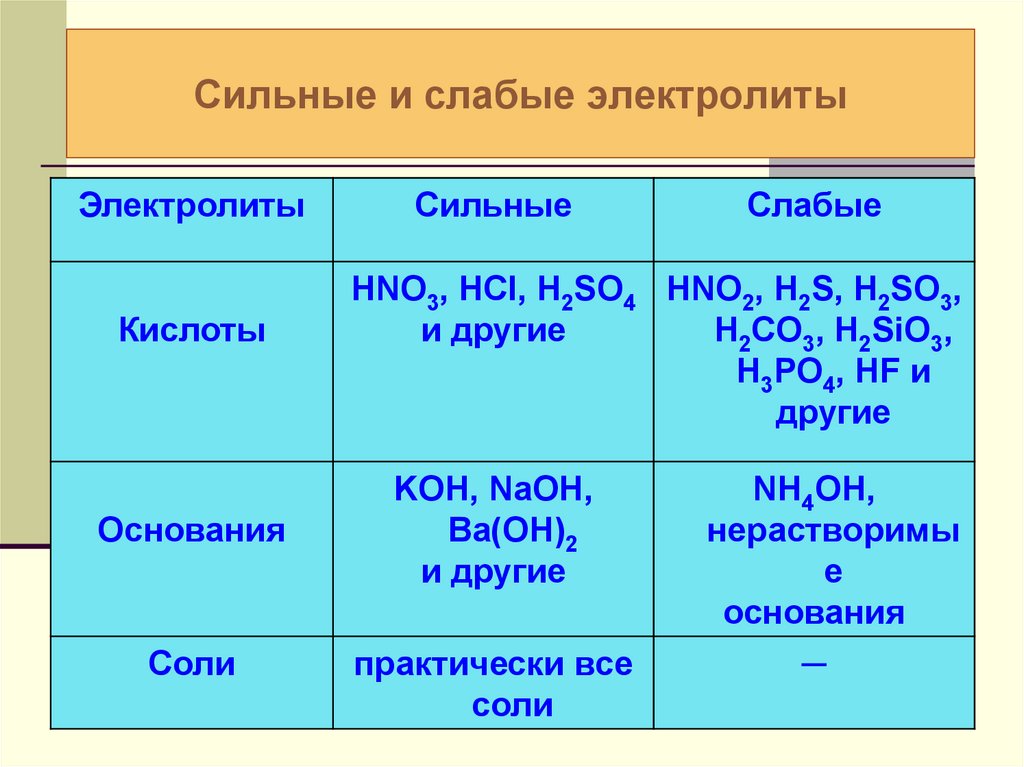
17. Сильные и слабые электролиты
ЭлектролитыКислоты
Основания
Соли
Сильные
Слабые
HNO3, HCl, H2SO4 HNO2, H2S, H2SO3,
и другие
H2CO3, H2SiO3,
H3PO4, HF и
другие
KOH, NaOH,
Ba(OH)2
и другие
практически все
соли
NH4OH,
нерастворимы
е
основания
─
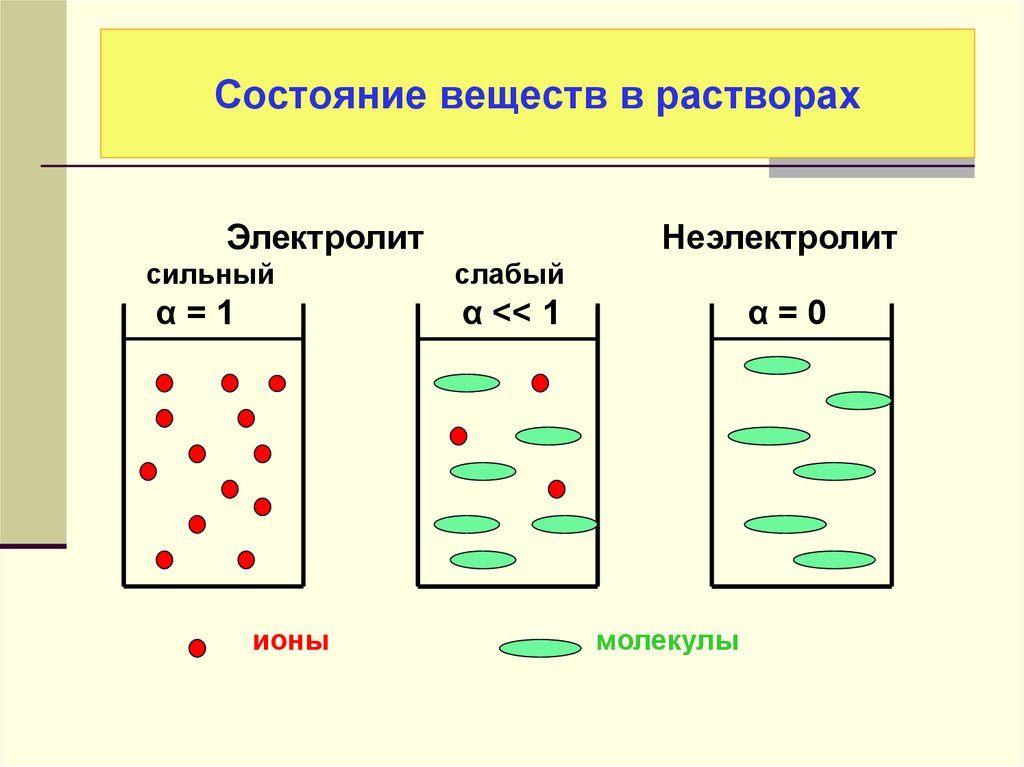
18. Состояние веществ в растворах
Электролитсильный
α=1
Неэлектролит
слабый
α << 1
ионы
α=0
молекулы
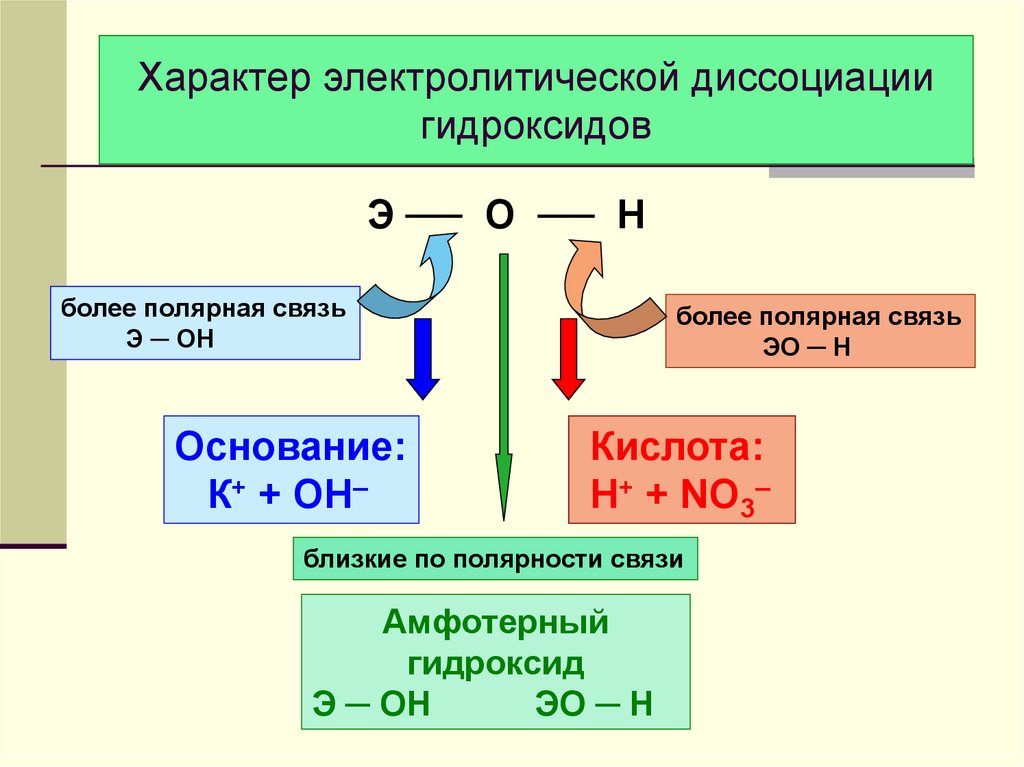
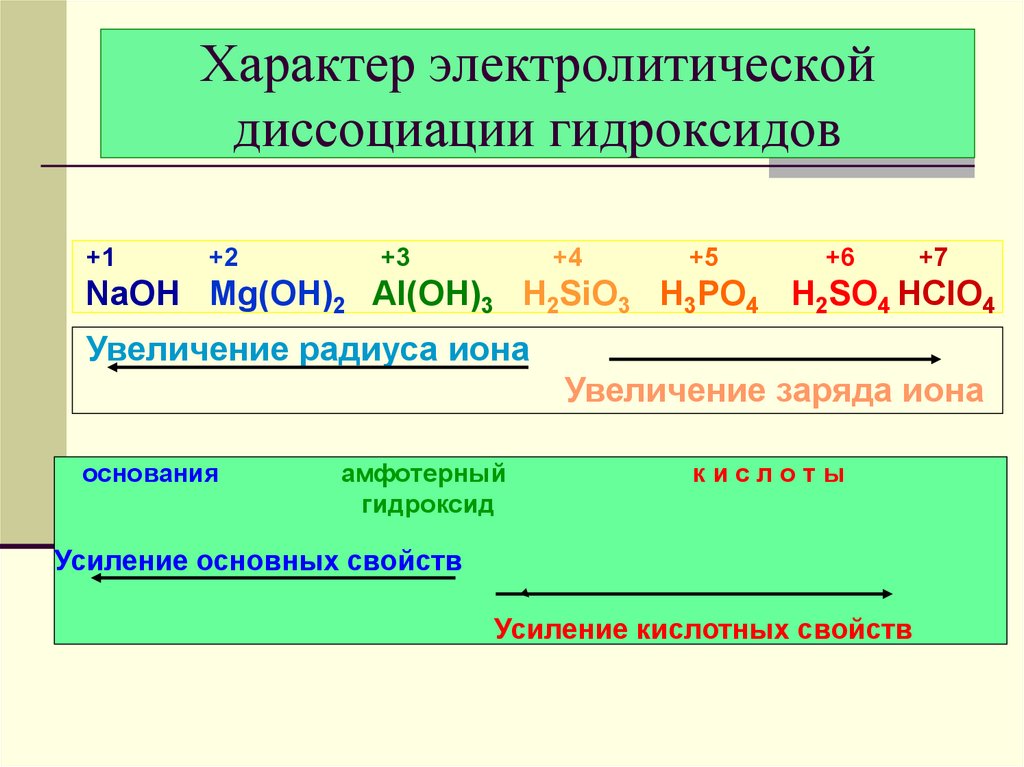
19. Характер электролитической диссоциации гидроксидов
Э ── O ── Hболее полярная связь
Э ─ OH
Основание:
К+ + ОН–
более полярная связь
ЭO ─ H
Кислота:
H+ + NO3–
близкие по полярности связи
Амфотерный
гидроксид
Э ─ ОН
ЭО ─ Н
20. Характер электролитической диссоциации гидроксидов
+1+2
+3
+4
+5
+6
+7
NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3PO4 H2SO4 HClO4
Увеличение радиуса иона
Увеличение заряда иона
основания
амфотерный
гидроксид
кислоты
Усиление основных свойств
Усиление кислотных свойств
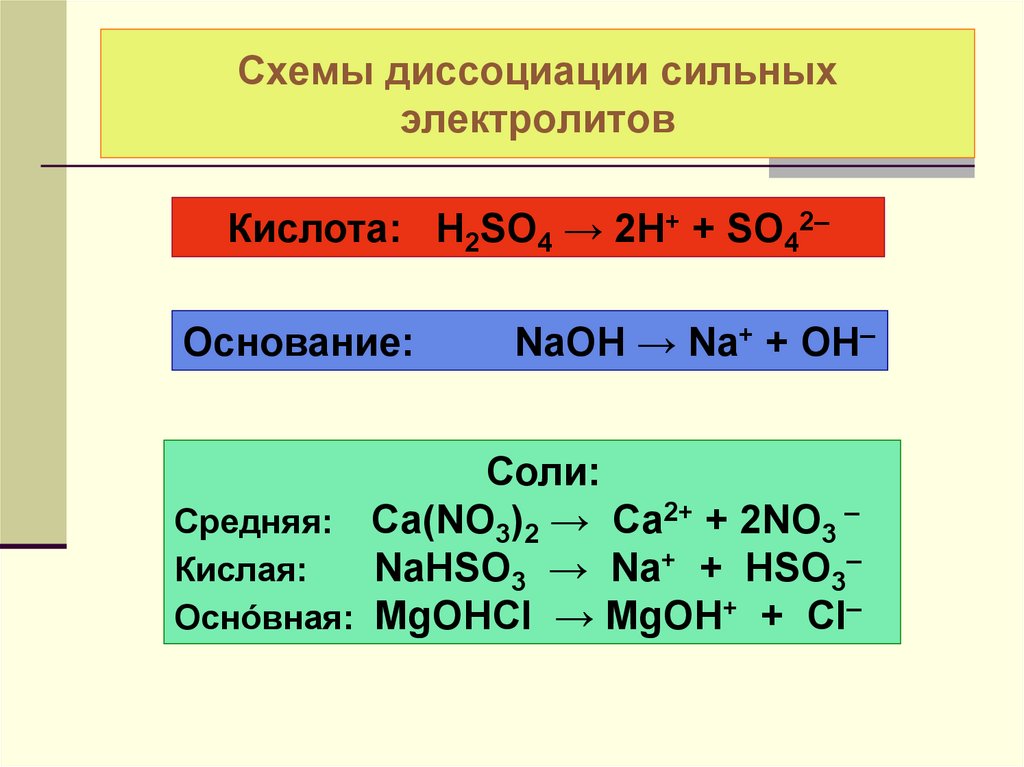
21. Схемы диссоциации сильных электролитов
Кислота: H2SO4 → 2H+ + SO42–Основание:
NaOH → Na+ + OH–
Соли:
Средняя: Са(NO3)2 → Са2+ + 2NO3 –
Кислая:
NaHSO3 → Na+ + HSO3–
Оснóвная: MgOHCl → MgOH+ + Cl–
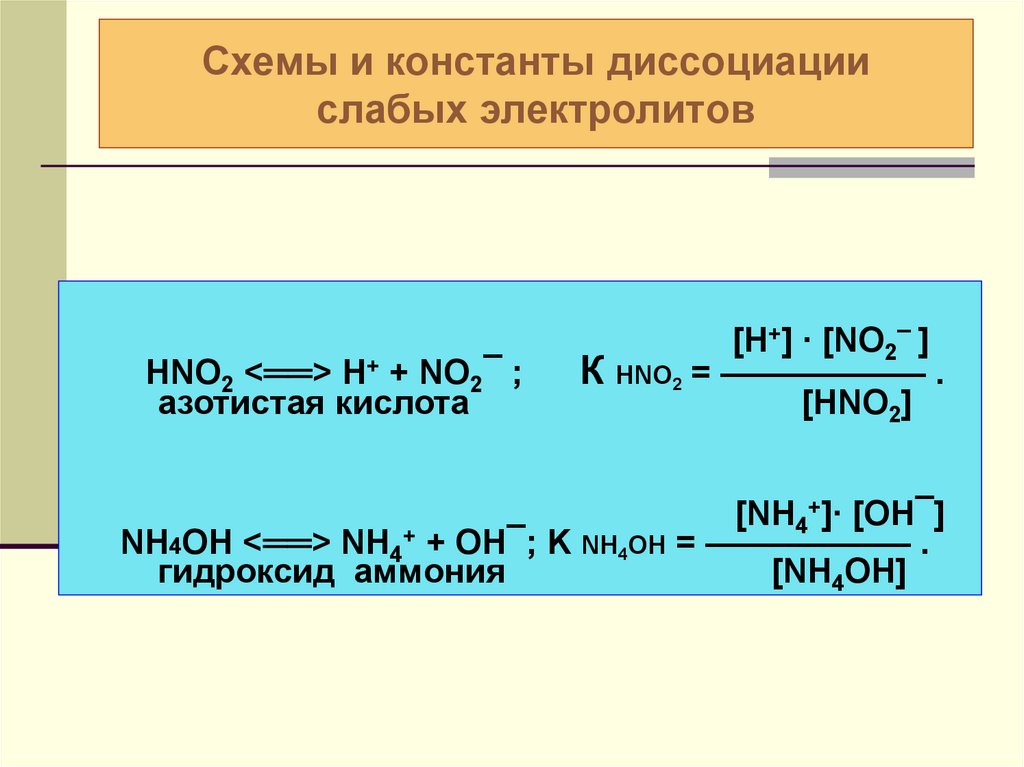
22. Схемы и константы диссоциации слабых электролитов
HNO2 <══> Н+ + NO2¯ ;азотистая кислота
[H+] ∙ [NO2¯ ]
К HNO2 = —————— .
[HNO2]
[NH4+]∙ [OH¯]
NH4OH <══> NH4+ + OH¯; K NH4OH = —————— .
гидроксид аммония
[NH4OH]
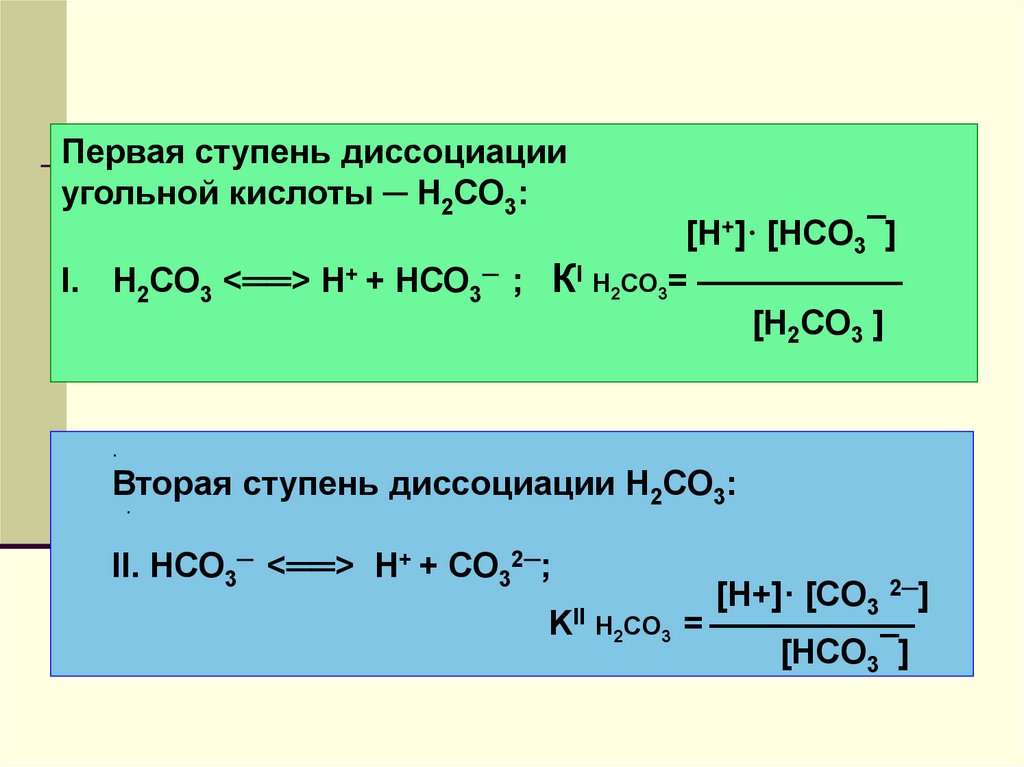
23.
Первая ступень диссоциацииугольной кислоты ─ Н2СО3:
I. Н2СО3 <══> Н+ + НСО3─
[H+]· [HCO3¯]
; КI Н2СО3= ——————
[Н2СО3 ]
.
Вторая ступень диссоциации Н2СО3:
.
II. НСО3─ <══> Н+ + СО32─;
KII Н2СО3
[H+]· [CO3 2─]
= ——————
[HCO3¯]
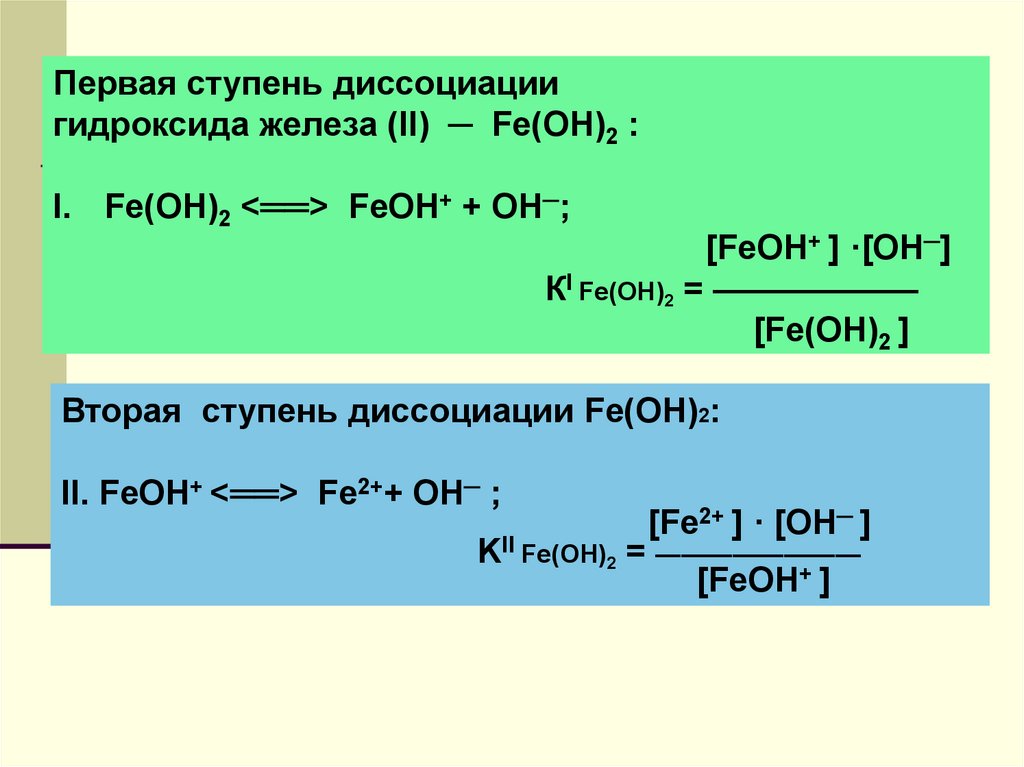
24.
Первая ступень диссоциациигидроксида железа (II) ─ Fe(OH)2 :
I. Fe(OH)2 <══> FeOH+ + ОН─;
[FeOH+ ] ·[ОН─]
КI Fe(OH)2 = ——————
[Fe(OH)2 ]
Вторая ступень диссоциации Fe(OH)2:
II. FeOH+ <══> Fe2++ ОН─ ;
[Fe2+ ] · [ОН─ ]
KII Fe(OH)2 = ————————
[FeOH+ ]
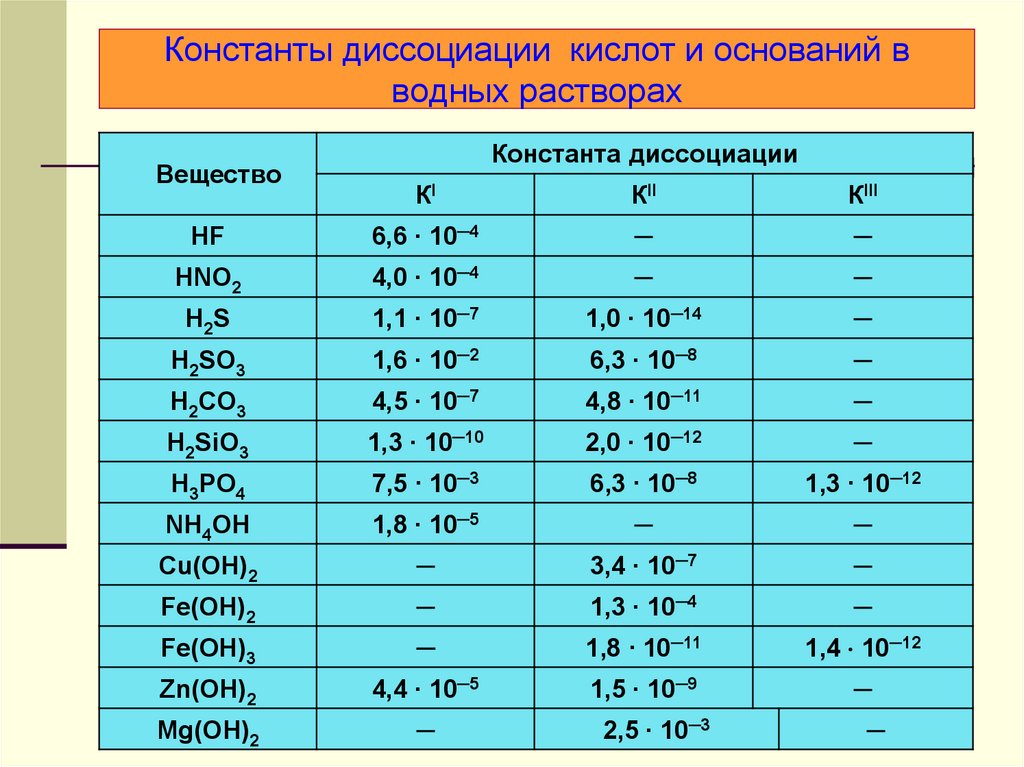
25. Константы диссоциации кислот и оснований в водных растворах
ВеществоКонстанта диссоциации
КI
КII
КIII
HF
6,6 ∙ 10─4
─
─
HNO2
4,0 ∙ 10─4
─
─
H2S
1,1 ∙ 10─7
1,0 ∙ 10─14
─
H2SO3
1,6 ∙ 10─2
6,3 ∙ 10─8
─
H2CO3
4,5 ∙ 10─7
4,8 ∙ 10─11
─
H2SiO3
1,3 ∙ 10─10
2,0 ∙ 10─12
─
H3PO4
7,5 ∙ 10─3
6,3 ∙ 10─8
1,3 ∙ 10─12
NH4OH
1,8 ∙ 10─5
─
─
Cu(OH)2
─
3,4 ∙ 10─7
─
Fe(OH)2
─
1,3 ∙ 10─4
─
Fe(OH)3
─
1,8 ∙ 10─11
1,4 10─12
Zn(OH)2
4,4 ∙ 10─5
1,5 ∙ 10─9
─
Mg(OH)2
─
2,5 ∙ 10─3
─
26. Закон разбавления Оствальда
К ≈ α 2· сα ≈ √ К/с
К – константа диссоциации;
α – степень диссоциации;
с – концентрация раствора
27. РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
ЛитератураКоровин Н.В. Общая химия. ─ М.: Высш. шк.,
2000. ─ 558 с., §§ 8.5, 8.6
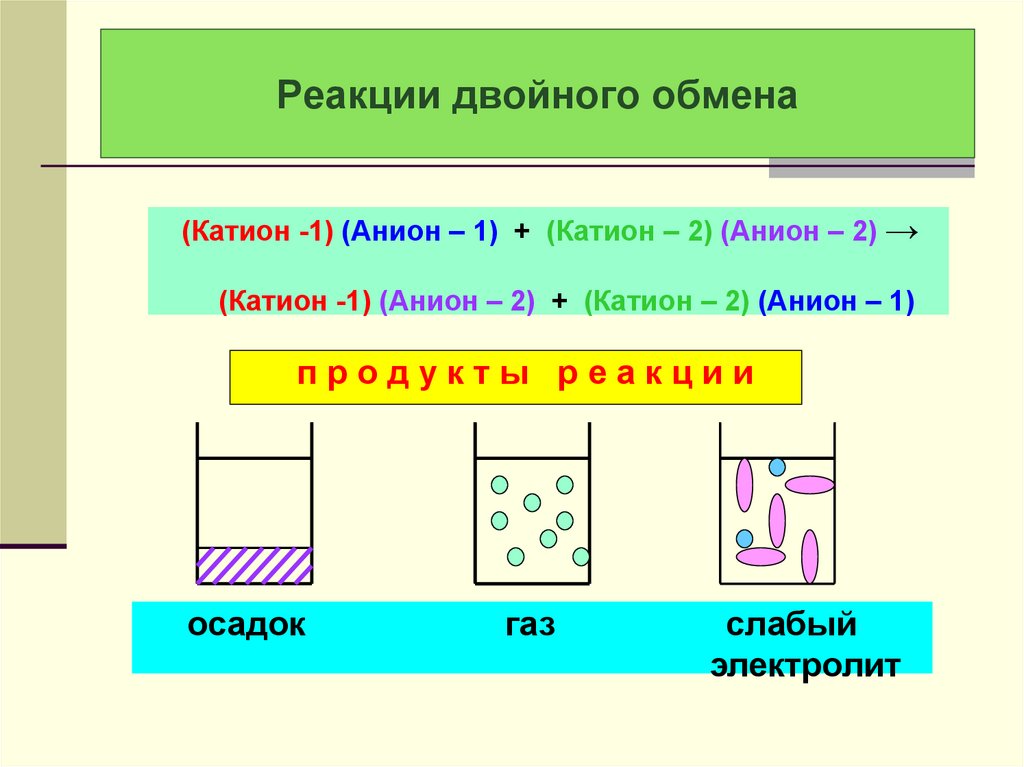
28. Реакции двойного обмена
(Катион -1) (Анион – 1) + (Катион – 2) (Анион – 2) →(Катион -1) (Анион – 2) + (Катион – 2) (Анион – 1)
продукты реакции
осадок
газ
слабый
электролит
29. Практически необратимая реакция двойного обмена с образованием осадка
CaCl2 + 2NaNO3 → Ca(NO3)2 + 2NaClР, сил
Р, сил
Р, сил
Р, сил
Ca2+ + 2Cl‾ + 2Na+ + 2NO3‾ → Ca2+ + 2NO3‾ + 2Na+ + 2Cl‾
CaCl2 + Na2SO4 → CaSO4↓ + 2NaCl
Р, сил
Р, сил
Н
Р, сил
Ca2+ + 2Cl‾ + 2Na+ + SO4 2‾ → CaSO4 ↓ + 2Na+ + 2ClCa2+ + SO42‾ → CaSO4 ↓
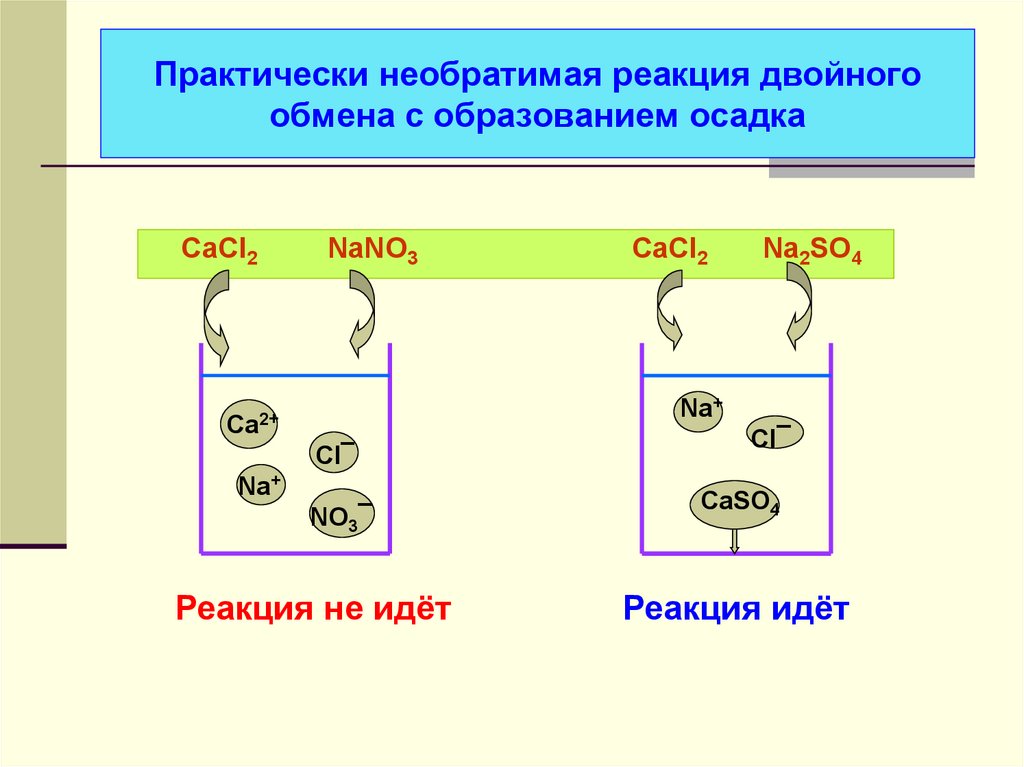
30. Практически необратимая реакция двойного обмена с образованием осадка
CaCl2NaNO3
CaCl2
Na2SO4
Na+
Ca2+
Cl¯
Na+
NO3¯
Реакция не идёт
Cl¯
CaSO4
Реакция идёт
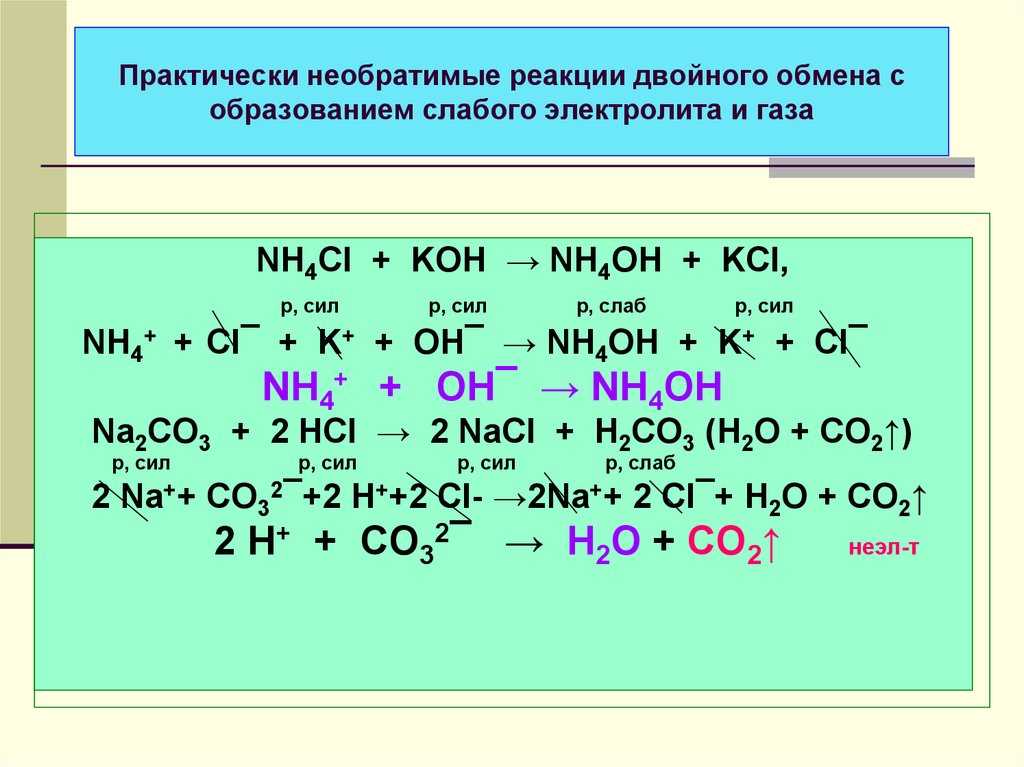
31. Практически необратимые реакции двойного обмена с образованием слабого электролита и газа
NH4Cl + KOH → NH4OH + KCl,р, сил
р, сил
р, слаб
р, сил
NH4+ + Cl¯ + K+ + OH¯ → NH4OH + K+ + Cl¯
NH4+ + OH¯ → NH4OH
Na2CO3 + 2 HCl → 2 NaCl + H2CO3 (H2O + CO2↑)
р, сил
р, сил
р, сил
р, слаб
2 Na++ CO32¯+2 H++2 Cl- →2Na++ 2 Cl¯+ H2O + CO2↑
2 H+ + CO32¯ → H2O + CO2↑
неэл-т
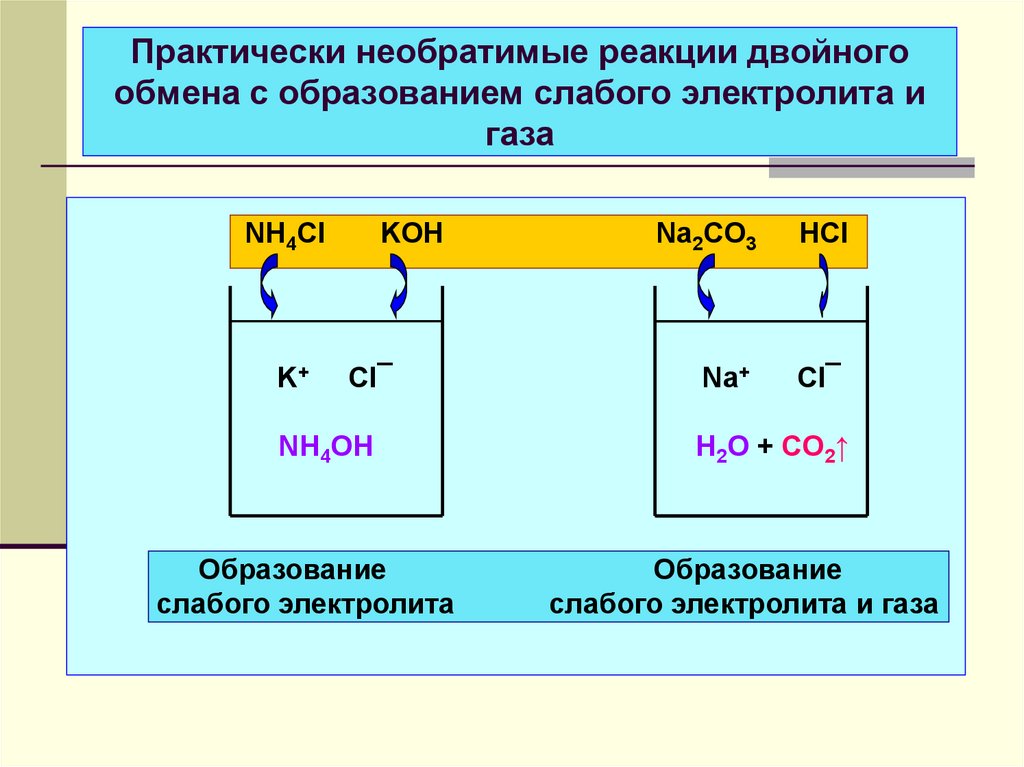
32. Практически необратимые реакции двойного обмена с образованием слабого электролита и газа
NH4ClK+
KOH
Cl¯
NH4OH
Образование
слабого электролита
Na2CO3
HCl
Na+
Cl¯
H2O + CO2↑
Образование
слабого электролита и газа
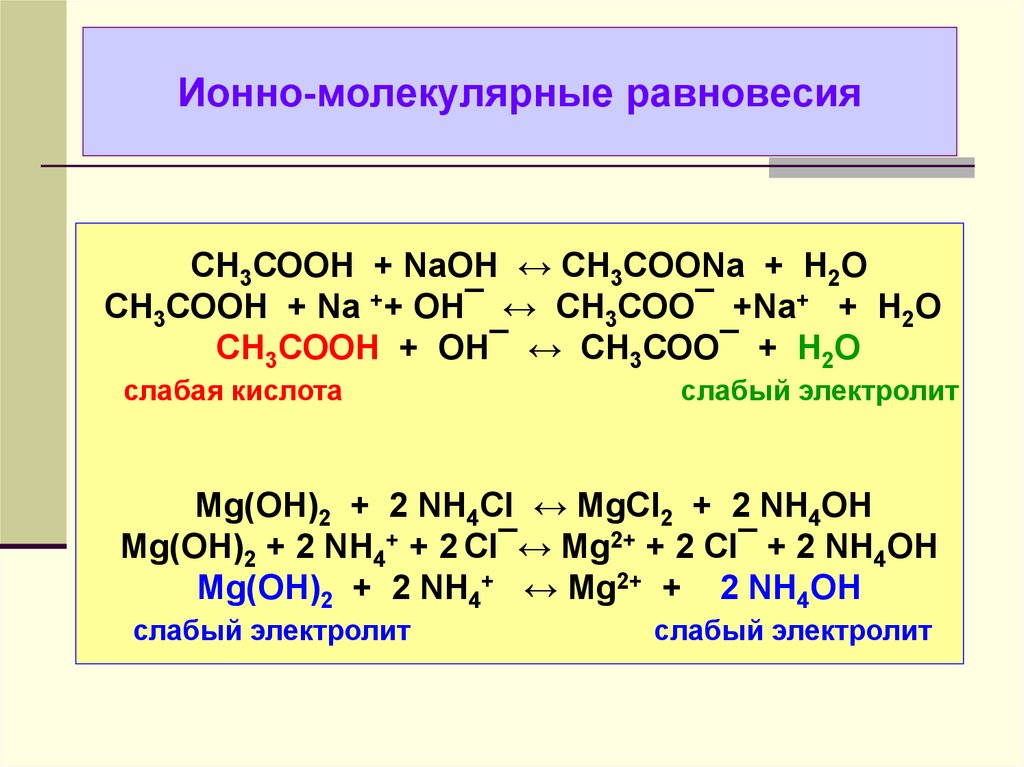
33. Ионно-молекулярные равновесия
СН3СООН + NaOH ↔ CH3COONa + H2OСН3СООН + Na ++ OH¯ ↔ СН3СОО¯ +Na+ + H2O
СН3СООН + OH¯ ↔ СН3СОО¯ + H2O
слабая кислота
слабый электролит
Mg(OH)2 + 2 NH4Cl ↔ MgCl2 + 2 NH4OH
Mg(OH)2 + 2 NH4+ + 2 Cl¯↔ Mg2+ + 2 Cl¯ + 2 NH4OH
Mg(OH)2 + 2 NH4+ ↔ Mg2+ + 2 NH4OH
слабый электролит
слабый электролит
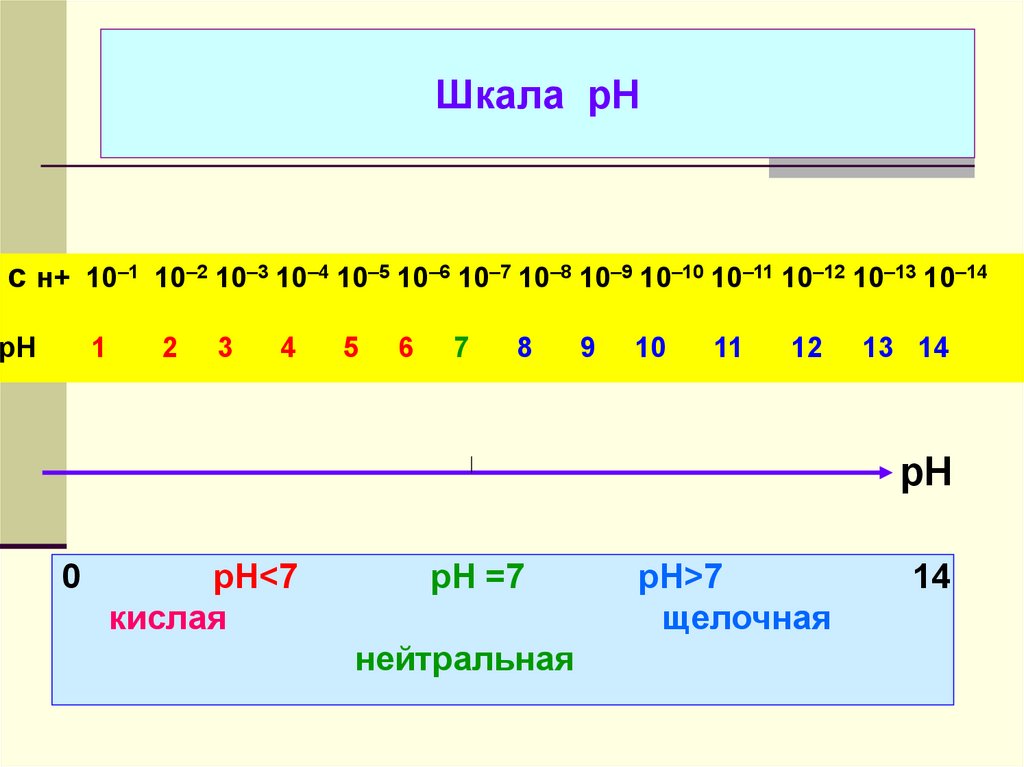
34. Шкала рН
с н+ 10–1 10–2 10–3 10–4 10–5 10–6 10–7 10–8 10–9 10–10 10–11 10–12 10–13 10–14рН
1
2
3
4
5
6
7
8
9
10
11
12
13 14
рН
0
рН<7
кислая
pH =7
нейтральная
рН>7
щелочная
14
35.
Вычислить степень диссоциации раствора уксусной кислотыс молярной концентрацией 0,1 моль/л, если водородный
показатель раствора рН = 2.
СН3СООН ↔ СН3СОО‾ + Н+
с (СН3СООН) продиссоциировавших
α = —————————————————— ;
сМ (СН3СООН)
с (Н+)
α = ——————
сМ (СН3СООН)
рН = – lg c (H+), ==>
c(H+) = 10 – pH = 10 –
α = (0,01) : (0,1) = 0,1
2
= 0, 01
36. Раствор гидроксида аммония с молярной концентрацией 0,01 моль/л имеет рН = 10. Вычислить степень диссоциации основания.
NH4OH ↔ NH4+ + OH¯с (NH4OH) продиссоциировавших
α = ————————————————
сМ (NH4OH)
с (ОН–)
α = —————— ; рН = – lg C (Н+), ==> с (Н+) = 10– 10
сМ (NH4OH)
с (Н+) · с (ОН–) = 10– 14, ==>
==> с (ОН–) = (10– 14) : (10 – 10 ) = 10 – 4 = 0,0001
α = ( 0,0001) : ( 0,01) = 0,01
37. Индикатор метиловый оранжевый
HJndкислотная форма
(красная)
↔
Jnd–
H+ +
основная форма
(жёлтая)
c к.ф.
рН = рК (Jnd) – lg —––,
с о.ф.
– ( – lg К дисс. ) индикатора;
рК (Jnd)
с к.ф. – концентрация кислотной формы;
с о.ф. – концентрация основной формы
Интервал перехода окраски: рН = (3,1 – 4,4 )
38. Состав буферных растворов и сущность буферного действия
Состав буферныхОбразование слабых
растворов
электролитов
при введении
Н+
ОН¯
СН3СООН
(СН3СОО¯+ Н+)
СН3СООNa
Ацетатный буфер рН
=5,8
NH4OH
(NH4+ + OH¯ )
NH4Cl
Аммиачный буфер
рН= 9.8
Н+ + СН3СОО¯ ↔
СН3СООН
OH¯ + H+ ↔ H2O
H+ + OH¯ ↔ H2O OH¯ + NH4+ ↔
NH4OH
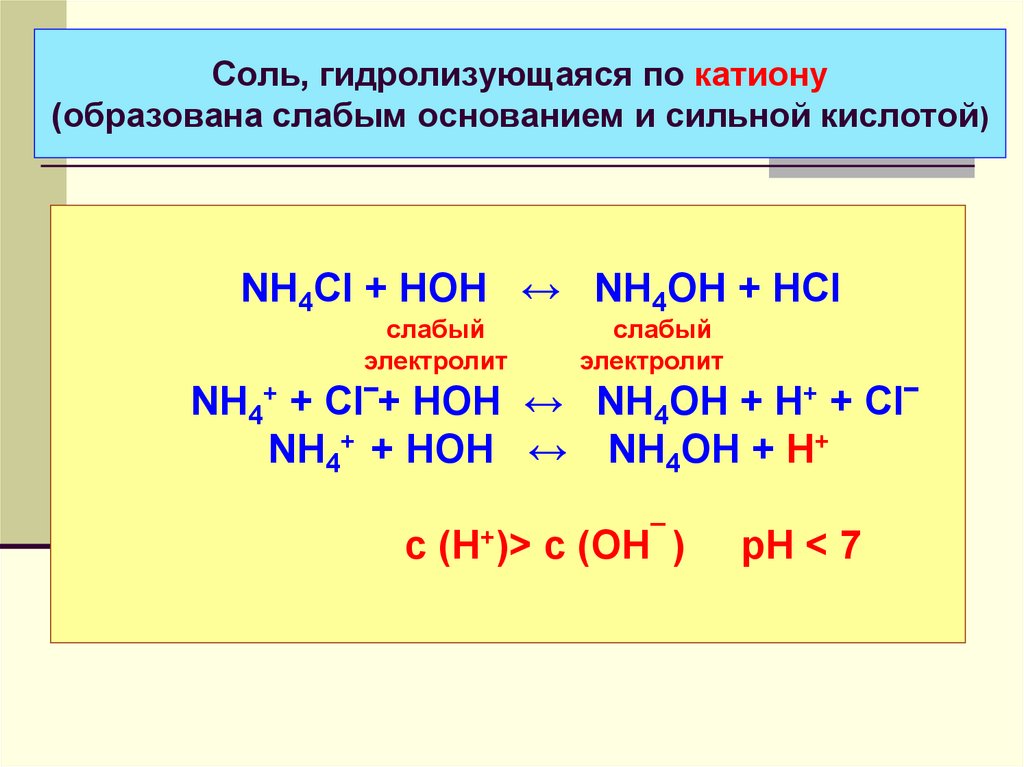
39. Соль, гидролизующаяся по катиону (образована слабым основанием и сильной кислотой)
NH4Cl + HOH ↔ NH4OH + HClслабый
электролит
слабый
электролит
NH4+ + Cl‾+ HOH ↔ NH4OH + H+ + Cl‾
NH4+ + HOH ↔ NH4OH + H+
с (Н+)> с (ОН¯ )
рН < 7
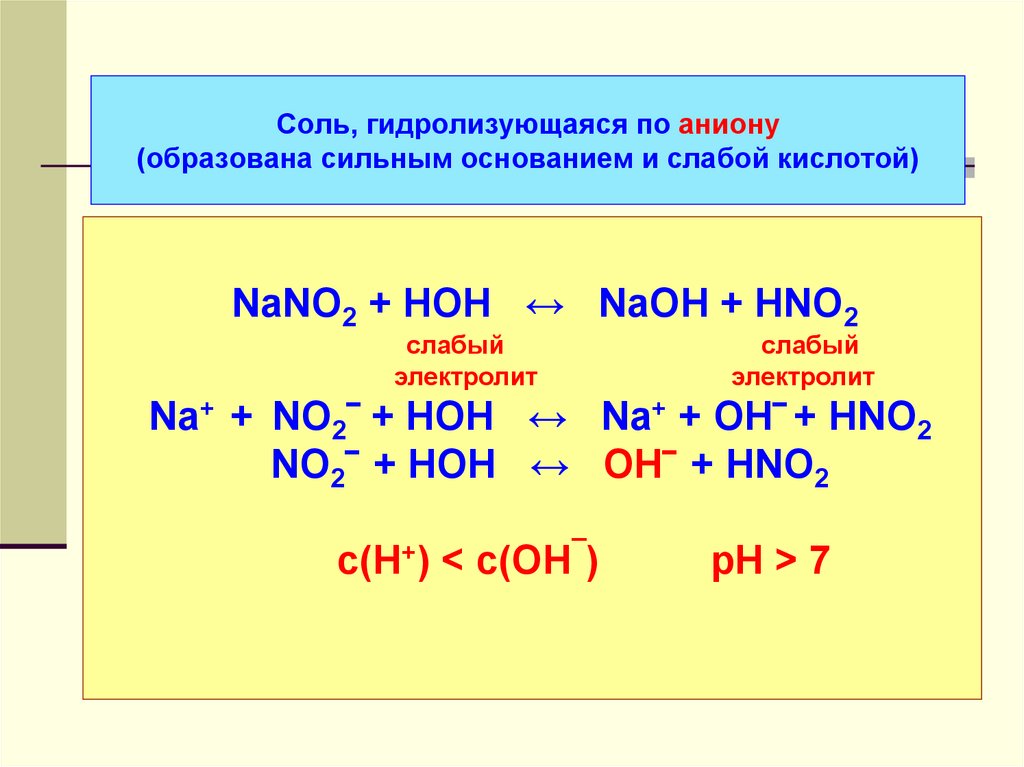
40. Соль, гидролизующаяся по аниону (образована сильным основанием и слабой кислотой)
NaNO2 + HOH ↔ NaOH + HNO2слабый
электролит
слабый
электролит
Na+ + NO2‾ + HOH ↔ Na+ + OH‾ + HNO2
NO2‾ + HOH ↔ OH‾ + HNO2
с(Н+) < с(ОН¯)
рН > 7
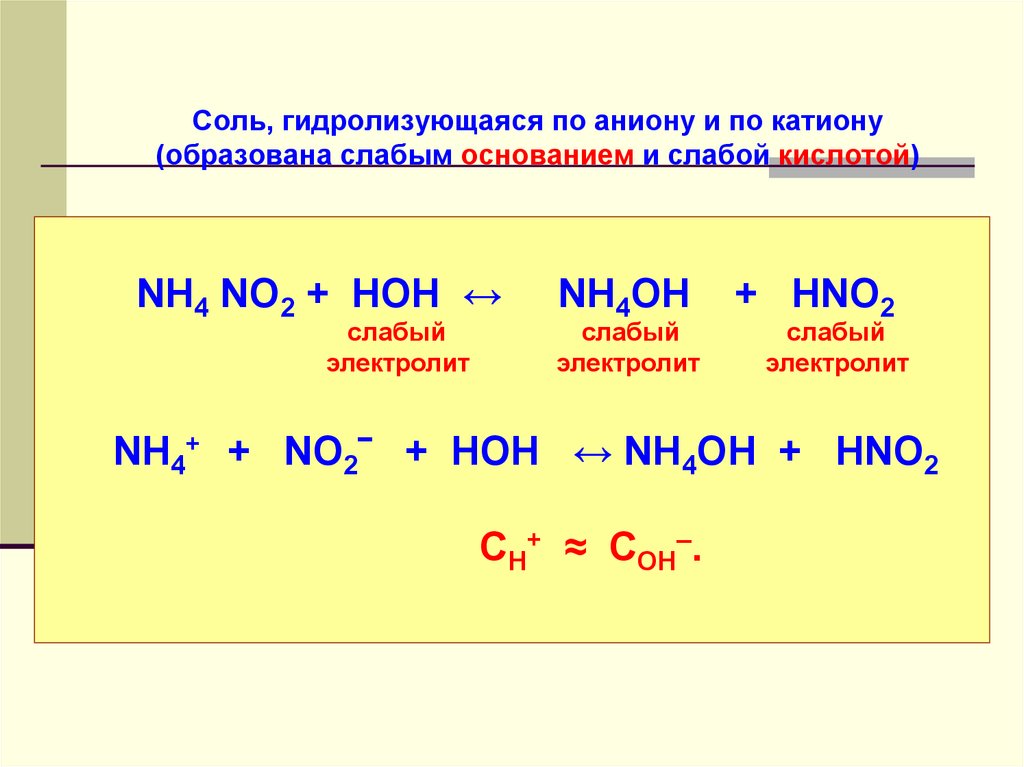
41. Соль, гидролизующаяся по аниону и по катиону (образована слабым основанием и слабой кислотой)
NH4 NO2 + НОН ↔слабый
электролит
NH4OH
слабый
электролит
+ HNO2
слабый
электролит
NH4+ + NO2‾ + НОН ↔ NH4OH + HNO2
СН+ ≈ СОН–.
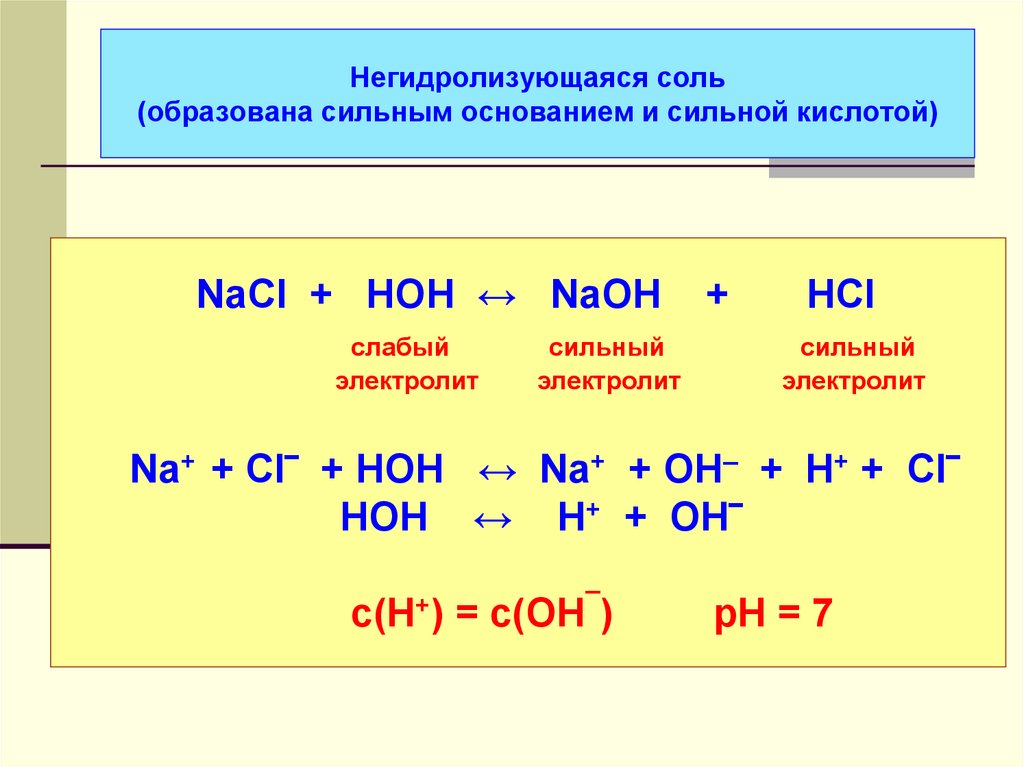
42. Негидролизующаяся соль (образована сильным основанием и сильной кислотой)
NaCl + HOH ↔ NaOHслабый
электролит
сильный
электролит
+
HCl
сильный
электролит
Na+ + Cl‾ + HOH ↔ Na+ + OH– + H+ + Cl‾
HOH ↔ H+ + OH‾
с(Н+) = с(ОН¯)
рН = 7
43. Гидролиз соли
Гидролизом называется обменноевзаимодействие ионов соли с водой,
которое сопровождается
образованием слабого электролита и
изменением рН среды
гидролиз
Соль + Вода <═══════> Основание + Кислота
реакция нейтрализации
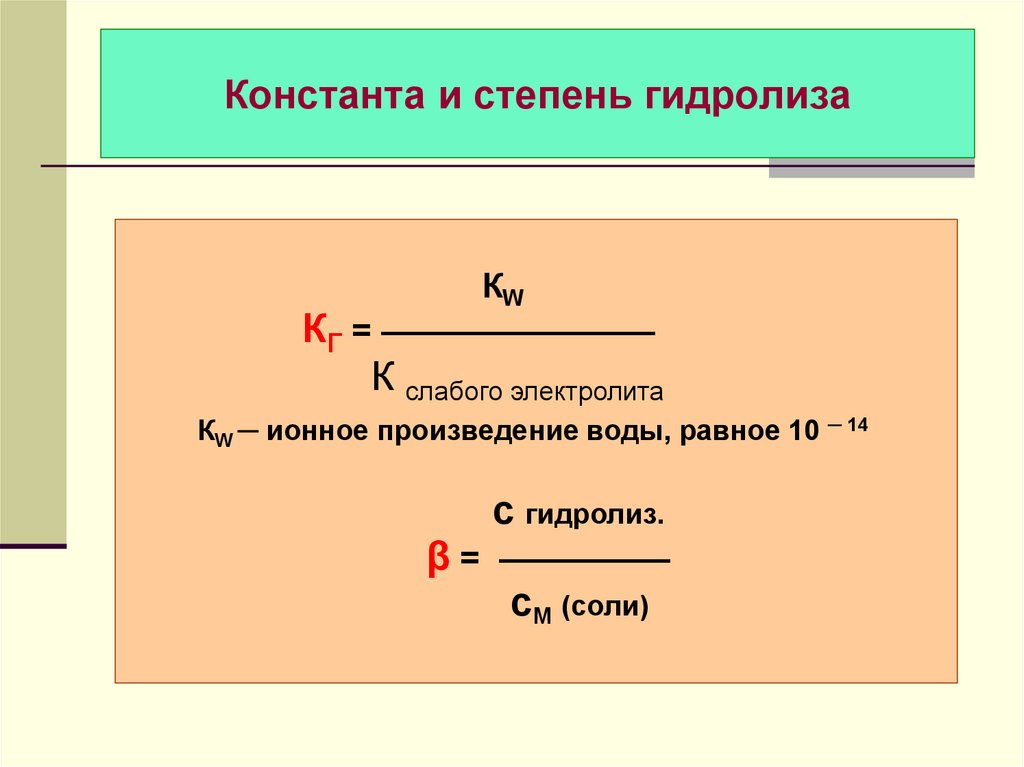
44. Константа и степень гидролиза
КWКГ = ————————
К слабого электролита
КW ─ ионное произведение воды, равное 10 ─ 14
с гидролиз.
β = —————
сМ (соли)
45. Влияние внешних факторов на полноту протекания гидролиза солей
гидролизСоль + Вода
<═══════════>
Основание + Кислота; ∆Н > 0
реакция нейтрализации
нагревание: усиление гидролиза
охлаждение: подавление гидролиза
разбавление раствора: усиление гидролиза
46. Гидролиз солей, образованных многовалентными остатками кислот и оснований
Na2SiO3 → 2Na+ + SiO32─+
HOH ↔ HSiO3─ + OH─
I ступень гидролиза:
Na2SiO3 + НОН ↔ NaHSiO3 + NaOH
2Na+ + SiO32─ + HOH ↔ Na+ + HSiO3─ + Na+ + OH─
SiO32─ + HOH ↔ HSiO3─ + OH─
NaHSiO3 → Na+ + HSiO3─
+
HOH ↔ H2SiO3 + OH─
II ступень гидролиза:
NaHSiO3 + НОН ↔ H2SiO3 + NaOH
Na+ + HSiO3─ + HOH ↔ H2SiO3 + Na+ + OH─
HSiO3─ + HOH ↔ H2SiO3 + OH─
47.
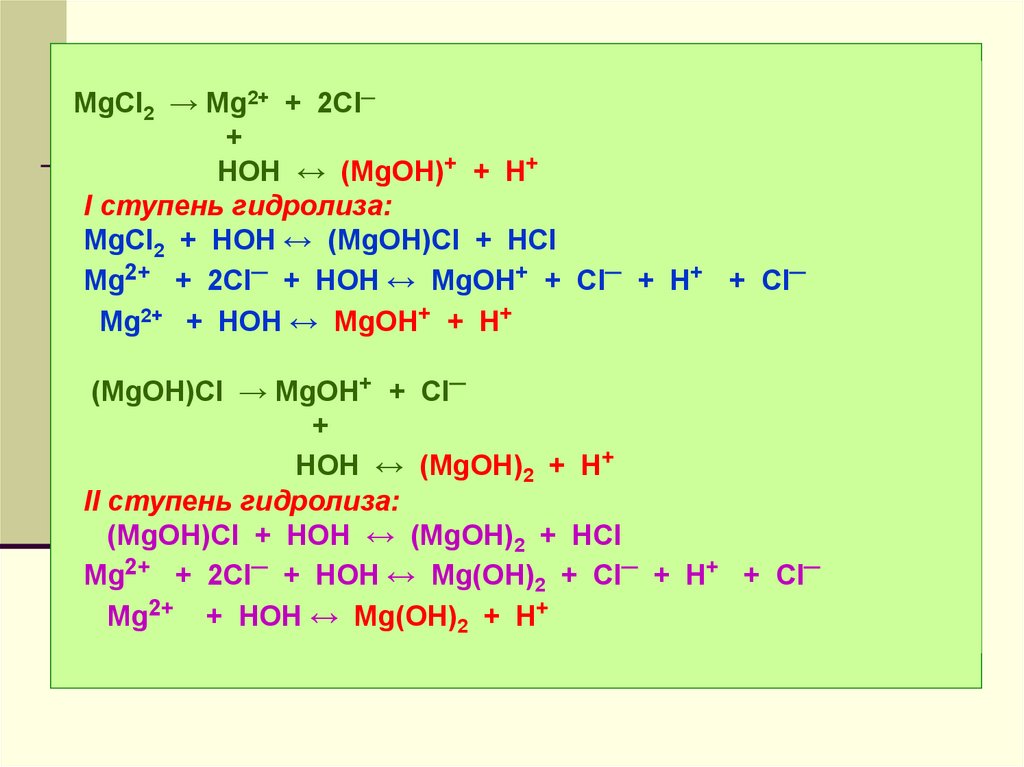
MgCl2 → Mg2+ + 2Cl─+
HOH ↔ (MgOH)+ + H+
I ступень гидролиза:
MgCl2 + HOH ↔ (MgOH)Cl + HCl
Mg2+ + 2Cl─ + HOH ↔ MgOH+ + Cl─ + H+ + Cl─
Mg2+ + HOH ↔ MgOH+ + H+
(MgOH)Cl → MgOH+ + Cl─
+
HOH ↔ (MgOH)2 + H+
II ступень гидролиза:
(MgOH)Cl + HOH ↔ (MgOH)2 + HCl
Mg2+ + 2Cl─ + HOH ↔ Mg(OH)2 + Cl─ + H+ + Cl─
Mg2+ + HOH ↔ Mg(OH)2 + H+

















 Химия
Химия








