Похожие презентации:
Взаимное влияние атомов в молекулах. Шкалы электроотрицательности
1.
Теоретические основы органическойхимии
Взаимное влияние атомов в молекулах.
Шкалы электроотрицательности.
Уравнение Тафта.
2.
1Представления о взаимном влиянии
атомов в молекулах
СH3COOH
рKa
СF3COOH
4.7
0.7
O
Me
Me
OH
OH
Me
рKa
Me
Me
~ 15
рKa
Me
~5
3.
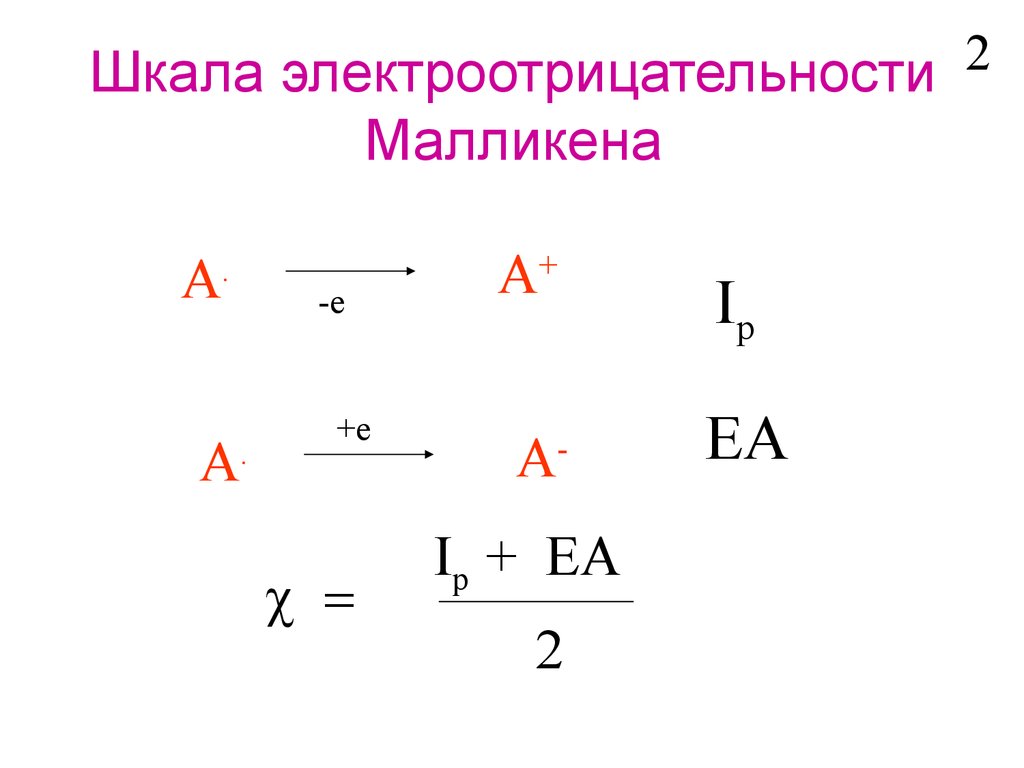
2Шкала электроотрицательности
Малликена
A
.
-e
A
.
+e
A+
Ip
A-
EA
Ip + EA
2
4.
Шкала электроотрицательности 3Полинга
A-B
A - B+
A + B-
Ковалентная связь:
EA-B = (EA-A + EB-B)/2
Ионная связь:
EA-B - (EA-A + EB-B)/2
A - B = f ( )
A - B =
23.05
F = 4.0
5.
Шкала ПолингаH
2.1
Li
Be
B
C
N
O
F
1.0
1.5
2.0
2.5
Si
1.8
Ge
1.8
Sn
1.8
3.0
P
2.1
As
2.0
Sb
1.9
3.5
S
2.5
Se
2.4
Te
2.1
4.0
Cl
3.0
Br
2.8
I
2.5
C
sp3
2.5
sp2
2.8
sp
3.1
4
6.
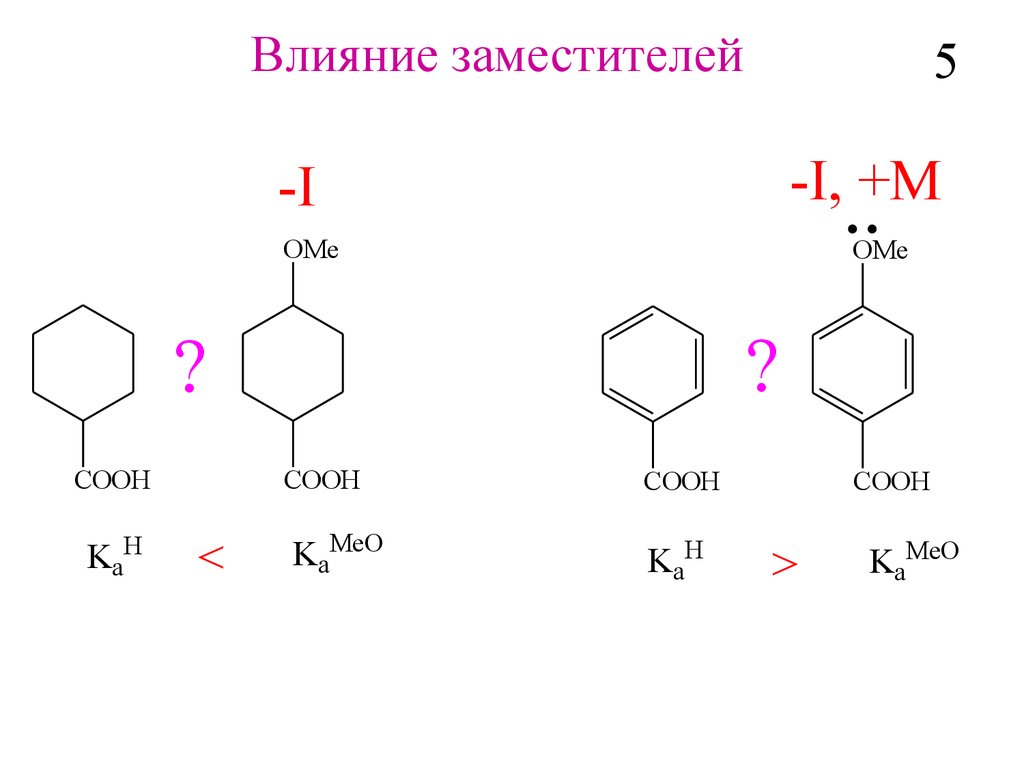
Влияние заместителей5
-I, +M
-I
OMe
OMe
?
?
COOH
KaH
COOH
<
KaMeO
COOH
KaH
COOH
>
KaMeO
7.
Влияние заместителей по -связям6
H – CH2 –CH2- CH2 -Y
+
+
+
+
F CH2 CH2 CH2 Y
Индуктивный эффект –последовательное
распространение и постепенное затухание
поляризации -связи (I
8.
Качественная оценка индуктивногоэффекта
C+
X-
-I-эффект
H стандарт
+
X
C
+I-эффект
-
CH3
CH2CH3
CH
CH3
CH3
CH3
CH3
C
CH3
+I
CR3 NR2
-I
OR
F
OR F
SR Cl
SeR Br
I
-I
7
9.
Количественная оценка индуктивноговлияния (Тафт, 1952-1954 гг.)
Щелочной гидролиз:
O
-
HO +
C
OMe
O-
lim
HO
R
O
OMe
R
H2O 25oC
R
Me
Kотн.
C
4.5x10-3 1
H
8
C
OH + MeO-
R
CH2Cl
CHCl2
COOMe
3.4
72
760
-I- эффект
10.
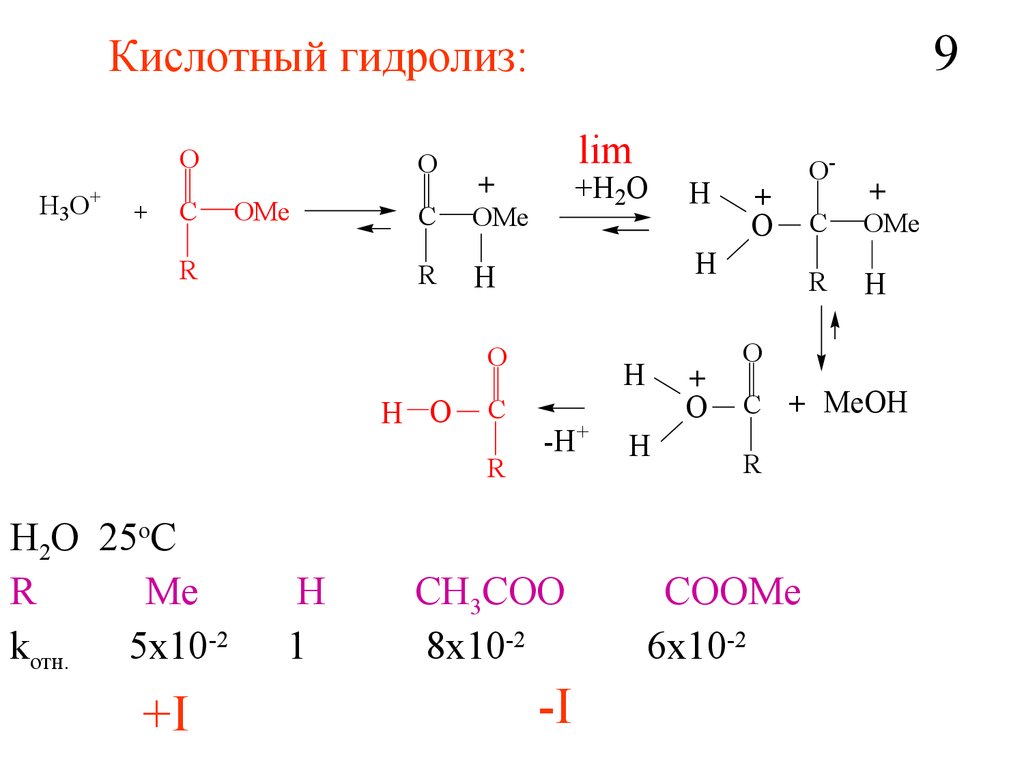
9Кислотный гидролиз:
O
H 3O +
+
C
O
OMe
R
lim
+
C
OMe
R
H
+H2O
C
R
H2O 25oC
R
Me
kотн. 5x10-2
+I
H
1
+
O
H
O
H O
H
H
-H+
CH3COO
8x10-2
-I
+
O
H
O-
+
C
OMe
R
H
O
C + MeOH
R
COOMe
6x10-2
11.
kOH = f (IR, SR)kH+ = f (SR)
10
O
HO-
C
H
OMe
H
R
щелочной
гидролиз
(lg
kR
kMe
)щел. гидр.
+
O
O-
+
C
OMe
R
H
кислотный
гидролиз
(lg
kR
1
)
kMe кисл. гидр. 2.48
R)
индукционная константа заместителей
Тафта (универсальная величина)
12.
+IR
Me
0.0
1
Et
-0.100
t-Bu -0.300
-0.475
SiMe3 -0.72
11
-I
R
Me
10.0
H
0.49
MeO 1.45
OH
1.55
I
2.4
Br
2.8
Cl
2.9
F
3.1
NO2 3.9
N+Me3 5.3
13.
Закон затухания12
CH2)nR = R n, где здесь ~0.36
(MeSO2) = 3.7
(MeSO2CH2) = 1.32
(NO2CH2CH2) = 0.5
Закон аддитивности
XYZC) = XCH2) + *(YCH2) + *(ZCH2)
Me3C) = 3. *(MeCH2) = 3.(-0.1) = -0.3
14.
Уравнение Тафта13
kR
lg
=
kMe
константа чувствительности реакции
определяет силу эффекта индуктивного влияния
заместителя, для р-ции щел.гидролиза метилацетата =1)
f (тип реакции, условия - to, растворитель и т.п.)
(с ростом температуры падает)
!!! Уравнение Тафта применимо к алифатическим
и алициклическим соединениям, где у реакционного
центра проявляется только индуктивное влияние заместителя
15.
R-CH2-SH + H2O = RCH2S + H3O-
lg(KR/KMe)
+
14
aкцепторы
смещают
равновесие
вправо
tg = = 1.2
Положительное значение ρ свидетельствует о том, что в переходном состоянии на
реакционном центре возникает частичный отрицательный заряд, а при переходе
от электронодонорных заместителей к электроноакцепторным реакционная
способность соединения в данной реакции увеличивается.
При отрицательной величине ρ наблюдается обратная зависимость.
16.
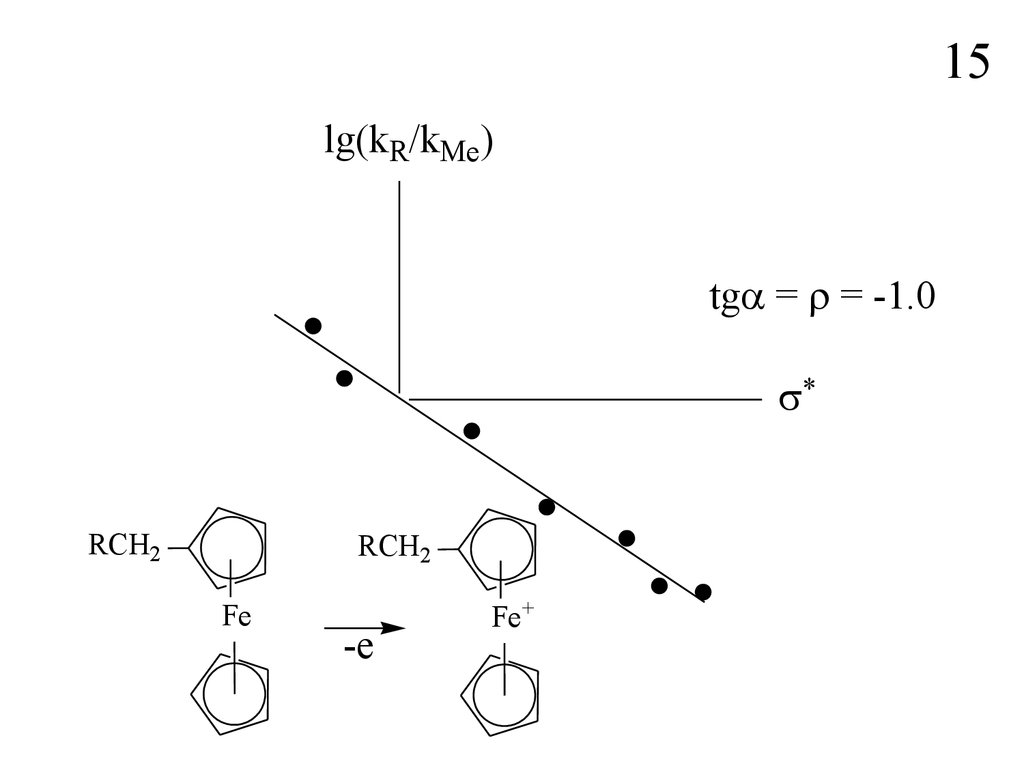
15lg(kR/kMe)
tg = = -1.0
RCH2
RCH2
Fe
-e
Fe+
17. Задание:
ЗАДАНИЕ:1. Константа диссоциации бицикло[2.2.2]октан-1-карбоновой
кислоты (X=Н) равна 1.80•10-7. Как будет меняться сила
кислоты при введении таких заместителей: Х=CN, СООС2Н5,
Вг, ОН? Расположите эти кислоты в порядке увеличения
констант диссоциации.
2. Константа диссоциации уксусной кислоты 1,74 .10-5. Как на
основании уравнения Тафта предсказать константы
диссоциации монохлоруксусной, дихлоруксусной и
трихлоруксусной кислот? Как на основании известных
констант найти константу заместителя Сl?
16













 Химия
Химия








