Похожие презентации:
Уравнение состояния идеального газа
1.
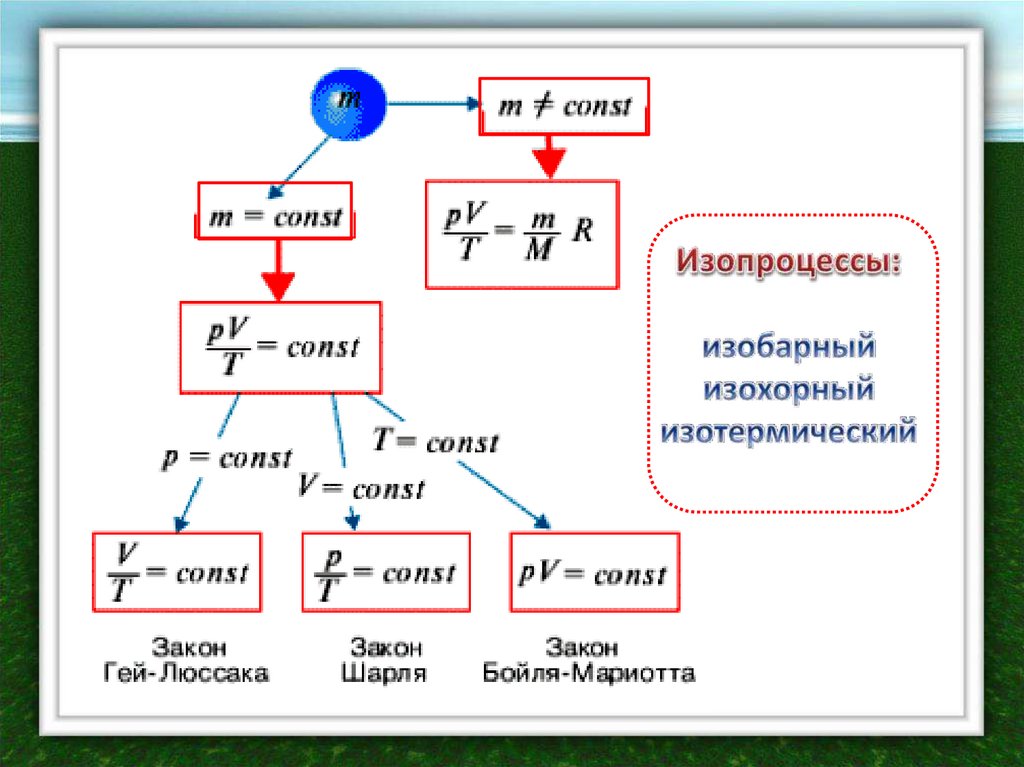
Уравнение состояния идеального газа является однимиз важнейших термодинамических соотношений. Оно
связывает механические понятия давления и объема с
термодинамическим понятием температуры. В
самом деле, уравнение состояния можно
рассматривать как фундаментальное физическое
определение температуры
Дж. Б. Мэрион
2.
Дано:p nkT
m-!
M-!
p-!
V-!
T-!
n
p
N
V
N
kT
V
m
N
NA
M
mTkN A
p
VM
k NA R
Дж
R 8,31
К моль
m
pV
RT
M
3.
ДжR 8,31
К моль
R – молярная газовая постоянная
(универсальная газовая постоянная)
m
pV
RT
M
Менделеев
Дмитрий Иванович
Русский химик
Клапейрон
Бенуа Поль Эмиль
Французский физик
и инженер.
Жил в России 11 лет
Уравнение состояния идеального газа вывел Д.И.
Менделеев в 1874 г., исходя из полученного на сорок лет
раньше Б. Клапейроном объединенного газового закона
4.
Если масса идеального газа постоянна, топрименительно к двум состояниям можно записать
уравнения состояния
p1V1
m
R
T1
M
p2V2
m
R
T2
M
p1V1 p2V2
T1
T2
pV
const
T
Отношение произведения давления данной массы
идеального газа на его объем к абсолютной температуре
есть величина постоянная
5.
Изопроцесс (от греч. «изос» - равный) – физическая модель реального процесса6.
7.
Закон открыт в середине XVII векаРобертом Бойлем(англ. физик) и
Эдмом Мариоттом (франц. физик)
При постоянной
температуре
произведение давления
данной
массы идеального газа и
его объема
есть величина постоянная
При T=const
pV const
p1V1 p2V2
p1 V2
p2 V1
При сжатии газа увеличивается
концентрация и плотность газа,
вследствие чего возрастает число
ударов молекул газа о стенки сосуда,
а следовательно увеличивается
давление
8.
9.
T1 T2Реальный процесс в
реальном газе можно
считать изотермическим,
если он протекает очень
медленно, столь
медленно,
что изменением
температуры газа за
некоторый малый
промежуток времени
можно пренебречь
10.
Закон открыт в начале XVIII векаэкспериментально французским ученым
Гей-Люссаком
При постоянном
давлении
объем данной
массы идеального газа
прямо пропорционален
его абсолютной
температуре
При р=const
V1 T1
V2 T2
V
const
T
При изобарном росте температуры
увеличивается средняя кинетическая
энергия молекул газа и их средняя
скорость, что связано с увеличением
длины свободного пробега молекул.
Поэтому изобарное изменение
объема изменяется соответственно
изменению температуры
11.
12.
p2 p1Поскольку абсолютный нуль
недостижим и, кроме того давление
и объем газа не могут быть равны
нулю при их приближении к началу
или осям координат график
изображается штриховой линией
13.
Если вместо абсолютнойтемпературы Т ввести в
закон температуру ,
измеренную по шкале
Цельсия, то закон примет
вид:
V0 – объем газа
при
температуре 0 0С
V V0 (1 t )
o
1
1
К
273
Температурный коэффициент объемного
расширения идеального газа показывает,
что при изобарном нагревании на 1 градус
объем данной массы идеального газа
увеличивается на 1/273 часть того объема,
который занимал газ при 0 0С
14.
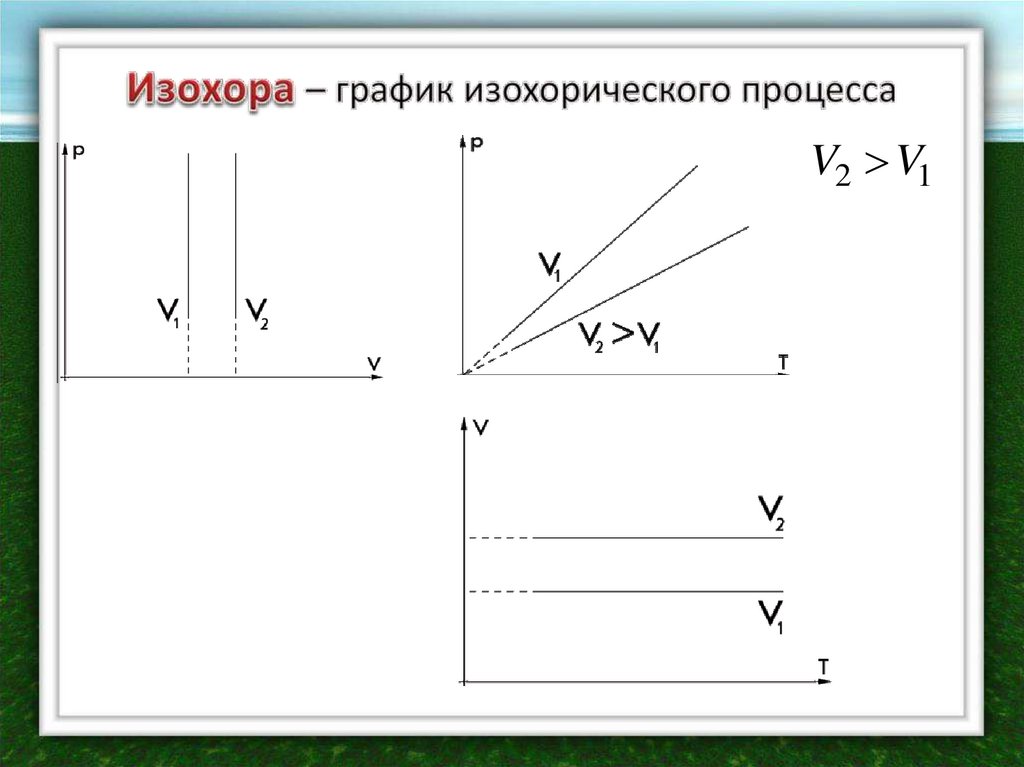
При V=constЗакон открыт в середине XVII века
французским ученым Шарлем
экспериментально
При постоянном объеме
давление данной
массы идеального газа
прямо пропорционально
его абсолютной
температуре
p1 T1
p2 T2
p
const
T
Если увеличить температуру газа,
не давая ему расширяться, то с
ростом средней кинетической
энергии его молекул будут
усиливаться их удары о стенки
сосуда, т.е. будет увеличиваться
давление газа
15.
16.
V2 V117.
Если вместо абсолютнойтемпературы Т ввести в
закон температуру ,
измеренную по шкале
Цельсия, то закон примет
вид:
р0 – объем газа
при
температуре 0 0С
p p0 (1 t )
o
1
1
К
273
Температурный коэффициент давления
идеального газа показывает,
что при нагревании на 1 градус
давление идеального газа
увеличивается на 1/273 часть того
давления, которое этот газ оказывал при 0 0С













 Физика
Физика








