Похожие презентации:
Термодинамика. ЕГЭ по физике
1.
2.
3.
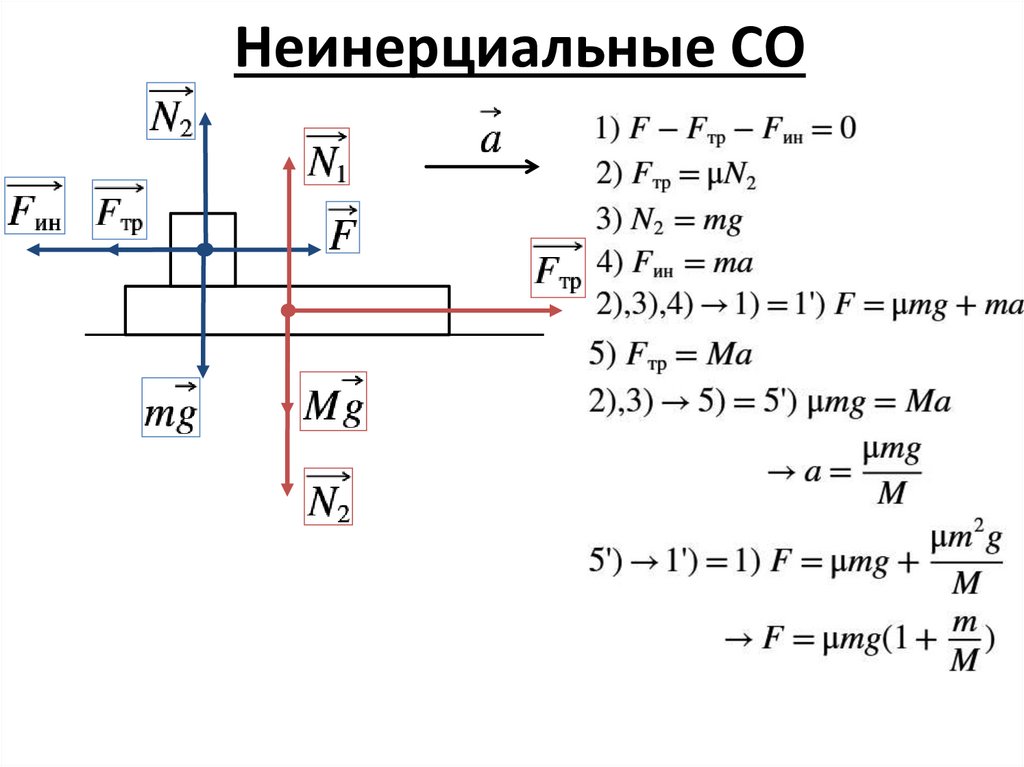
Неинерциальные СО4.
Неинерциальные СО5.
Неинерциальные СО6.
Неинерциальные СО7.
Неинерциальные СО8.
Неинерциальные СО9.
α10.
α11.
Hα
12.
Hα
13.
Hα
14.
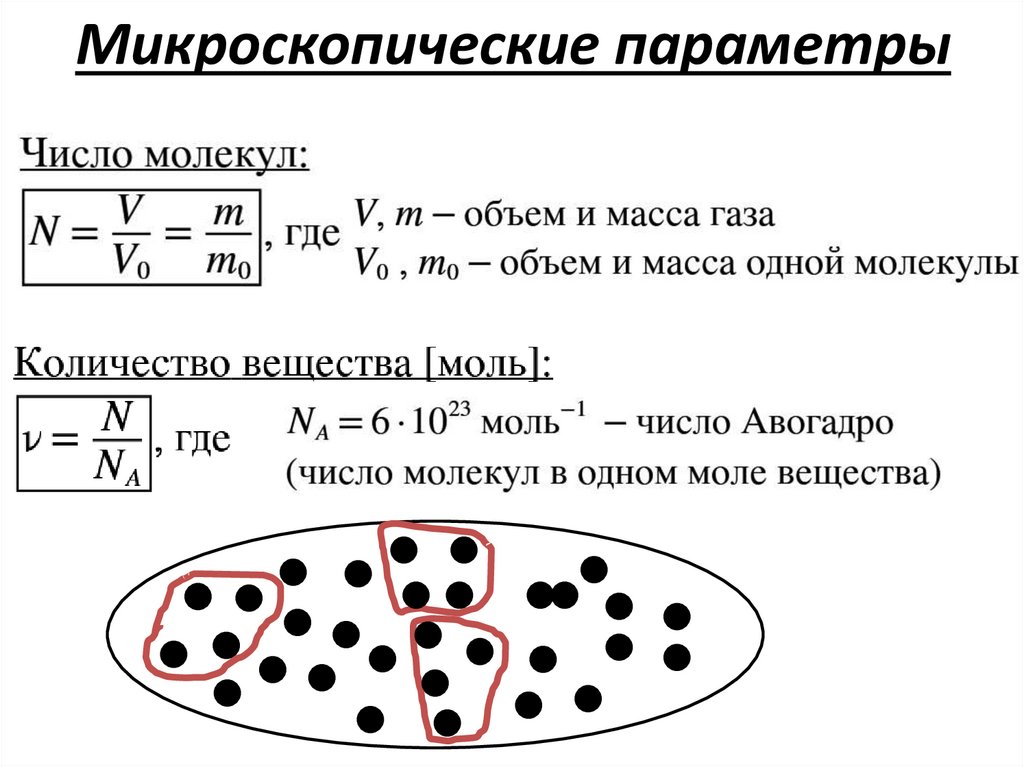
Основные положения МКТПараметры системы
Микроскопические
(отдельные
элементы системы)
Макроскопические
(система как
целое)
Идеальный газ - это физическая модель газа, взаимодействие между
молекулами которого пренебрежительно мало.
• взаимодействие между молекулами пренебрежительно мало
• расстояние между молекулами много больше размеров молекул
• молекулы - это упругие шары
• отталкивание молекул возможно только при соударении
• движение молекул - по законам Ньютона
• давление газа на стенки сосуда - за счет ударов молекул
15.
Микроскопические параметры16.
Микроскопические параметры17.
18.
19.
Связь микро- и макропараметров20.
Макроскопические параметры21.
22.
Закон ДальтонаДавление смеси химически невзаимодействующих элементов
равно сумме парциальных давлений
Парциальное давление-давление, которое создавал бы один
газ, если бы занимал весь объем смеси при той же
температуре
23.
24.
25.
26.
27.
Фазовые превращения.Удельная темплоемкость вещества c – количество теплоты,
которое надо сообщить телу массой 1 кг, чтобы изменить его
температуру на 1 градус
Теплоемкость вещества С – произведение массы тела на
удельную теплоемкость вещества, из которого оно
изготовлено.
Количество теплоты, отданное источником:
28.
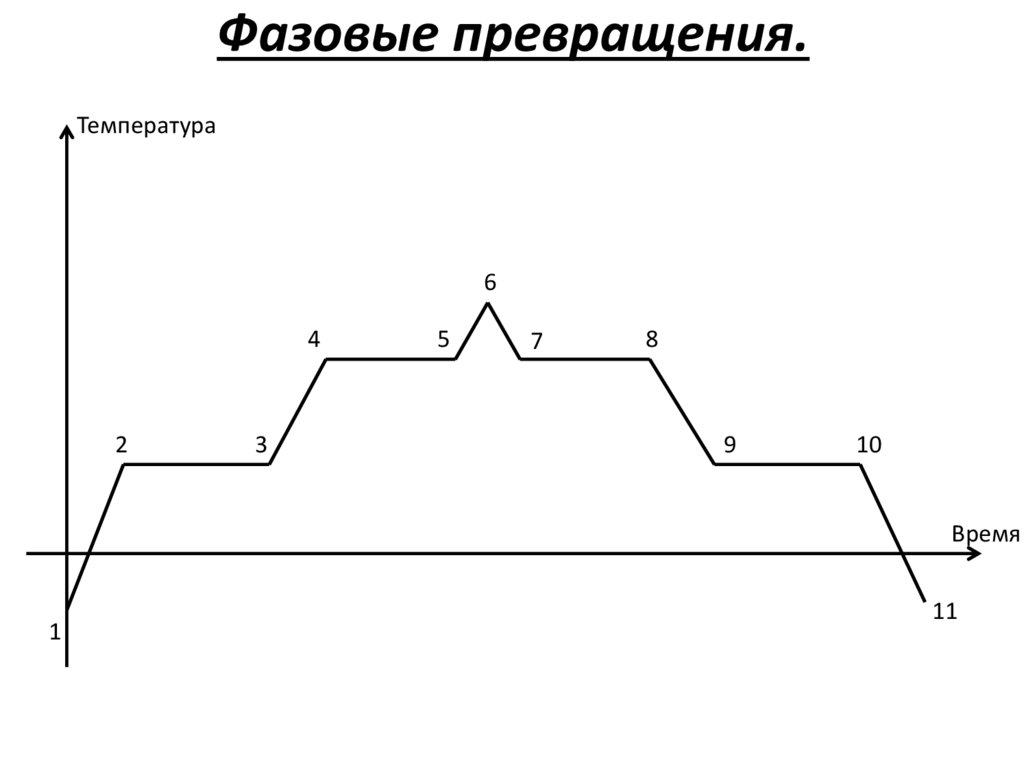
Фазовые превращения.Температура
6
4
2
3
5
7
8
9
10
Время
1
11
29.
Фазовые превращения.2-3 (9-10) – плавление
(кристаллизация)
4-5 (7-8) – парообразование
(конденсация)
30.
Фазовые превращения.Количество теплоты, выделяющееся при сгорании топлива :
31.
Фазовые превращения.Уравнение теплового баланса:
В замкнутой системе тел алгебраическая сумма количеств
теплоты, отданных и полученных всеми телами, участвующими
в теплообмене, равна нулю
32.
Фазовые превращения.33.
Фазовые превращения.34.
Фазовые превращения.35.
Термодинамика.Внутренняя энергия идеального одноатомного газа:
Изменение внутренней энергии :
36.
Термодинамика.*Если газ не одноатомный:
37.
Термодинамика.Работа идеального газа:
1. В общем случае: площадь фигуры под графиком в
координатах p-V
2. При изобарном процессе (p=const):
38.
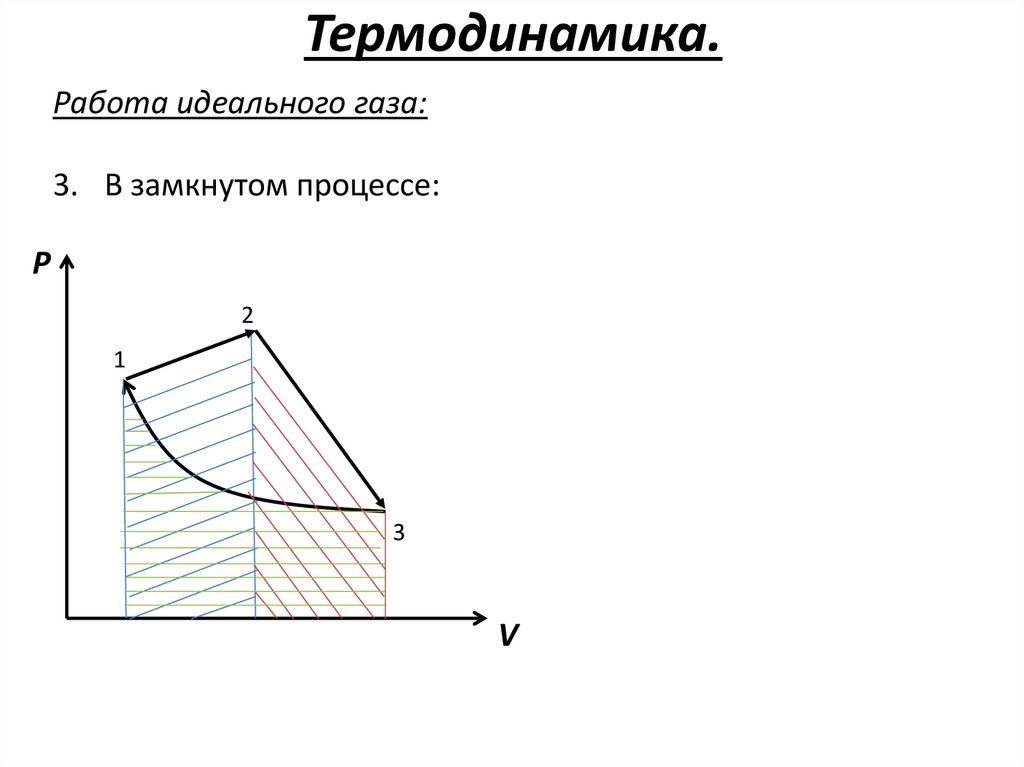
Термодинамика.Работа идеального газа:
3. В замкнутом процессе:
P
2
1
3
V
39.
Термодинамика.Первый закон термодинамики :
Количество теплоты, сообщаемое газу, идет на
совершение газом работы и изменение его
внутренней энергии
40.
Термодинамика.Изобарный процесс (p=const):
Изохорный процесс (V=const):
Изотермический процесс (T=const):
41.
Термодинамика.Адиабатический процесс (Q=0):
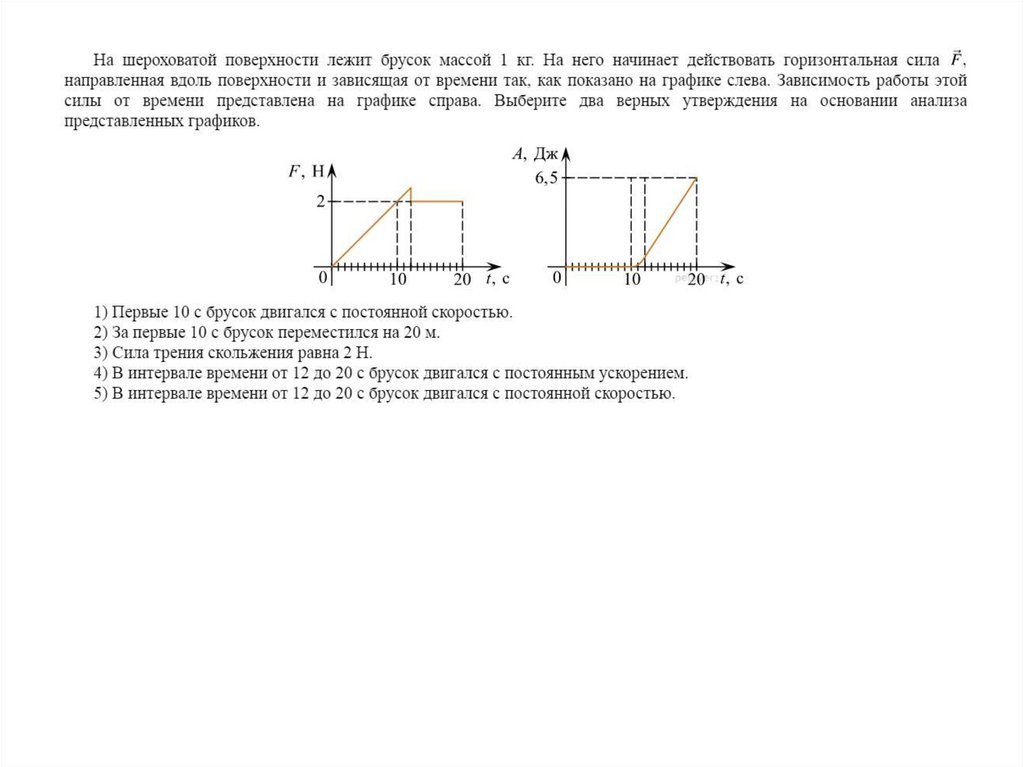









































 Физика
Физика








