Похожие презентации:
Процессы и аппараты химической технологии
1.
ПРОЦЕССЫ И АППАРАТЫ ХИМИЧЕСКОЙ ТЕХНОЛОГИИЛитература:
1. Касаткин, А.Г. Основные процессы и аппараты химической технологии
2. Дытнерский, Ю.И. Процессы и аппараты химической технологии: в 2
кн.
3. Разинов А.И., Клинов А.В.., Дьяконов Г.С. Процессы и аппараты
химической технологии: учебное пособие, 2017 , Казань
4. Плановский, А.Н. Процессы и аппараты химической и нефтехимической
технологии
5. Гельперин, Н.И. Основные процессы и аппараты химической
технологии
6. Общий курс процессов и аппаратов химической технологии: в 2 кн.; под
ред. В.Г. Айнштейна.
Семестр
Лектор:
Клинов Александр Вячеславович
Лекции
Лаб.занятия
Практика
Срс.
1
36
18
18
81
2
18
36
36
81
Всего
54
54
54
162
2.
Ученые исследует то, что существует вокруг,инженеры создают то, чего никогда не было.
Мы живем в мире созданном инженерами
3.
ПАХТ (Chemical Engineering)Перенос идей в
промышленные
технологии
Основная проблема – масштабный переход
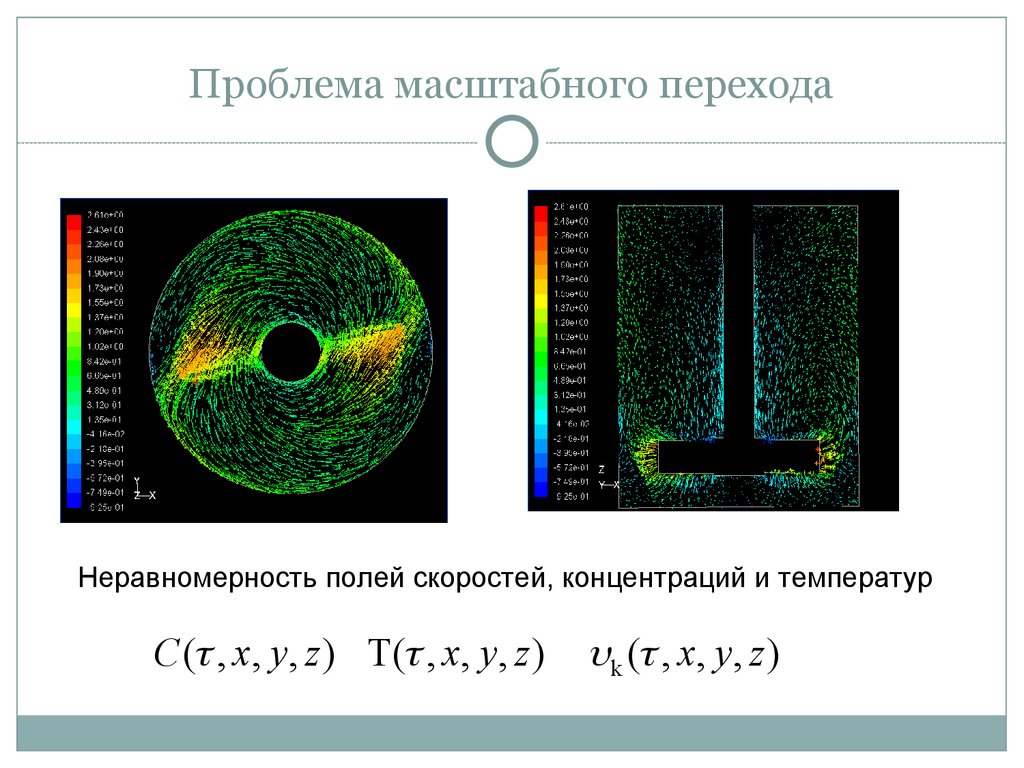
4. Проблема масштабного перехода
Неравномерность полей скоростей, концентраций и температурC ( , x, y, z ) T( , x, y, z )
k ( , x, y, z )
5. Задачи
1 Проектные – требуется подобрать и рассчитать основные размерыаппарата по заданным характеристикам входных и выходных
потоков
2 Поверочные – для заданного аппарата определенной конструкции
и размеров определяют характеристики протекания процесса в
зависимости от технологических и режимных параметров.
Необходимо выбрать оптимальный вариант решения задачи !
6. ИСТОРИЯ ВОЗНИКНОВЕНИЯ ПАХТ
В Российской империи первопроходцем в этой области стал Ф. А. Денисов,высказавший идею об общности процессов и аппаратов в различных
химических производствах (1828 год).
Эта идея подтолкнула химика Александра Крупского к созданию новой
учебной дисциплины (расчёт и проектирование основных процессов и
аппаратов) в Петербургском технологическом институте в 1890-х, позднее
такой же курс стал читать профессор И. А. Тищенко в Московском Высшем
техническом училище. Благодаря своей деятельности А. А. Крупский и
И. А. Тищенко считаются основоположниками курса «Процессы и аппараты».
Андрей Георгиевич Касаткин
(25.08.1903 - 05.06.1963)
Автор книги «Основные процессы и аппараты химической технологии»
(1935, 10-е издание 2004), переведенной на многие иностранные языки.
7. ИСТОРИЯ ВОЗНИКНОВЕНИЯ ПАХТ
Техническая школа г. Манчестер (Англия) 1901г.США в 1931 г. издан учебник В. Бержера и В. Лак-Кэба
"Основные процессы и аппараты химических производств
8.
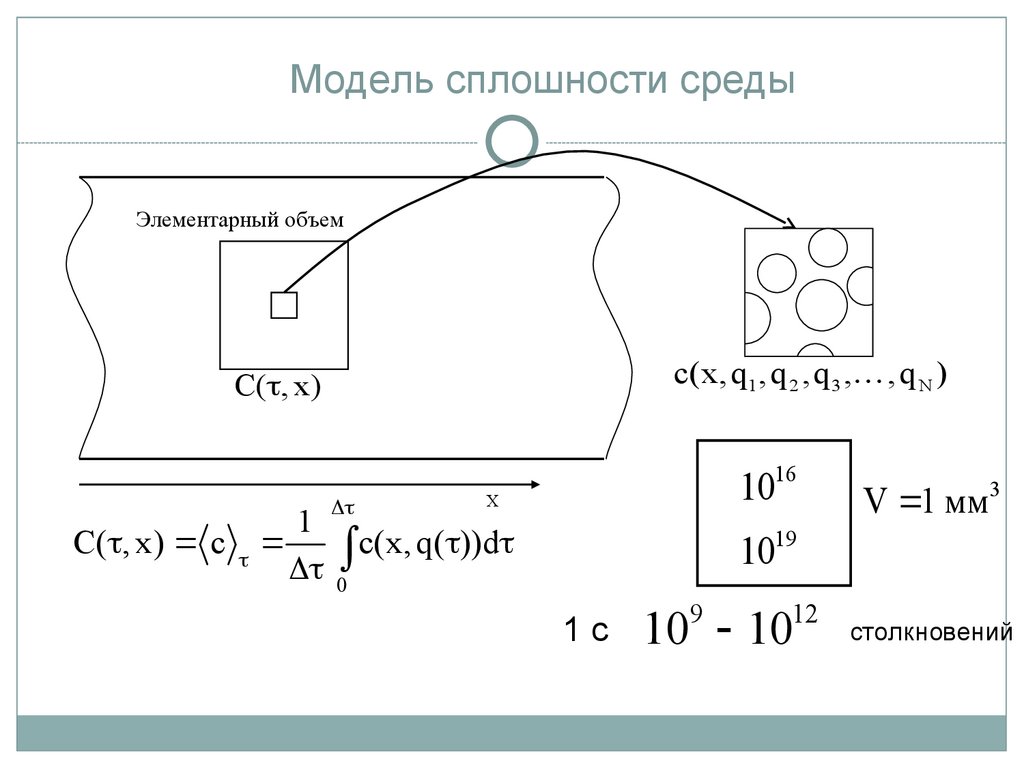
Модель сплошности средыЭлементарный объем
с(x, q1 , q 2 , q 3 , , q N )
C( , x)
C( , x) c
1
1016
X
c(x, q( ))d
V 1 мм3
1019
0
1с
9
12
10 10
столкновений
9. Система и параметры состояния
Макроскопическая система – любой материальный объект,состоящий из большого числа частиц (молекул).
Системы могут быть гомогенными и гетерогенными
Состояние системы задается макроскопическими параметрами
(внутренними и внешними), например давление, объем , температура
и т.д.
Число параметров необходимых для однозначного задания состояния
системы определяется правилом фаз Гиббса: С=К-Ф+2
Состояние системы может быть равновесным (параметры системы
не меняются с течением времени и отсутствуют потоки субстанции)
и неравновесным , а так же стационарным (параметры системы не
меняются с течением времени) и нестационарным
10.
ПроцессыПод процессом понимается последовательная смена состояний системы.
Для проведения процесса необходимо вывести систему из состояния
равновесия, т.е. оказать на нее воздействие извне. При этом будет
осуществляться перенос одного или нескольких видов субстанции: массы,
импульса, энергии.
В зависимости от того, скорость переноса какого вида субстанции определяет
скорость протекания процессов, изучаемых в данной дисциплине, они
подразделяются на следующие:
гидромеханические определяющиеся скоростью переноса импульса;
теплообменные, определяющиеся скоростью переноса энергии;
массообменные, определяющиеся скоростью переноса массы;
механические;
химические реакции
11. Процессы
Процессы могут подразделяться не только по виду переносимой субстанции,определяющей скорость их протекания, но и по ряду других признаков.
Различают стационарные процессы, в которых параметры (температура,
давление, скорость и т.д.) для любой фиксированной точки пространства не
меняются во времени, и нестационарные, в которых такие изменения
происходят.
По способу организации процессов во времени их подразделяют на
периодические и непрерывные. В периодических процессах, являющихся
нестационарными, все стадии протекают в одном месте, но в различное
время (загрузка, обработка, выгрузка). В непрерывных процессах,
являющихся, как правило, стационарными, все стадии осуществляются
одновременно, но разделены в пространстве.
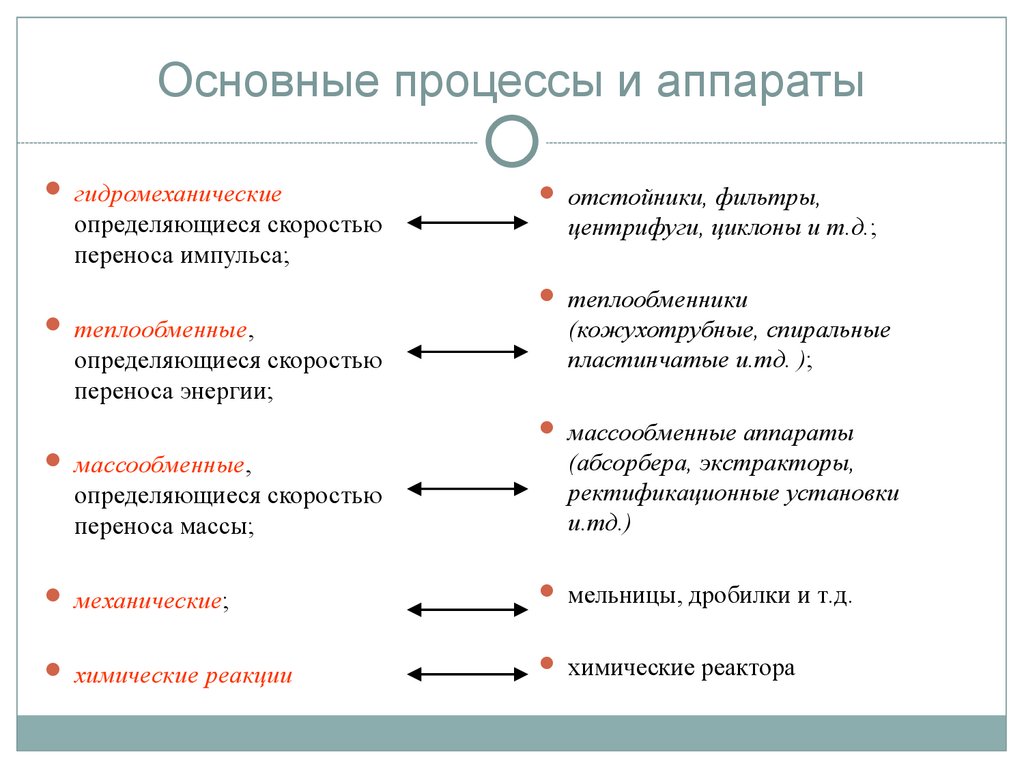
12. Основные процессы и аппараты
гидромеханическиеопределяющиеся скоростью
переноса импульса;
отстойники, фильтры,
центрифуги, циклоны и т.д.;
теплообменники
теплообменные,
определяющиеся скоростью
переноса энергии;
(кожухотрубные, спиральные
пластинчатые и.тд. );
массообменные аппараты
массообменные,
определяющиеся скоростью
переноса массы;
(абсорбера, экстракторы,
ректификационные установки
и.тд.)
механические;
мельницы, дробилки и т.д.
химические реакции
химические реактора
13. Теоретические основы химической технологии
1. Законы сохранения2. Законы термодинамики
3. Явления переноса и химическая кинетика
14.
Законы термодинамикиВторое начала термодинамики
Термодинамические функции состояния
n
-внутренняя энергия;
U(S, V, N)
dU Q PdV i dN i
i 1
F(V, T, N) U TS
Q TdS
- свободная энергия;
n
dF SdT PdV i dN i
i 1
соотношение Гиббса-Дюгема:
G(P, T, N) U TS PV
SdT VdP N i d i 0
i 1
H(P, S, N) U PV
i 1
N d
i
i 1
i
0
i
x
0
i
x k
i 1
- энтальпия;
n
При Р=const и T=const
n
n
dG SdT VdP i dN i
n
n
- энергия Гиббса;
dH TdS VdP i dN i
,
i 1
P f (T, V, N1 , N 2 , N n ) Уравнение состояния
15. Условия равновесия
Однофазная системаМногофазная система
Тепловое равновесие
Т=const
T ' T '' T ''' ... T (Ф)
T 0
Механическое равновесие
P=const
;
P 0
P ' P '' P ''' ... P (Ф)
Концентрационное (химическое) равновесие
1' 1'' 1''' ... 1(Ф)
'2 ''2 '''2 ... (Ф)
2
=const i 0
i
j k
x
y
z
a a a
a i
j
k
grada
x
y
z
.....................................
'n ''n '''n ... (Ф)
n
16. Химический потенциал
Pd i vi dP
i (T, P) i0 (T, P 0 ) v idP
P0
Идеальный газ
PV N i RT
i
Реальный газ
vi
RT
P
PV ZV Ni RT
i
P
i (T, P) i0 (T, P 0 ) RT ln P
0
f
i i0 RT ln i 0
fi
(T, P) 0 (T, P 0 ) RT ln P
fi i Px i
i (T, P) i0 (T, P 0 ) RT ln Pi
Условия фазового равновесия
Pi Px i
P 0
i 1
i i f i f i
Справедливо при любом выборе нулевого
состояния
17. Химический потенциал
Переменные P, T, xP
1
RT
ln( i )
v
i
dP
RT 0
P
Чистый компонент
P
Z 1
ln( ) V
dP
P
0
Переменные V, T, x
1 P
ln( i )
RT V N i
V, T, N j i
RT
dV ln Z V
V
Чистый компонент
Z 1
ln( ) (ZV 1) V dV ln Z V
V
V
Для расчета фугитивности (коэффициента фугитивности) необходимо
уравнение состояния
V (T, P, N1 , N 2 , N n )
P f (T, V, N1 , N 2 , N n )
18. Химический потенциал
19. Химический потенциал
fiаi 0 xi i
fi
fi 0
- активность
f i f i 0 xi i
- Фугитивность стандартного состояния
чистый компонент i при заданных Т и Р
бесконечное разбавление компонента i при заданных T и P
i (T , P, xi ) i0 (T , P ) RT ln( xi i )
g E (T , P, xi ) g( T , P, xi ) g id ( T , P, xi )
E
1 Ng
ln( i )
RT Ni
- Id идеальный раствор
x1 1 1 1, g E 0
N k ,P,T
x2 1 2 1, g E 0
i 1

















 Физика
Физика








