Похожие презентации:
Патентные споры в области фармацевтики
1.
Особенности патентных споров в областифармацевтики
Озолина И.Г., адвокат, патентный поверенный
Патентно-правовая фирма «А. Залесов и партнеры»
2.
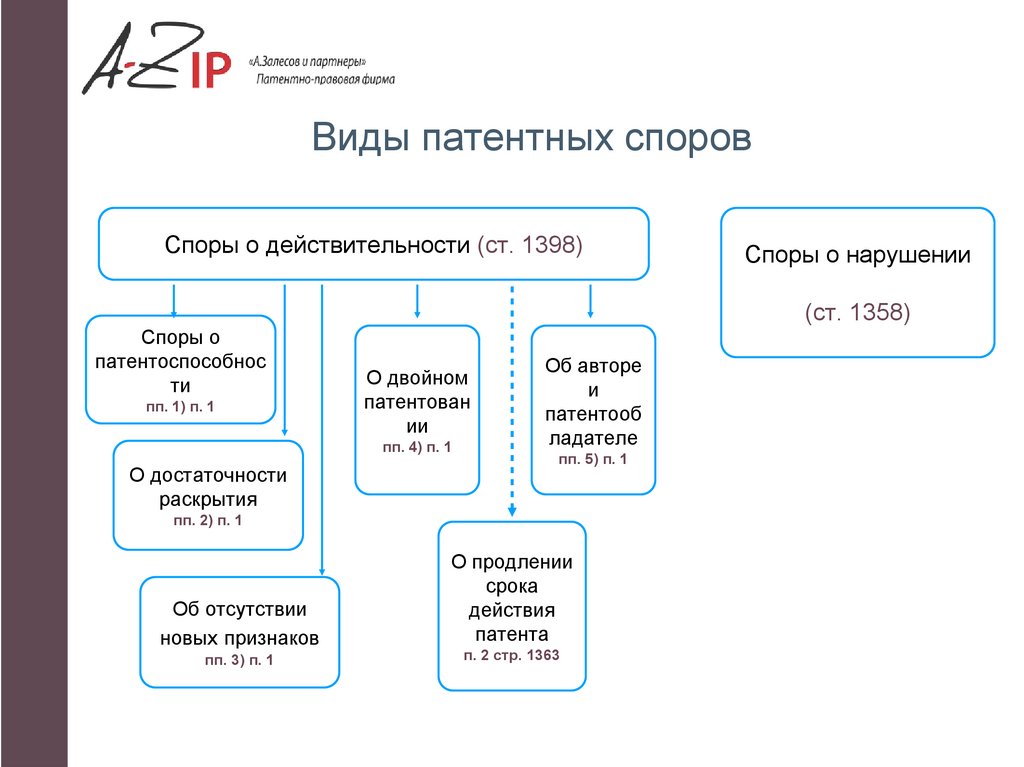
Что такое патентные споры?3.
Виды патентных споровСпоры о действительности (ст. 1398)
Споры о нарушении
(ст. 1358)
Споры о
патентоспособнос
ти
пп. 1) п. 1
О двойном
патентован
ии
пп. 4) п. 1
О достаточности
раскрытия
Об авторе
и
патентооб
ладателе
пп. 5) п. 1
пп. 2) п. 1
Об отсутствии
новых признаков
пп. 3) п. 1
О продлении
срока
действия
патента
п. 2 стр. 1363
4.
Чем изобретения в области медицины ифармацевтики отличаются от изобретений в
области электроники?
5.
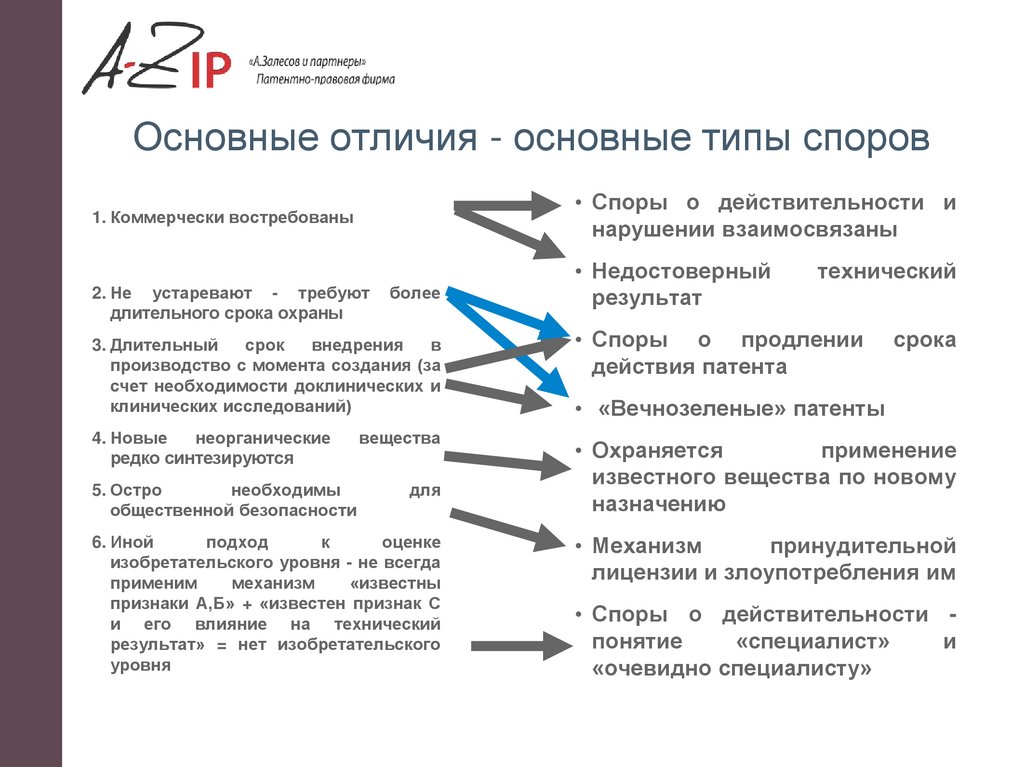
Основные отличия - основные типы споров• Споры о действительности и
нарушении взаимосвязаны
1. Коммерчески востребованы
2. Не устаревают - требуют
длительного срока охраны
более
3. Длительный
срок
внедрения
в
производство с момента создания (за
счет необходимости доклинических и
клинических исследований)
4. Новые
неорганические
редко синтезируются
5. Остро
необходимы
общественной безопасности
вещества
для
6. Иной
подход
к
оценке
изобретательского уровня - не всегда
применим
механизм
«известны
признаки А,Б» + «известен признак С
и его влияние на технический
результат» = нет изобретательского
уровня
• Недостоверный
результат
технический
• Споры о продлении
действия патента
срока
• «Вечнозеленые» патенты
• Охраняется
применение
известного вещества по новому
назначению
• Механизм
принудительной
лицензии и злоупотребления им
• Споры о действительности понятие
«специалист»
и
«очевидно специалисту»
6.
Особенности споров о нарушении7.
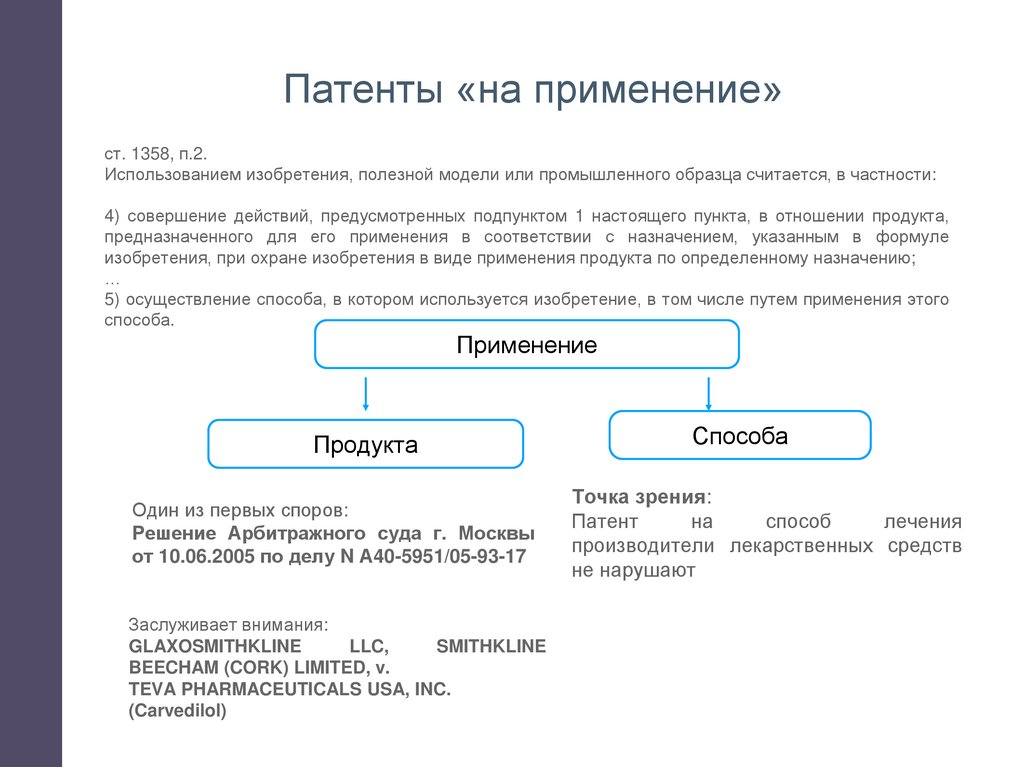
Патенты «на применение»ст. 1358, п.2.
Использованием изобретения, полезной модели или промышленного образца считается, в частности:
4) совершение действий, предусмотренных подпунктом 1 настоящего пункта, в отношении продукта,
предназначенного для его применения в соответствии с назначением, указанным в формуле
изобретения, при охране изобретения в виде применения продукта по определенному назначению;
…
5) осуществление способа, в котором используется изобретение, в том числе путем применения этого
способа.
Применение
Продукта
Один из первых споров:
Решение Арбитражного суда г. Москвы
от 10.06.2005 по делу N А40-5951/05-93-17
Заслуживает внимания:
GLAXOSMITHKLINE
LLC,
SMITHKLINE
BEECHAM (CORK) LIMITED, v.
TEVA PHARMACEUTICALS USA, INC.
(Carvedilol)
Способа
Точка зрения:
Патент
на
способ
лечения
производители лекарственных средств
не нарушают
8.
Патенты на продуктст. 1358, п.2.
Использованием изобретения, полезной модели или промышленного образца считается, в частности:
1) ввоз на территорию Российской Федерации, изготовление, применение, предложение о продаже, продажа,
иное введение в гражданский оборот или хранение для этих целей продукта, в котором использованы
изобретение или полезная модель, либо изделия, в котором использован промышленный образец;
2) совершение действий, предусмотренных подпунктом 1 настоящего пункта, в отношении продукта,
полученного непосредственно запатентованным способом. Если продукт, получаемый запатентованным
способом, является новым, идентичный продукт считается полученным путем использования запатентованного
способа, поскольку не доказано иное;
…
4) совершение действий, предусмотренных подпунктом 1 настоящего пункта, в отношении продукта,
предназначенного для его применения в соответствии с назначением, указанным в формуле изобретения, при
охране изобретения в виде применения продукта по определенному назначению;
Дело А40-90149/2011:
Спор между компанией Байер и Гедеон Рихтер о лекарственном средстве
«Мидиана».
Спор дошел до Высшего Арбитражного Суда для разрешения вопроса о
последствиях признания патента частично недействительным для дела о
нарушении.
9.
Особенности сбора доказательствДело А40-197005/2016:
Тева Фармасьютикал Индастриз Лтд. к АО «Р-Фарм»
Истребование материалов досье ответчика из Минздрава и
рассмотрение их в закрытом судебном заседании (Определение
от 15.03.2017).
10.
Споры о принудительных лицензияхИнтересы
правообладателей
окупить затраты на
инновации
Интересы
общества
стимулировать развитие
науки и техники
пользоваться плодами
развития науки и техники,
заработать на
инновациях
создать/сохранить
репутацию
побудить разработчиков
раскрыть результат
интеллектуальной
деятельности
обеспечить национальную
безопасность, в том
числе, в сфере
здравоохранения
11.
Принудительное лицензирование - один из механизмовсоблюдения баланса
Согласно статье 1362 ГК РФ, принудительная
лицензия возможна:
в случае недостаточного использования либо
неиспользования в течение 4-х лет
в случае наличия зависимого патента, если такой
патент - важное техническое достижение и имеет
существенные экономические преимущества.
12.
История развития судебной практики в отношении принудительнойлицензии
Первая попытка: А40-83104/2011 - встречный иск (определение от 25 мая
2021 года) в споре между Дебиофарм С.А. и ООО «Тева» (по двум
основаниям).
Первые дела по предоставлению принудительной лицензии на основании
наличия зависимого патента (на основании статьи 1362):
Леналидомид (ООО «Натива» vs. Сьюджен - No А40-71471/17, заключено
мировое на стадии кассации)
Сорафениб (Байер vs. ООО «Натива» - А41-3828/18, дело
рассматривается, ООО «Натива» vs. Байер - А40-157726/2018, дело
приостановлено до рассмотрения Федеральной службой по
интеллектуальной собственности возражения Байер от 03.02.2020 против
выдачи патента РФ No 2568638 на изобретение)
Сунитиниб (Сьюджен (группа Пфайзер) vs. ООО «Натива» - А40166505/2017, 20.02.2020 - в передаче спора для рассмотрения в заседании
судебной коллегии Верховного суда РФ отказано)
13.
Постановление Конституционного Суда от 13 февраля 2018 года №8-П
Осуществляя правовое регулирование ответственности за нарушение
прав интеллектуальной собственности, федеральный законодатель в
пределах своих полномочий вправе устанавливать и изменять меры
ответственности, в том числе их вид и размер, будучи вместе с тем
связан предписаниями статьи 55 (часть 3) Конституции Российской
Федерации, которые во взаимосвязи с ее статьями 8, 17, 19, 34 и 35
применительно
к
праву
частной
собственности,
свободе
экономической деятельности допускают возможность их ограничений
федеральным законом, если такие ограничения базируются на общих
принципах
права,
отвечают
требованиям
равенства
и
справедливости,
являются
адекватными,
соразмерными
конституционно значимым целям и ценностям и необходимы для их
защиты.
Имея своим предназначением воспрепятствование злоупотреблению
правом, такое правовое регулирование не должно посягать на само
существо того или иного права и приводить к утрате его реального
содержания…
14.
Принудительная лицензия в связи с угрозой национальнойбезопасности
Статья 1360. Использование изобретения, полезной модели или
промышленного образца в интересах национальной безопасности
Правительство Российской Федерации имеет право в интересах обороны
и безопасности разрешить использование изобретения, полезной модели
или промышленного образца без согласия патентообладателя с
уведомлением его об этом в кратчайший срок и с выплатой ему
соразмерной компенсации.
Обсуждаемый в Государственной Думе законопроект:
«в случае крайней необходимости в связи с обеспечением обороны и
безопасности государства, охраной жизни и здоровья граждан».
Ассоциации международных фармпроизводителей:
Соглашение ТРИПС предусматривает, что использовать изобретение под
чужим патентом можно только после тщательных переговоров с
патентообладателем или в случае чрезвычайной ситуации.
15.
Первая принудительная лицензия выдана5 января 2021 года опубликовано распоряжение Правительства
РФ от 31 декабря 2020 года № 3718-р о выдаче принудительной
лицензии на изобретения, связанные с производством
ремдесивира. Разрешение выдано АО «Фармасинтез» на
использование соответствующих патентов на изобретения,
принадлежащие Gilead Sciences, Inc. и Gilead Pharmasset LLC,
сроком на один год.
16.
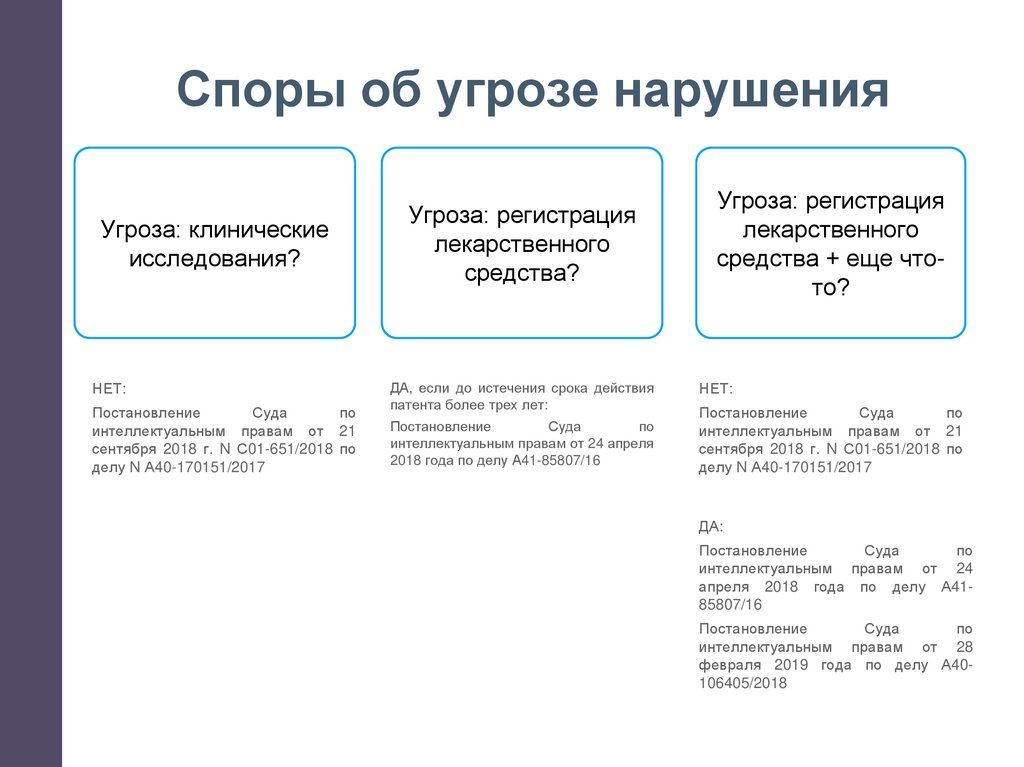
Споры об угрозе нарушенияУгроза: клинические
исследования?
НЕТ:
Постановление
Суда
по
интеллектуальным правам от 21
сентября 2018 г. N С01-651/2018 по
делу N А40-170151/2017
Угроза: регистрация
лекарственного
средства?
ДА, если до истечения срока действия
патента более трех лет:
Постановление
Суда
по
интеллектуальным правам от 24 апреля
2018 года по делу А41-85807/16
Угроза: регистрация
лекарственного
средства + еще чтото?
НЕТ:
Постановление
Суда
по
интеллектуальным правам от 21
сентября 2018 г. N С01-651/2018 по
делу N А40-170151/2017
ДА:
Постановление
Суда
по
интеллектуальным правам от 24
апреля 2018 года по делу А4185807/16
Постановление
Суда
по
интеллектуальным правам от 28
февраля 2019 года по делу А40106405/2018
17.
Применение пункта 7 статьи 32 Федерального закона от 12 апреля 2010 г. N 61-ФЗ "Обобращении лекарственных средств"
(аннулирование регистрации лекарственного средства в связи с нарушением
интеллектуальных прав)
Постановление Суда по интеллектуальным правам от 20 сентября 2016 г. N С01-542/2016 по делу N А40158999/2015:
Истец полагал, что суд, отказывая в рамках иного дела (дело N А43-18360/2013) в удовлетворения требования
ответчика о признании недействительным решения Управления Федеральной антимонопольной ответчика
нарушившим пункт 4 части 1 статьи 14 Федерального закона от 26.07.2006 N 135-ФЗ "О защите конкуренции"
(далее - Закон о защите конкуренции), установил, что действия ответчика по введению в оборот спорного
лекарственного препарата с использованием евразийского патента N 008765 являются незаконными.
Суды сочли, что в этом случае судебного акта о нарушении не было, поэтому в требовании отказано.
NB: «При этом названная норма не содержит указаний на то обстоятельство, что лицом, нарушившим право
правообладателя объектов интеллектуальной собственности при обращении лекарственных средств, может
выступать только лицо, являющееся держателем или владельцем регистрационного удостоверения
лекарственного препарата.
Между тем, гражданское законодательство позволяет привлекать к гражданско-правовой ответственности лицо,
вводящее в гражданский оборот на территории Российской Федерации товар, нарушающий исключительное право
на объект интеллектуальной собственности, а не только производителя такого товара.
Таким образом, Министерством, а впоследствии и судом первой инстанции, сделан ошибочный вывод о том, что
ответчиком по такому иску должен выступать исключительно обладатель регистрационного удостоверения иностранный производитель лекарственного средства».
18.
Право Sui generis - защита данных доклинических иклинических исследований
Федеральный закон от 12 апреля 2010 г. N 61-ФЗ «Об обращении лекарственных средств» (далее Закон)
Приказ Министерства здравоохранения РФ от 12 июля 2017 г. N 409н «Об утверждении порядка
формирования регистрационного досье на лекарственный препарат и требований к документам в
его составе, требований к объему информации, предоставляемой в составе регистрационного
досье, для отдельных видов лекарственных препаратов для медицинского применения и порядка
представления документов, из которых формируется регистрационное досье на лекарственный
препарат для медицинского применения в целях его государственной регистрации» (далее - Приказ
409н)
Приложение 2 к Приказу 409н: Требования к объему информации, предоставляемой в составе
регистрационного досье, для отдельных видов лекарственных препаратов для медицинского
применения
Статья 39 ТРИПС
Обобщение правовых позиций межгосударственных органов по защите прав и свобод человека и
специальных докладчиков (рабочих групп), действующих в рамках Совета ООН по правам
человека, по вопросу защиты права лица на охрану здоровья
Письмо Федеральной антимонопольной службы от 1 июля 2013 г. N АК/25271-ПР/13 "О проекте
федерального закона "О внесении изменений в Федеральный закон "Об обращении лекарственных
средств" и в статью 333.32.1. части второй Налогового кодекса Российской Федерации»
Доклад Рабочей группы по присоединению Российской Федерации к ВТО от 16 ноября 2011 г.
Постановление Суда по интеллектуальным правам от 17 декабря 2015 г. N С01-882/2015 по делу
N А40-188378/2014
19.
Споры о продлении20.
Продление срока действия патента: ч. 2 ст. 1363 ГК РФЕсли с даты подачи заявки на выдачу патента на изобретение, относящееся к такому
продукту, как лекарственное средство, пестицид или агрохимикат, для применения
которых требуется получение в установленном законом порядке разрешения, до дня
получения первого разрешения на применение прошло более пяти лет, срок действия
исключительного права на соответствующее изобретение и удостоверяющего это
право патента продлевается по заявлению патентообладателя федеральным
органом исполнительной власти по интеллектуальной собственности.
Указанный срок продлевается на время, прошедшее с даты подачи заявки на выдачу
патента на изобретение до дня получения первого разрешения на применение
продукта, за вычетом пяти лет, но не более чем на пять лет.
Заявление о продлении срока подается патентообладателем в период действия
патента до истечения шести месяцев со дня получения первого разрешения на
применение продукта или с даты выдачи патента в зависимости от того, какой из этих
сроков истекает позднее.
…
При продлении на основании абзаца первого настоящего пункта срока действия
исключительного права выдается дополнительный патент с формулой, содержащей
совокупность признаков запатентованного изобретения, характеризующую продукт,
на применение которого получено разрешение.
21.
СИП-155/2014Компания Авентис Фарма 28.06.2012 на основании пункта 2 статьи 1363 ГК РФ обратилась в
Роспатент с заявлением о продлении срока действия патента Российской Федерации No
2134123, представив в обоснование своего заявления регистрационное удостоверение No
ЛП-001500 от 13.02.2012 на лекарственный препарат «Джевтана».
… В период рассмотрения этого заявления решением Роспатента от 26.12.2012 патент
Российской Федерации No 2134123 был признан недействительным частично…
После выдачи нового патента Российской Федерации No2481827 взамен патента Российской
Федерации No 2134123 компания Авентис Фарма 15.04.2013 обратилась в Роспатент с
заявлением о продлении срока действия патента Российской Федерации No 2481827, указав
в заявлении на то, что просит рассматривать его как продолжение заявления о продлении
срока действия патента Российской Федерации No 2134123…
Продляя патент Российской Федерации No 2481827, Роспатент исходил из того, что
представленное компанией Авентис Фарма регистрационное удостоверение No ЛП-001500
от 13.02.2012 на лекарственный препарат «Джевтана» является первым разрешением на
применение лекарственного средства, к которому относится изобретение.
Между тем Роспатентом не учтено, что данное регистрационное удостоверение не является
первым разрешением, поскольку 01.04.1996 Министерством здравоохранения и медицинской
промышленности Российской Федерации было выдано регистрационное удостоверение П-8242 No 007384 на лекарственное средство «Таксотер». Также в материалах дела имеются
регистрационные удостоверения на данное лекарственное средство от 07.06.2001 (том 2,
л.д.104) и от 20.03.2007 (том 2, л.д. 64).
22.
СИП-461/2020Спор о действительности продления патента компании Novo Nordisk A/S № 2352581,
иск подан ООО «Герофарм»
«В силу части 2 статьи 9 Арбитражного процессуального кодекса Российской
Федерации лица, участвующие в деле, несут риск наступления последствий
совершения или несовершения ими процессуальных действий.
Таким образом, пропуск срока является самостоятельным основанием для отказа в
удовлетворении требования о признании недействительными ненормативных
правовых актов, незаконными решений и действий (бездействия) органов,
осуществляющих публичные полномочия, должностных лиц.
Ходатайство о восстановлении пропущенного срока обществом «Герофарм» не
заявлено, поскольку заявитель полагает срок на обращение в суд не пропущенным.
В силу части 4 статьи 170 Арбитражного процессуального кодекса Российской
Федерации в случае отказа в иске в связи с признанием неуважительными причин
пропуска срока исковой давности или срока обращения в суд в мотивировочной части
решения суда указывается только на установление судом данных обстоятельств, в
связи с чем изложенные в заявлении общества «Герофарм» доводы о незаконности
действий Роспатента рассмотрению не подлежат».
23.
Споры о действительности патентов24.
Соотношение объема правовой охраны патента призащите и оспаривании патентных прав
Тезис, вытекающий из основных принципов патентного права:
Объем правовой охраны изобретения (определяемый формулой
с возможностью использовать описание для толкования) при
выдаче патента, оспаривании патента и защите патентных прав
должен быть одинаковый.
С учетом разделения процедур оспаривания патента и защиты
патентных прав (встречный иск о недействительности патента
невозможен) выполнение этого простого условия затруднено.
Постановление ВАС РФ от 31 января 2012 года № 11025/11:
формула изобретения должна толковаться с учетом имеющегося
уровня техники.
25.
Соотношение объема правовой охраны патента призащите и оспаривании патентных прав
Тезис, вытекающий из основных принципов патентного права:
Объем правовой охраны изобретения (определяемый формулой
с возможностью использовать описание для толкования) при
выдаче патента, оспаривании патента и защите патентных прав
должен быть одинаковый.
С учетом разделения процедур оспаривания патента и защиты
патентных прав (встречный иск о недействительности патента
невозможен) выполнение этого простого условия затруднено.
Постановление ВАС РФ от 31 января 2012 года № 11025/11:
формула изобретения должна толковаться с учетом имеющегося
уровня техники.
26.
Патент № 2137766, пункт 1:«Оптически чистые Na+, Мg2+, Li+, К+ или
Са2+КРКА:
соли (-)-5-метокси-2-[[(4-метоксиПозиция
3,5-диметил-2-пиридинил)метил] сульфинил]-1Н-бензимидазола»
Дело
о действительности
А40-24937/09Из
уровня
техники известен омепразол
как
51-296
Дело о нарушении А40-156272/13-129-1031
таковой в виде рацемата (смеси двух
Астра Зенека АБ vs. ООО «КРКА ФАРМА»
КРКА, товарна здравил, л.д., vs.
Роспатент (-)-энантиомер и (+)-энантиомер),
энантиомеров:
Позиция ООО «КРКА ФАРМА»:
Из уровня техники известен омепразол как известна магниевая соль этой смеси (рацемата),
таковой в виде рацемата (смеси двух
энантиомеров:
(-)-энантиомер
и
(+)- известен способ разделения выделения обоих
энантиомер), известна магниевая соль этой типов энантиомеров из смеси (рацемата),
смеси (рацемата), известен способ разделения
выделения обоих типов энантиомеров из следовательно сама по себе магниевая соль
смеси (рацемата), следовательно сама по себе
одного из энантиомеров не может считаться
магниевая соль одного из энантиомеров не
может
считаться
патентноспособной. патентноспособной.
Следовательно, объем охраны изобретения
распространяется на такое вещество, которое Понятие «оптически чистый» недостаточно
соответствует данному судом толкованию
признака «оптически чистые» - т.е., вещество, определено.
содержащее более чем 99,8% (-)-энантиомера
В описании не подтверждается, что заявленный
омепразола.
Поскольку в лекарственном препарате
технический результат реализуется только при
«Эманера» содержание (-)-энантиомера менее
99,8%, следовательно, нельзя считать, что чистоте более 99,8% (-)-энантиомера омепразола:
есть нарушение.
в описании оспариваемого патента отсутствуют
сравнительные примеры, подтверждающие
27.
Патент № 2137766, пункт 1:«Оптически чистые Na+, Мg2+, Li+, К+ или Са2+ соли (-)-5-метокси-2-[[(4-метокси3,5-диметил-2-пиридинил)метил] сульфинил]-1Н-бензимидазола»
Дело о действительности А40-24937/0951-296
Дело о нарушении А40-156272/13-129-1031
Астра Зенека АБ vs. ООО «КРКА ФАРМА»
КРКА, товарна здравил, л.д., vs.
Роспатент
Позиция Астра Зенека АБ:
Существо изобретения - достижение
определенных фармакологических и
фармакодинамических свойств, которые
достигаются, в том числе, при меньшей
чистоте (99,4 - 99.6), следовательно,
признак,
использованный
в
лекарственном средстве «Эманера»,
эквивалентен
признаку
«оптически
чистый».
Позиция Астра Зенека:
Технический результат изобретения
заключается в получении новых солей (-)энантиомеров омепразола с высокой (>99,8%)
оптической чистотой с определенными
свойствами, обеспечивающих достижение
улучшенных фармакокинетических и
метаболических свойств, которые могут быть
достигнуты только при очень высокой степени
очистки эзомепразола - более 99,8%.
28.
Патент № 2137766, пункт 1:«Оптически чистые Na+, Мg2+, Li+, К+ или Са2+ соли (-)-5-метокси-2-[[(4-метокси3,5-диметил-2-пиридинил)метил] сульфинил]-1Н-бензимидазола»
Дело о действительности А40-24937/0951-296
Дело о нарушении А40-156272/13-129-1031
Астра Зенека АБ vs. ООО «КРКА ФАРМА»
КРКА, товарна здравил, л.д., vs.
Роспатент
Решение Суда
Решение Суда
Существом изобретения является не
достижение
определенных
Из описания изобретения по патенту No 2137766
фармакологических и фармакодинамических
свойств,
а
достижение
улучшенных прямо следует, что технический результат
фармакокинетических и метаболических
свойств,
которые,
по
утверждению изобретения определен и заключается в
патентообладателя, могут быть достигнуты получении новых солей (-)-энантиомеров,
только при очень высокой степени очистки
омепразола с высокой (> 99,8%) оптической
эзомепразола - более 99,8%.
Следовательно, при разрешении вопроса о
чистотой,
с
улучшенными
том, является ли признак, содержащийся в
препарате «Эманера», и признак формулы фармакокинетическими
и
метаболическими
изобретения по патенту эквивалентными,
нельзя ссылаться на то, что и препарат свойствами, которые обеспечивают улучшенную
«Эманера», и изобретение по патенту имеют терапевтическую характеристику, такую как
одинаковые
фармакологические
и
фармакодинамические свойства, поскольку пониженная степень внутрииндивидуальной
существо изобретения, обеспечивающее его
изменчивости, а также обладают стабильностью
охраноспособность, составляют иные новые и
неожиданные свойства.
по отношению к рацемизации при хранении, как в
Следовательно, нарушения нет.
29.
Неподтвержденный или недостоверный технический результат- попытка «обхода» требования к изобретательскому уровню
Общая формула проверки изобретательского уровня:
«из уровня техники известны признаки А,Б»
+
«из уровня техники известен признак В и его влияние на технический
результат»
=
«у изобретения АБВ нет изобретательского уровня»
Если технический результат выдуман - будет ли он известен из уровня
техники?
Технические результаты, подтверждение которых затруднительно:
• Увеличение периода действия препарата
• Увеличение (улучшение, «сглаживание профиля») биодоступности
• Снижение различных побочных эффектов
• Увеличение срока хранения препарата
30.
Примеры судебной практикиООО «Герофарм» vs. Санофи.
СИП-628/2017
Пункт 1 формулы изобретения по патенту РФ № 2 564 104:
Фармацевтическая композиция на водной основе для лечения диабета I типа и II типа у пациента,
включающая в себя 300 Ед/мл инсулина гларгина [эквимолярно 300 ME инсулина человека].
Технический результат:
«Однако инсулин гларгин U300 продемонстрировал еще более плавный профиль PK (воздействия) и PD
(активности)».
Роспатент оставил патент в силе, Суд по интеллектуальным правам отменил решение, отправил на новое
рассмотрение, Президиум отменил, направил в первую инстанцию на пересмотр (дело СИП-628/2017)
Бристоль Майерс Сквибб vs. ООО «Натива»
СИП-307/2019
«Кристаллическая безводная δ-модификация N-(2-хлор-6-метилфенил)-2-[[6-[4-(2-гидроксиэтил)-1пиперазинил]-2-метил-4-пиримидинил]амино]-5-тиазолкарбоксамида, способ ее получения и
фармацевтическая композиция на ее основе»
31.
СИП-628/2017 - последствия неправильногоустановления приоритета
При испрашивании приоритета по дате подачи более ранней заявки в такой
более ранней (приоритетной) заявке должны быть раскрыты все признаки
изобретения, на которое, в итоге, получен патент. Произвольное
установление приоритета без такого подтверждения недопустимо.
Исходя из этого, Суд подтвердил, что датой приоритета должна быть более
поздняя дата приоритета патента №2564104, нежели дата, которую счел
датой приоритета Роспатент при вынесении решения, что позволило Суду
при оценке указать на необходимость при оценке новизны изобретения
принять во внимание публикации, появившиеся между указанными двумя
датами.
Данная проблема долгое время никак не была решена в российской
патентной практике (например: А.В.Залесов. Проблема действительности
патента в Российской Федерации при ошибочно установленном
конвенционном приоритете// Патентный поверенный, № 4, Июль - Август,
2018)
32.
Критерий очевидности специалисту - два подходаОчевидно исследователю
Очевидно медику
(ссылка на доказательную
медицину)
СИП - 291/2017 (очевидно медику)
СИП - 328/2019 - мирное урегулирование спора
33.
СИП-628/2017 - последствия неправильногоустановления приоритета
При испрашивании приоритета по дате подачи более ранней заявки в такой
более ранней (приоритетной) заявке должны быть раскрыты все признаки
изобретения, на которое, в итоге, получен патент. Произвольное
установление приоритета без такого подтверждения недопустимо.
Исходя из этого, Суд подтвердил, что датой приоритета должна быть более
поздняя дата приоритета патента №2564104, нежели дата, которую счел
датой приоритета Роспатент при вынесении решения, что позволило Суду
при оценке указать на необходимость при оценке новизны изобретения
принять во внимание публикации, появившиеся между указанными двумя
датами.
Данная проблема долгое время никак не была решена в российской
патентной практике (например: А.В.Залесов. Проблема действительности
патента в Российской Федерации при ошибочно установленном
конвенционном приоритете// Патентный поверенный, № 4, Июль - Август,
2018)
34.
YouTubeСпасибо за внимание!
Озолина И.Г. Патентный поверенный РФ, рег. № 1212
Адвокат, Старший партнер
www.azalesov.ru





























 Медицина
Медицина Право
Право








