Похожие презентации:
Подготовка к итоговой контрольной работе
1.
Подготовка к итоговойконтрольной работе »
2.
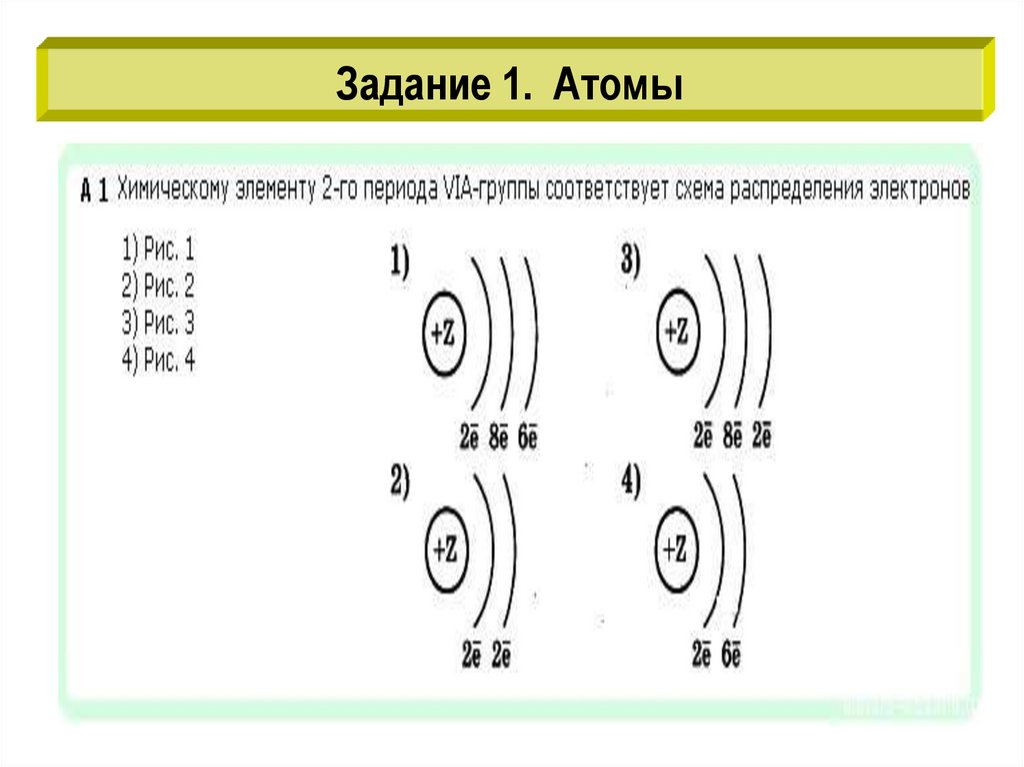
Задание 1. Атомы3.
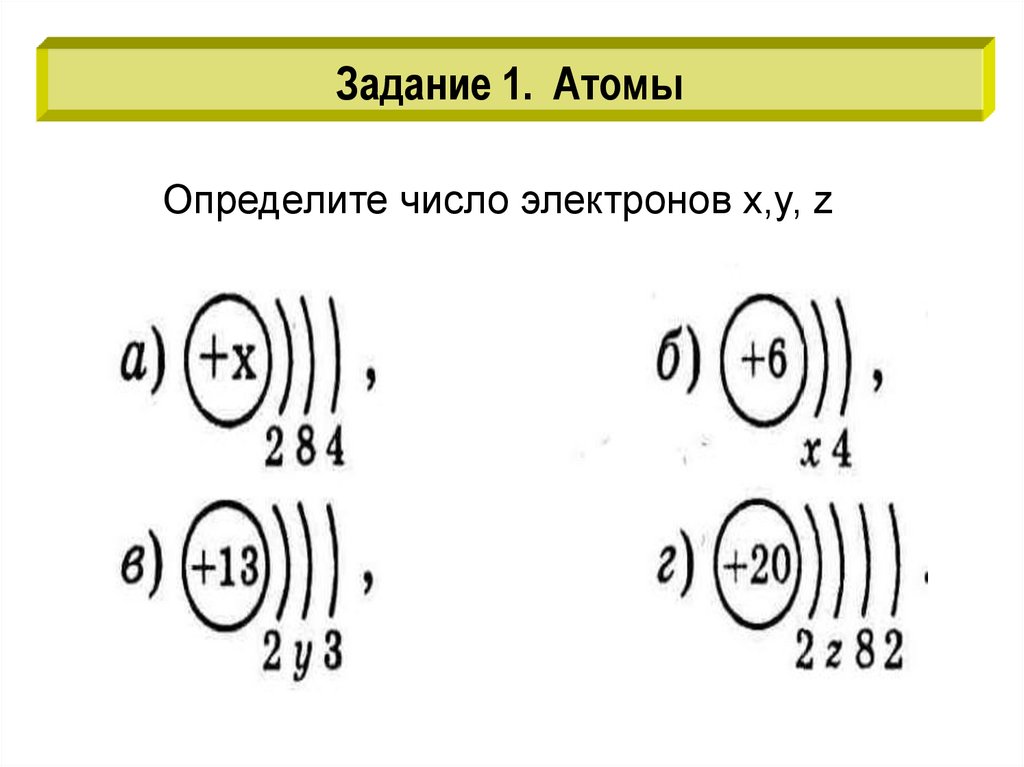
Задание 1. АтомыОпределите число электронов х,y, z
4.
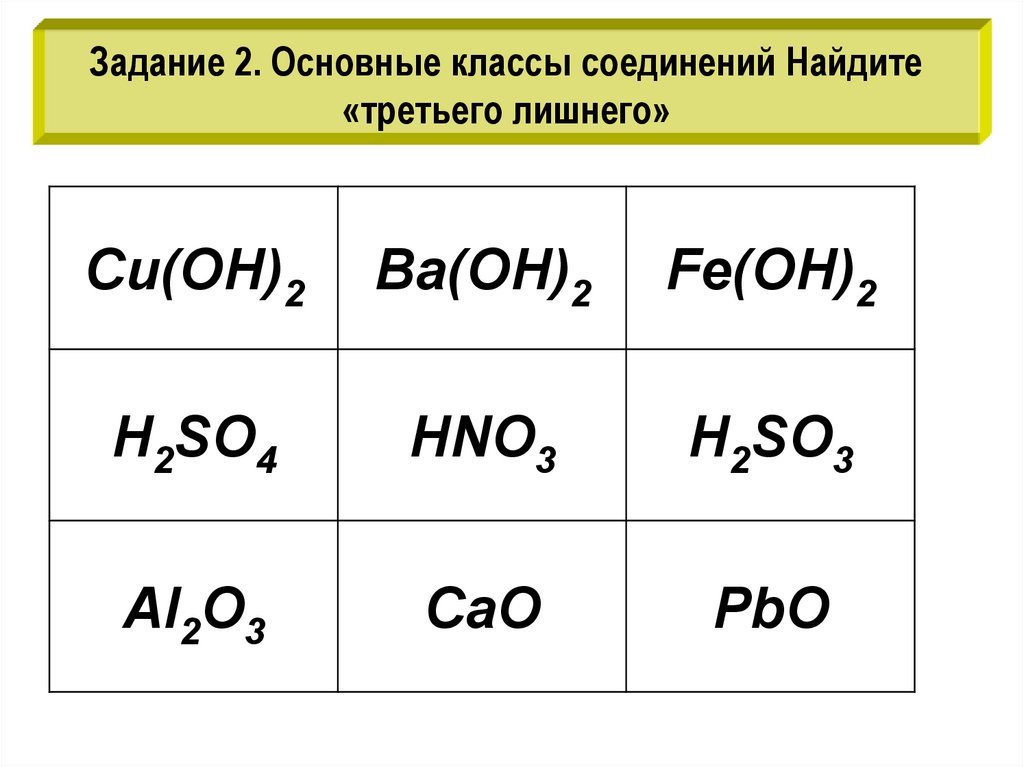
Задание 2. Основные классы соединений Найдите«третьего лишнего»
Cu(OH)2
Ba(OH)2
Fe(OH)2
H2SO4
HNO3
H2SO3
Al2O3
CaO
PbO
5.
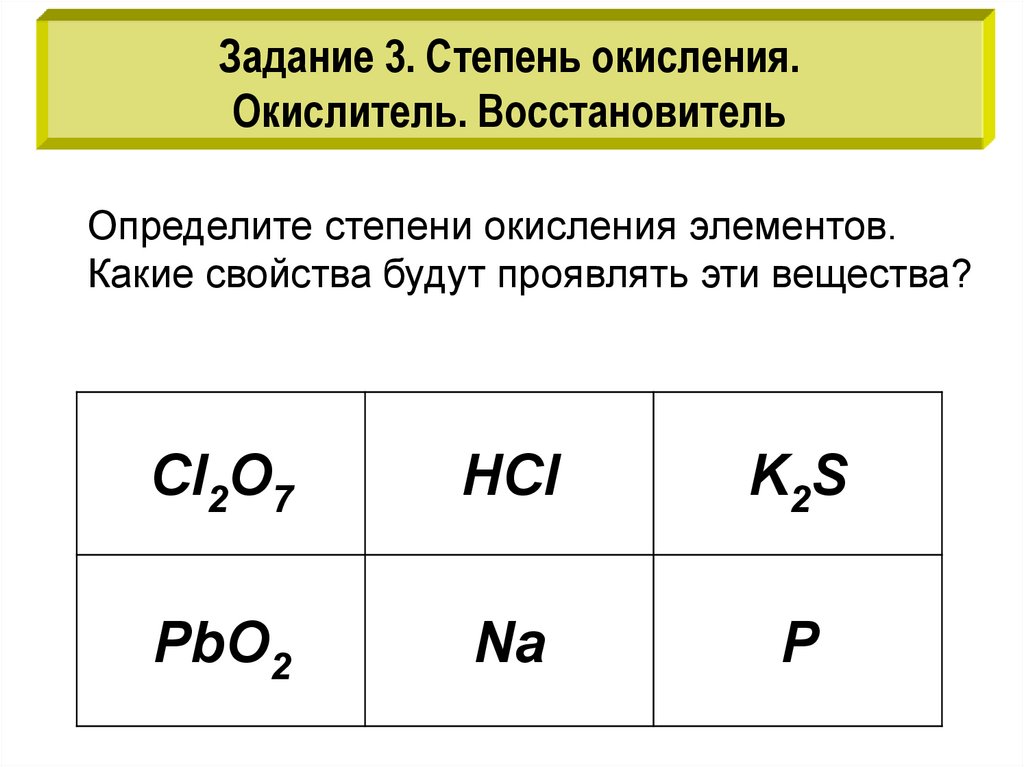
Задание 3. Степень окисления.Окислитель. Восстановитель
Определите степени окисления элементов.
Какие свойства будут проявлять эти вещества?
Cl2O7
HCl
K2S
PbO2
Na
P
6.
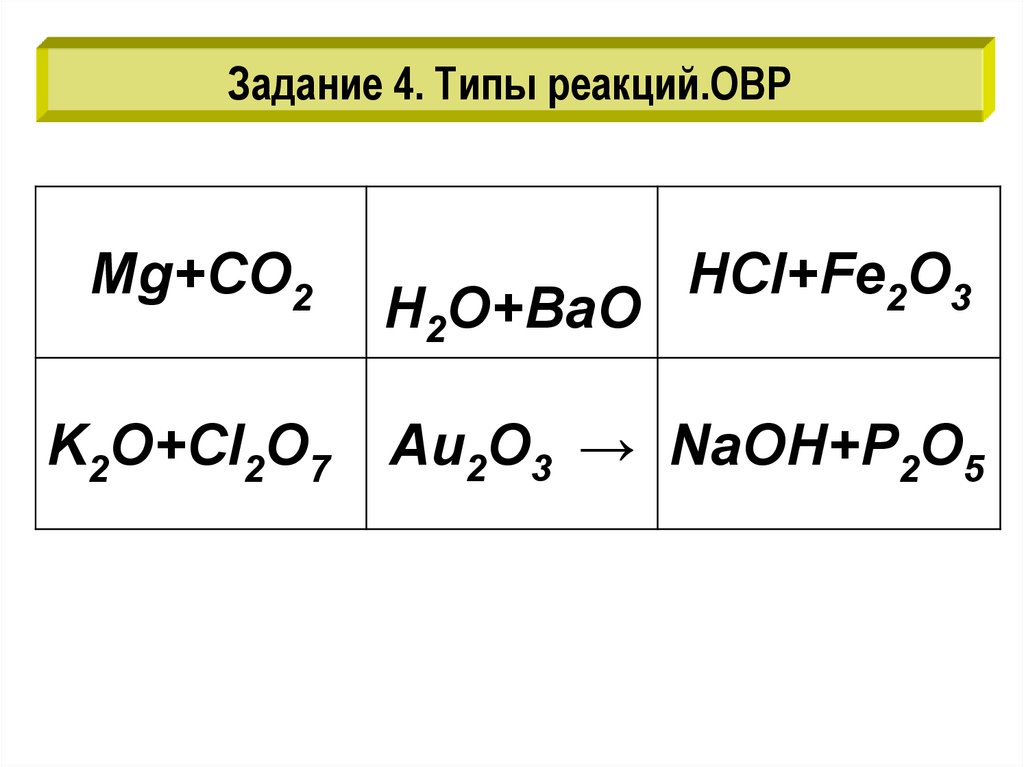
Задание 4. Типы реакций.ОВРMg+CO2
K2O+Cl2O7
H2O+BaO
HCl+Fe2O3
Au2O3 → NaOH+P2O5
7.
Задание 5 Химическая связьFeO, Al , SiO2,HNO3,BaF2
8. нитрат серебра + хлорид бария (с доказательством причины ее необратимости)
Задание 6. Составьте ионноеуравнение реакции
нитрат серебра + хлорид бария
(с доказательством причины ее
необратимости)
2 AgNO3 + BaCl2 = 2AgCl↓ + Ba(NO3)2
2Ag+ + 2NO3- + Ba2+ + 2Cl- =
= 2AgCl↓ + Ba2+ + 2NO3Ag+ + Cl- = AgCl↓
9.
Задание 7 Генетическая связь веществОпределите пропущенное вещество
Mg → X → Mg(NO3)2 → карбонат
магния
Х= MgO
Si → SiO2 →Na2SiO3 →Y
Y=H2SiO3
10.
Задание 8.Задача с уравнением реакции
К раствору сульфата меди (II ) массой 120г с массовой
долей 20% прилили раствор гидроксида натрия.
Определите массу образовавшегося гидроксида меди (II).
Решение:
mв(CuSO4 )=ω в · m р-ра= 0,2 · 120 = 24(г)
ν (CuSO4 )=m/M =24г/160г/моль=0,15 моль
0,15моль
х моль
1 моль
1 моль
х = 0,15моль
m(Cu(OH)2)= ν · M (Cu(OH)2= 0,15 моль · 98г/моль=14,7г.
Ответ: m(Cu(OH)2)= 14,7 г
11.
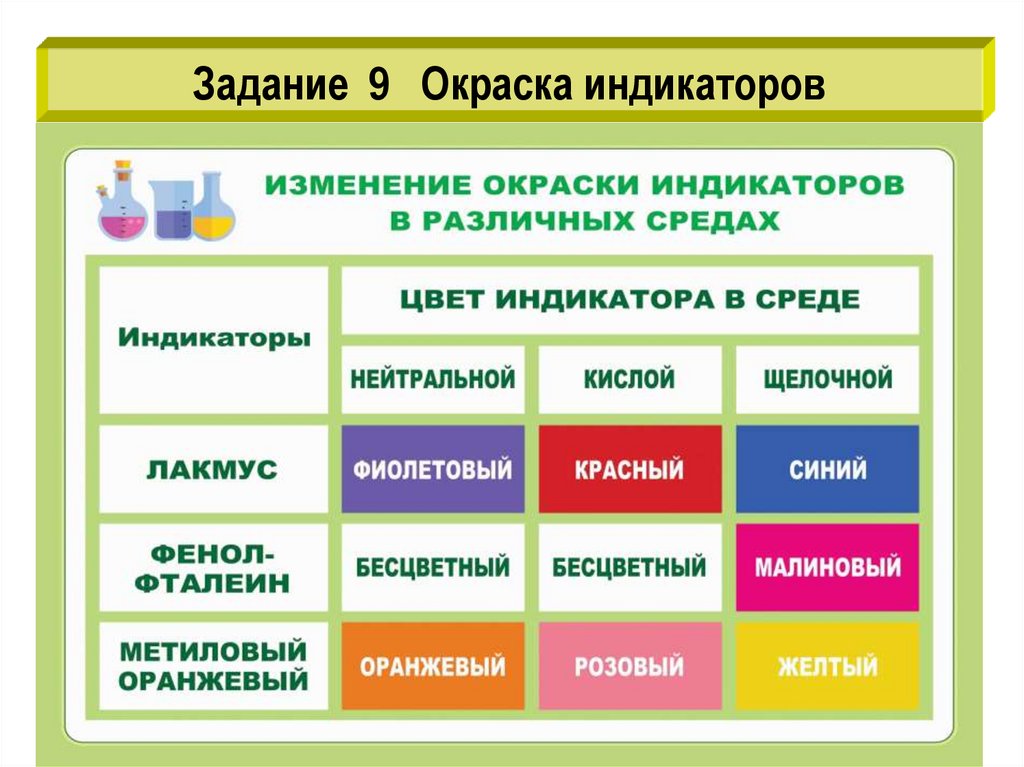
Задание 9 Окраска индикаторов12.
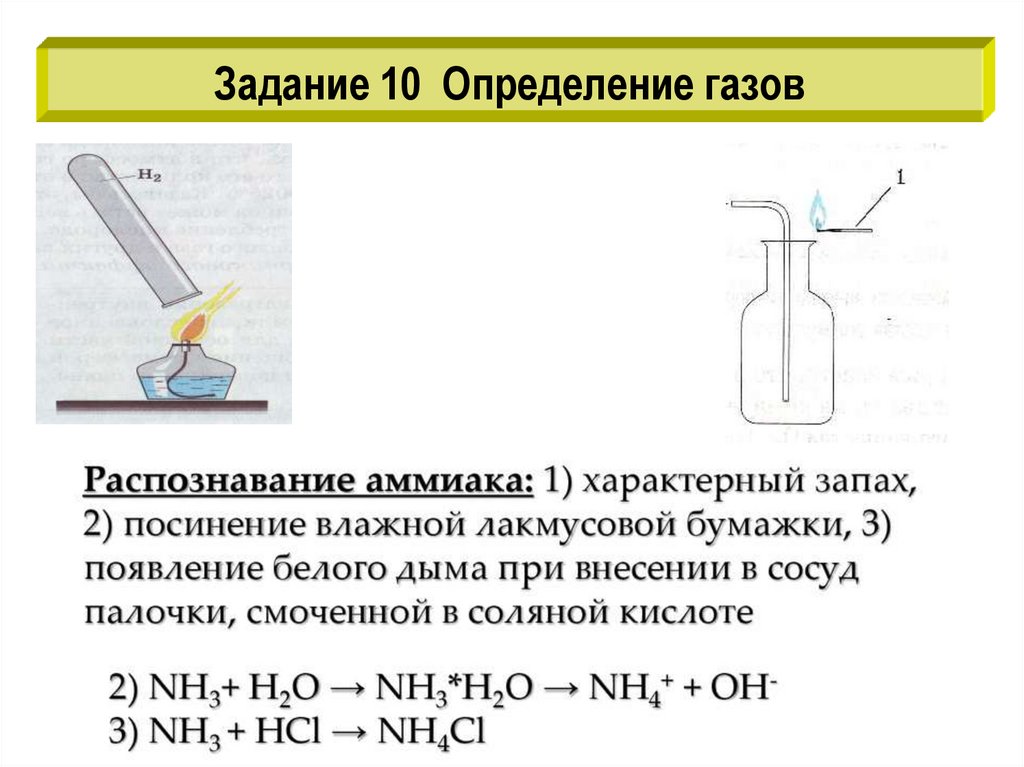
Задание 10 Определение газов13.
Задание 10 Определение газов14.
Домашнее задание: подготовиться к итоговойконтрольной работе
1. Поработайте с параграфами учебника
39-41.Пройдите в тестах «Проверь свои
знания» задания : 1,5 стр.207, 8 стр.208. 3
стр.211,1-5 стр.216-217
2.Повторите алгоритм задачи







 Химия
Химия








