Похожие презентации:
Ферменты. Структура и функция
1.
ФЕРМЕНТЫСТРУКТУРА И
ФУНКЦИЯ
2.
ФЕРМЕНТЫ (энзимы)- специализированные биокатализаторыбелковой природы, используемые для осуществления с высокой
скоростью различных химических реакций
КИРХГОФ
Константин
Сигизмундович
(1764 –1833)
русский химик
1814г.- показано, что солод
ячменя вызывает
брожение крахмала
Джеймс Бэчеллер Самнер
(1887–1955)
американский химик
1926- очищен и выделен
фермент уреаза
Слово ≪фермент≫ происходит от слова ≪fermentatio≫ - брожение, а энзим – от
≪enzyme≫, что означает закваска в дрожжах.
3.
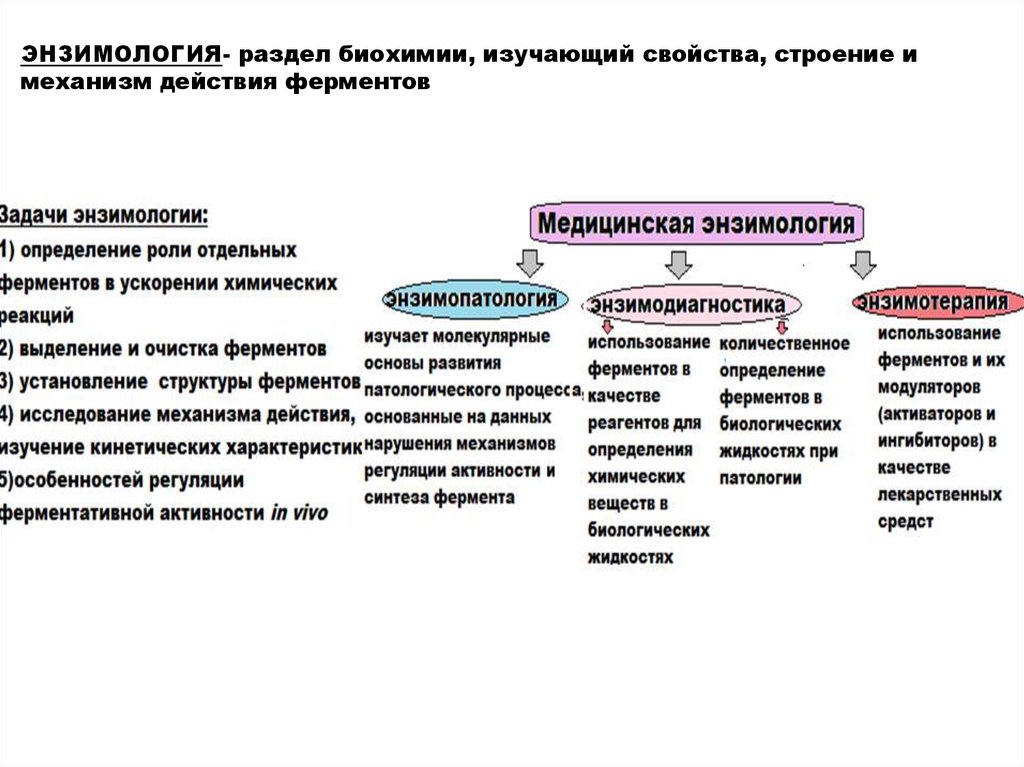
ЭНЗИМОЛОГИЯ- раздел биохимии, изучающий свойства, строение имеханизм действия ферментов
4.
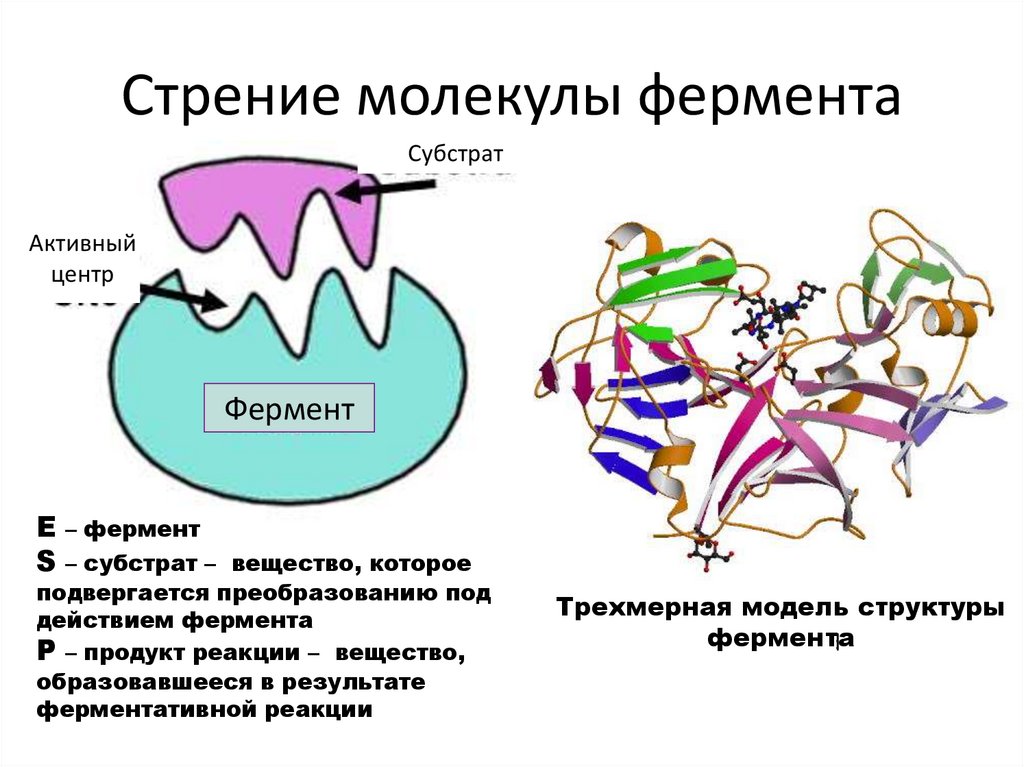
Стрение молекулы ферментаСубстрат
Активный
центр
Фермент
Е – фермент
S – субстрат –
вещество, которое
подвергается преобразованию под
Трехмерная
модель
The main part of the enzyme
molecule is called
the структуры
действием фермента
site, which is the site of substrateфермента
binding and
Р – продукт реакцииactive
– вещество,
catalysis. It is in a cleft, crevice, or cavity in the
образовавшееся в результате
enzyme molecule.
ферментативной реакции
5.
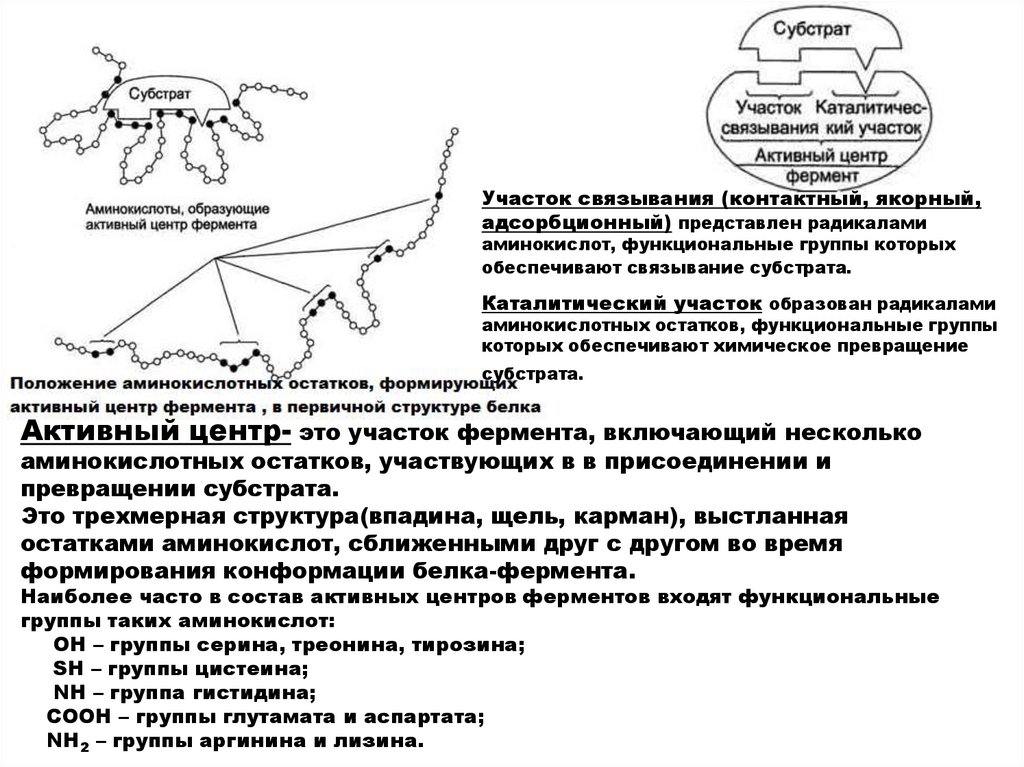
Участок связывания (контактный, якорный,адсорбционный) представлен радикалами
аминокислот, функциональные группы которых
обеспечивают связывание субстрата.
Каталитический участок образован радикалами
аминокислотных остатков, функциональные группы
которых обеспечивают химическое превращение
субстрата.
Активный центр- это участок фермента, включающий несколько
аминокислотных остатков, участвующих в в присоединении и
превращении субстрата.
Это трехмерная структура(впадина, щель, карман), выстланная
остатками аминокислот, сближенными друг с другом во время
формирования конформации белка-фермента.
Наиболее часто в состав активных центров ферментов входят функциональные
группы таких аминокислот:
ОН – группы серина, треонина, тирозина;
SН – группы цистеина;
NН – группа гистидина;
СООН – группы глутамата и аспартата;
NН2 – группы аргинина и лизина.
6.
Каталитическое действие ферментаЭтапы ферментативного катализа. I - этап сближения и ориентации
субстрата относительно активного центра фермента; II - образование
фермент-субстратного комплекса (ES) в результате индуцированного
соответствия; III - деформация субстрата и образование нестабильного
комплекса фермент-продукт (ЕР); IV- распад комплекса (ЕР) с
высвобождением продуктов реакции из активного центра фермента и
освобождением фермента.
7.
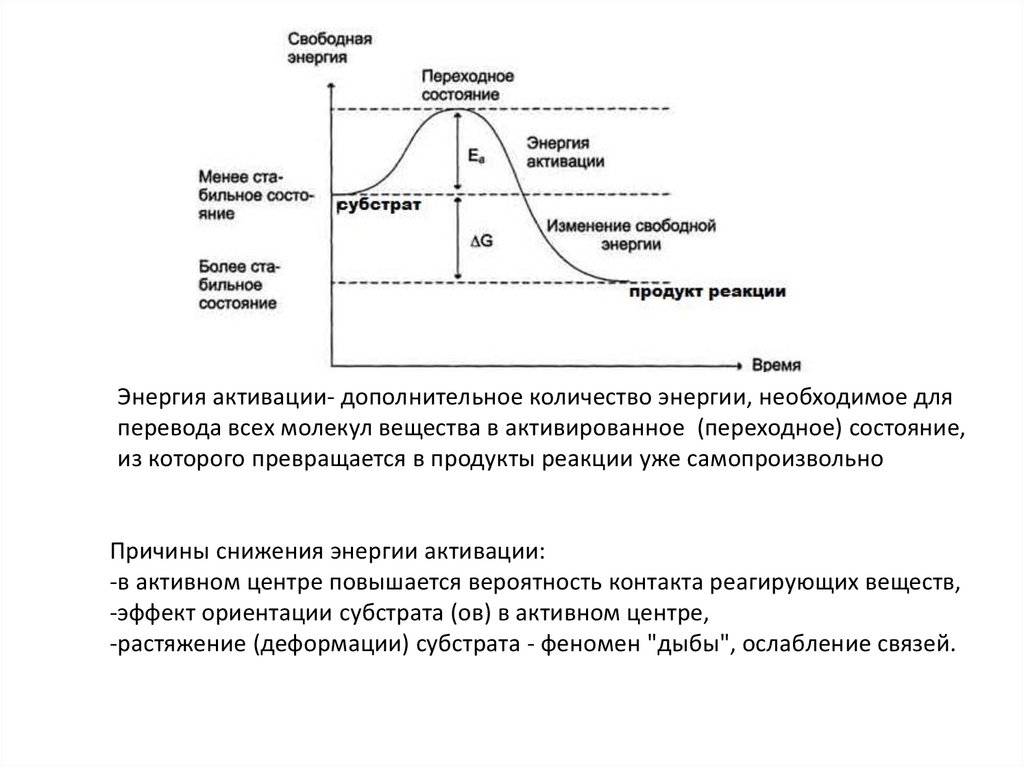
Энергия активации- дополнительное количество энергии, необходимое дляперевода всех молекул вещества в активированное (переходное) состояние,
из которого превращается в продукты реакции уже самопроизвольно
Причины снижения энергии активации:
-в активном центре повышается вероятность контакта реагирующих веществ,
-эффект ориентации субстрата (ов) в активном центре,
-растяжение (деформации) субстрата - феномен "дыбы", ослабление связей.
8.
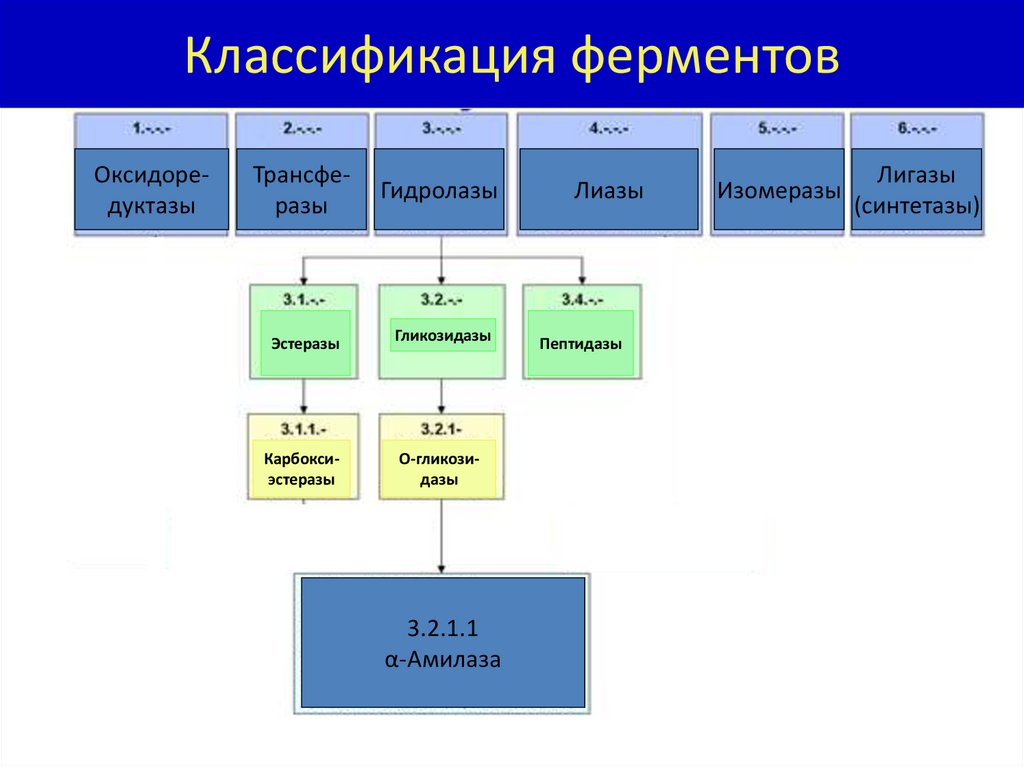
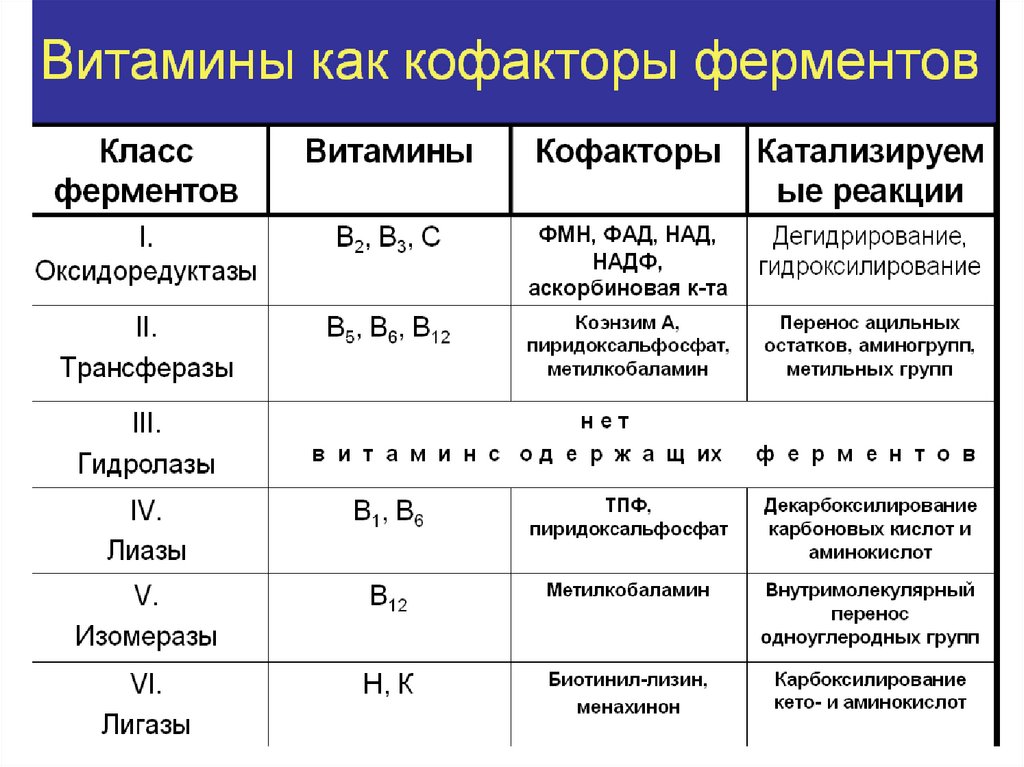
Классификация ферментовОксидоредуктазы
Трансферазы
Гидролазы
Эстеразы
Гликозидазы
Карбоксиэстеразы
О-гликозидазы
3.2.1.1
α-Амилаза
Лиазы
Пептидазы
Изомеразы
Лигазы
(синтетазы)
9.
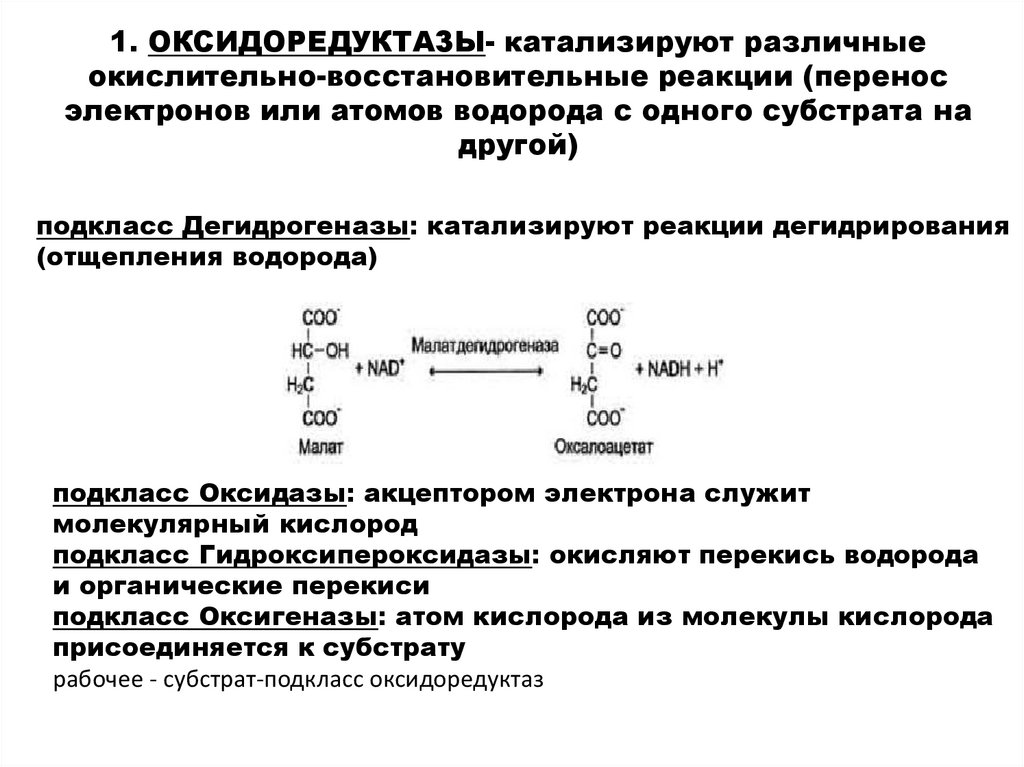
1. ОКСИДОРЕДУКТАЗЫ- катализируют различныеокислительно-восстановительные реакции (перенос
электронов или атомов водорода с одного субстрата на
другой)
подкласс Дегидрогеназы: катализируют реакции дегидрирования
(отщепления водорода)
подкласс Оксидазы: акцептором электрона служит
молекулярный кислород
подкласс Гидроксипероксидазы: окисляют перекись водорода
и органические перекиси
подкласс Оксигеназы: атом кислорода из молекулы кислорода
присоединяется к субстрату
рабочее - субстрат-подкласс оксидоредуктаз
10.
2. ТРАНСФЕРАЗЫ- катализируют реакции переносафункциональных групп от одного соединения к другому
Подразделяют в зависимости от переносимой группы:
аминотрансферазы, ацилтрансферазы, метилтрансферазы,
гликозилтрансферазы, киназы (фосфотрансферазы).
Название этих ферментов составляют по формуле
"донор: ацептор- переносимая группа- трансфераза".
11.
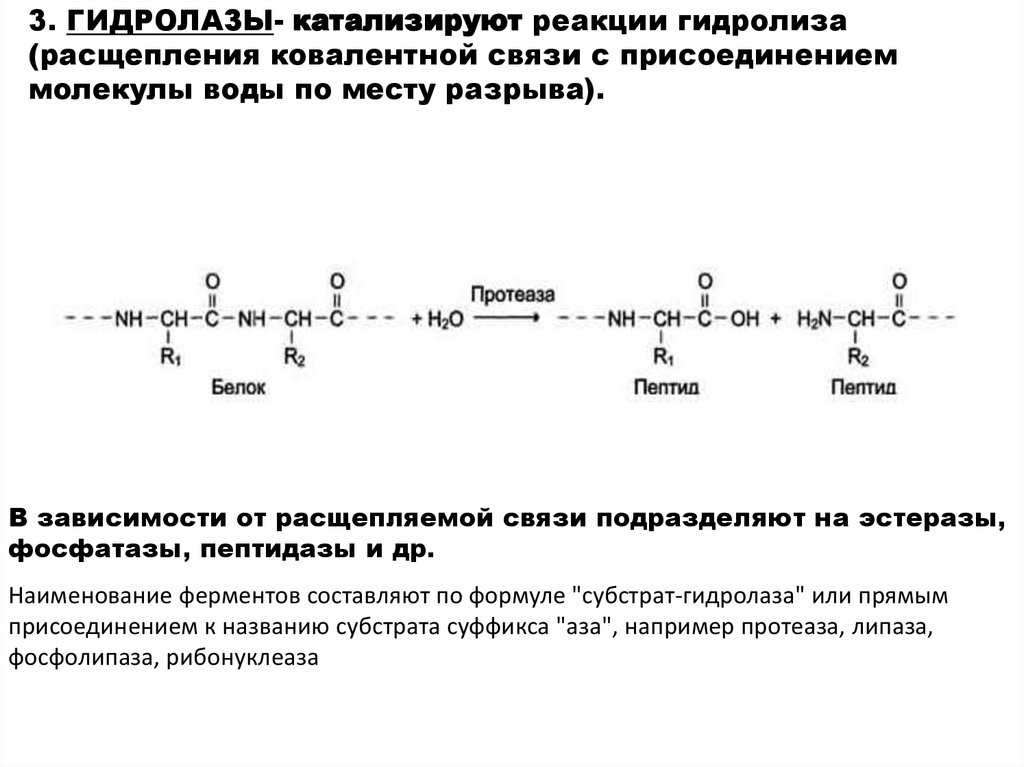
3. ГИДРОЛАЗЫ- катализируют реакции гидролиза(расщепления ковалентной связи с присоединением
молекулы воды по месту разрыва).
В зависимости от расщепляемой связи подразделяют на эстеразы,
фосфатазы, пептидазы и др.
Наименование ферментов составляют по формуле "субстрат-гидролаза" или прямым
присоединением к названию субстрата суффикса "аза", например протеаза, липаза,
фосфолипаза, рибонуклеаза
12.
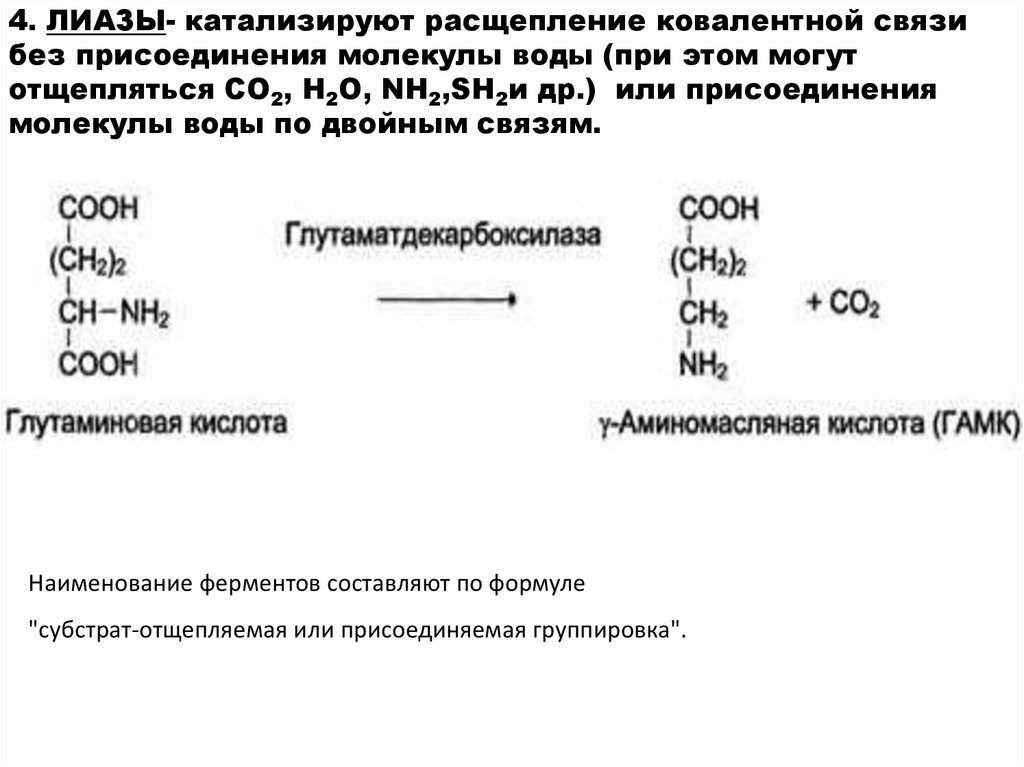
4. ЛИАЗЫ- катализируют расщепление ковалентной связибез присоединения молекулы воды (при этом могут
отщепляться СО2, Н2О, NH2,SН2и др.) или присоединения
молекулы воды по двойным связям.
Наименование ферментов составляют по формуле
"субстрат-отщепляемая или присоединяемая группировка".
13.
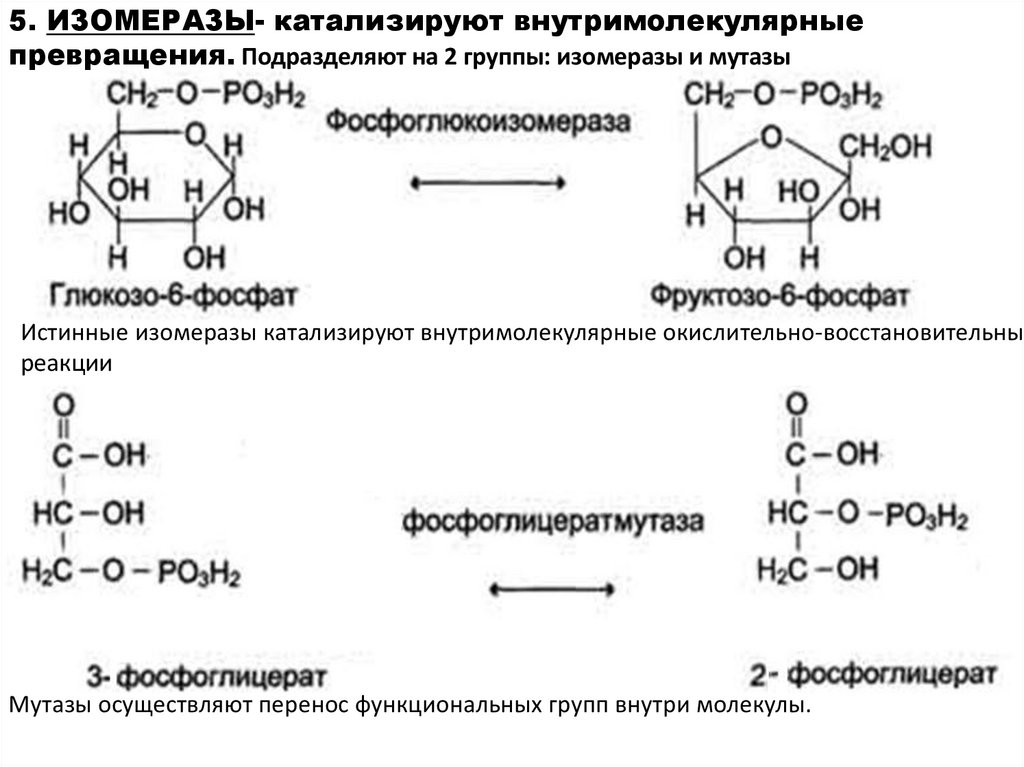
5. ИЗОМЕРАЗЫ- катализируют внутримолекулярныепревращения. Подразделяют на 2 группы: изомеразы и мутазы
Истинные изомеразы катализируют внутримолекулярные окислительно-восстановительные
реакции
Мутазы осуществляют перенос функциональных групп внутри молекулы.
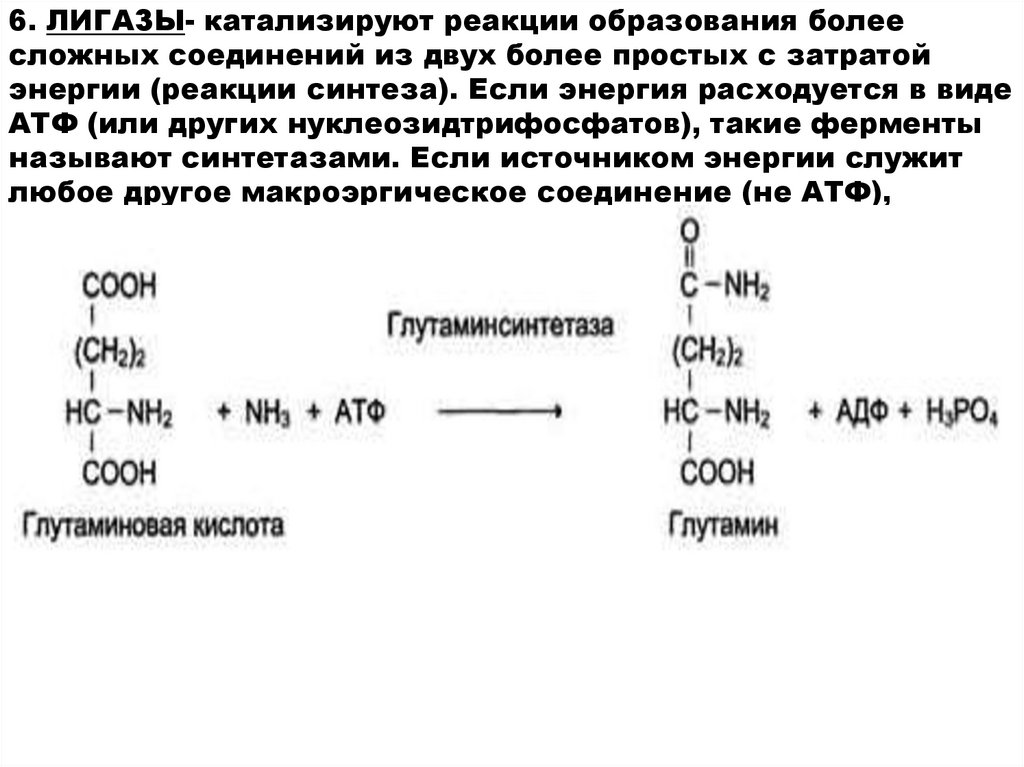
14.
6. ЛИГАЗЫ- катализируют реакции образования болеесложных соединений из двух более простых с затратой
энергии (реакции синтеза). Если энергия расходуется в виде
АТФ (или других нуклеозидтрифосфатов), такие ферменты
называют синтетазами. Если источником энергии служит
любое другое макроэргическое соединение (не АТФ),
ферменты называют синтазами
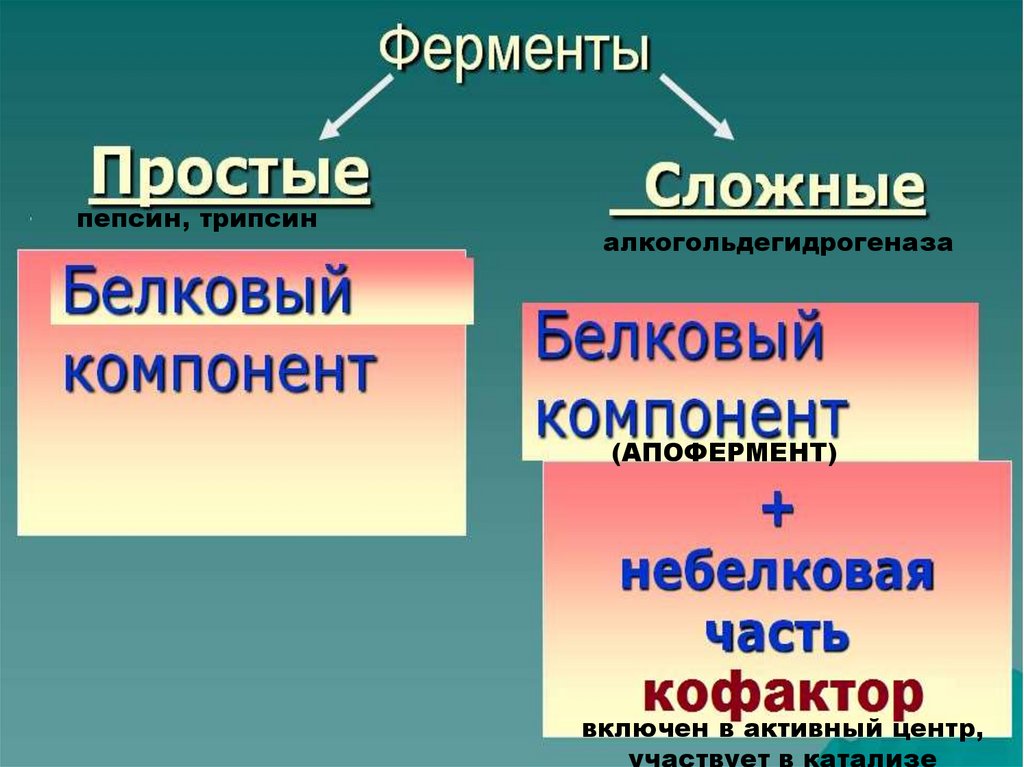
15.
пепсин, трипсиналкогольдегидрогеназа
(АПОФЕРМЕНТ)
включен в активный центр,
участвует в катализе
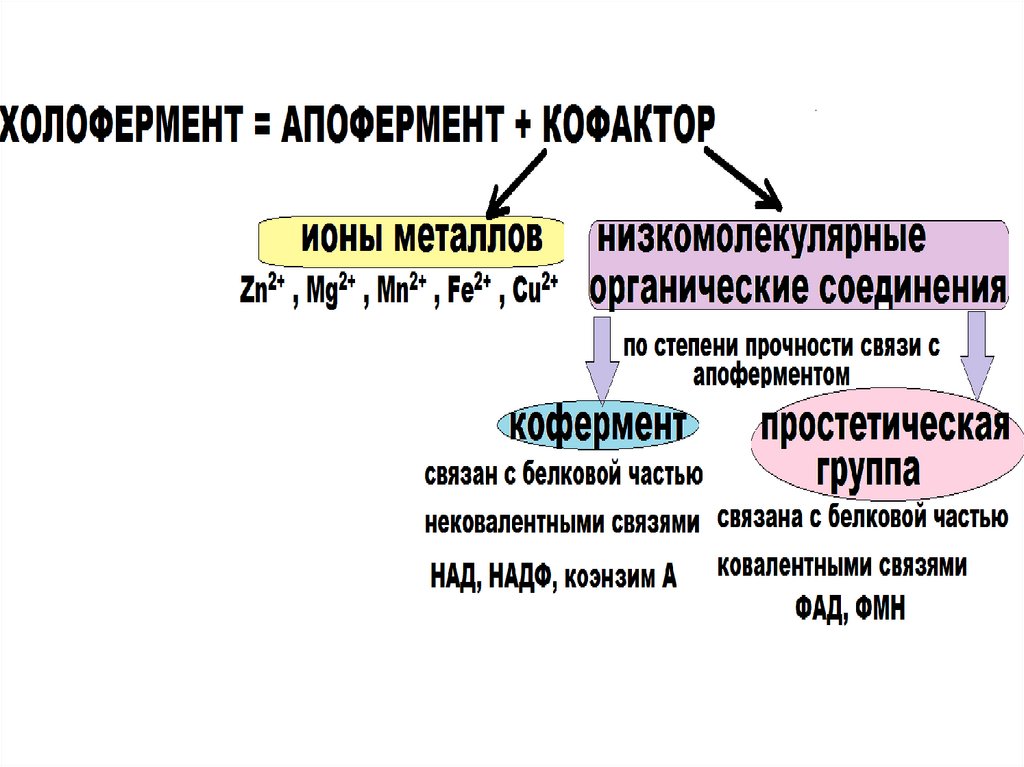
16.
РОЛЬ АПОФЕРМЕНТА1) определяет
специфичность
фермента
2) отвечает за выбор
типа химического
превращения
субстрата
РОЛЬ КОФАКТОРА :
1) Способствует
формированию третичной
структуры белка, обеспечивает
комплементарность между
ферментом и субстратом;
2) принимает
непосредственное участие в
реакции в качестве
косубстрата.
17.
18.
19.
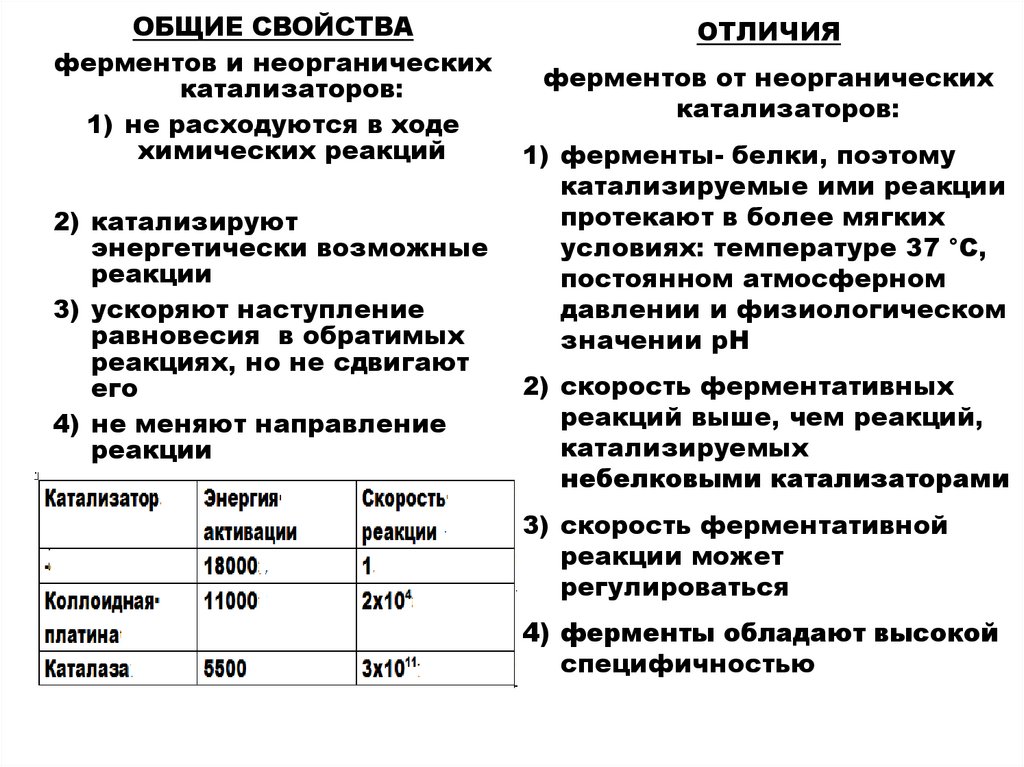
ОБЩИЕ СВОЙСТВАферментов и неорганических
катализаторов:
1) не расходуются в ходе
химических реакций
2) катализируют
энергетически возможные
реакции
3) ускоряют наступление
равновесия в обратимых
реакциях, но не сдвигают
его
4) не меняют направление
реакции
ОТЛИЧИЯ
ферментов от неорганических
катализаторов:
1) ферменты- белки, поэтому
катализируемые ими реакции
протекают в более мягких
условиях: температуре 37 °С,
постоянном атмосферном
давлении и физиологическом
значении рН
2) скорость ферментативных
реакций выше, чем реакций,
катализируемых
небелковыми катализаторами
3) скорость ферментативной
реакции может
регулироваться
4) ферменты обладают высокой
специфичностью
20.
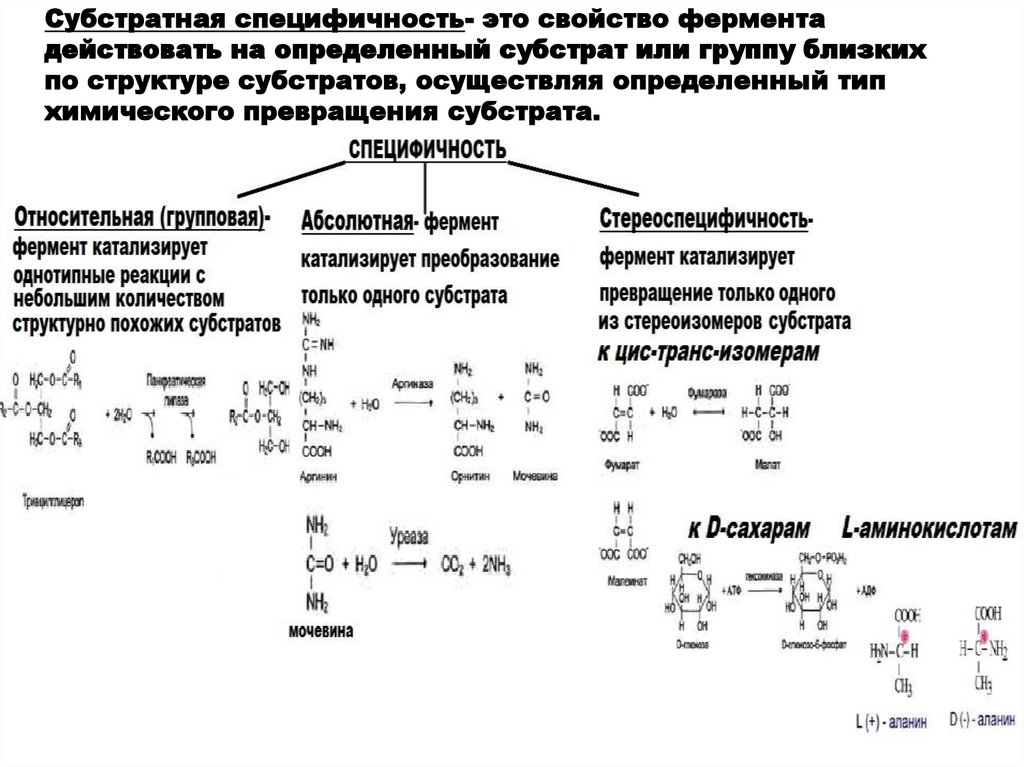
Субстратная специфичность- это свойство ферментадействовать на определенный субстрат или группу близких
по структуре субстратов, осуществляя определенный тип
химического превращения субстрата.
21.
Механизм kinetics.действия ферментов.
Теория ключаtheory.
и замка
Enzyme
“lock-and-Key”
По теории Фишера активный центр фермента
жестко соответствует конфигурации субстрата
и не изменяется при его присоединении.
Эмиль Герман Фишер
(1852-1919)
немецкий химик-органик,
лауреат Нобелевской
премии по химии 1902 г.
22.
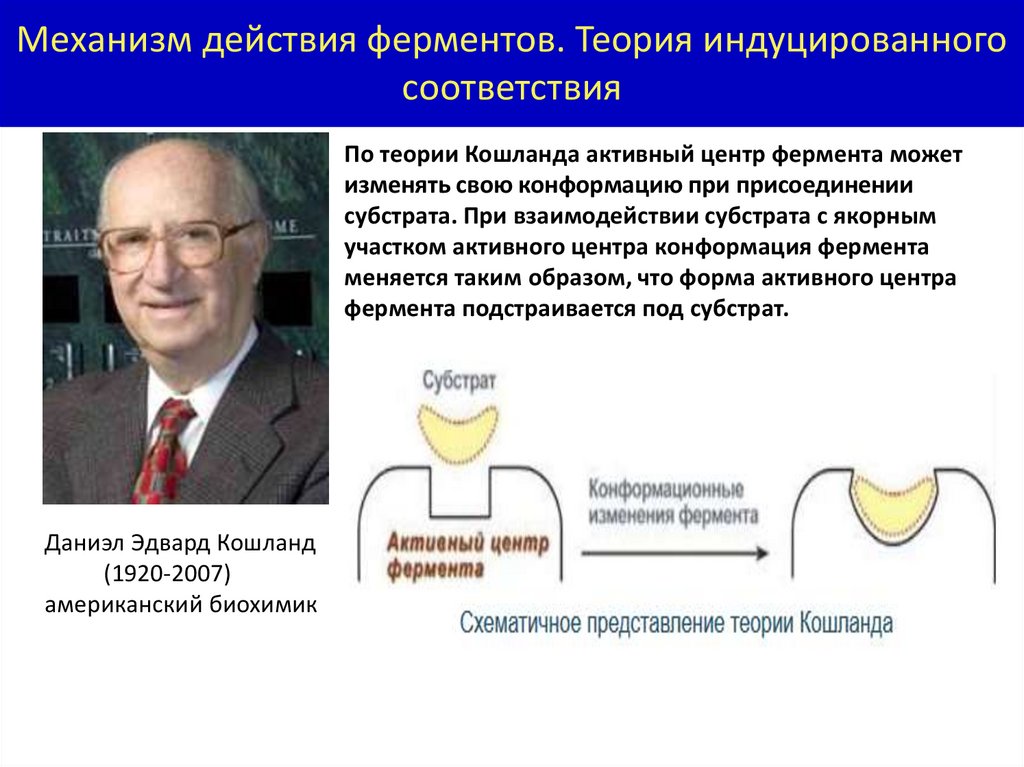
Механизм действия ферментов. Теория индуцированногосоответствия
По теории Кошланда активный центр фермента может
изменять свою конформацию при присоединении
субстрата. При взаимодействии субстрата с якорным
участком активного центра конформация фермента
меняется таким образом, что форма активного центра
фермента подстраивается под субстрат.
Даниэл Эдвард Кошланд
(1920-2007)
американский биохимик
23.
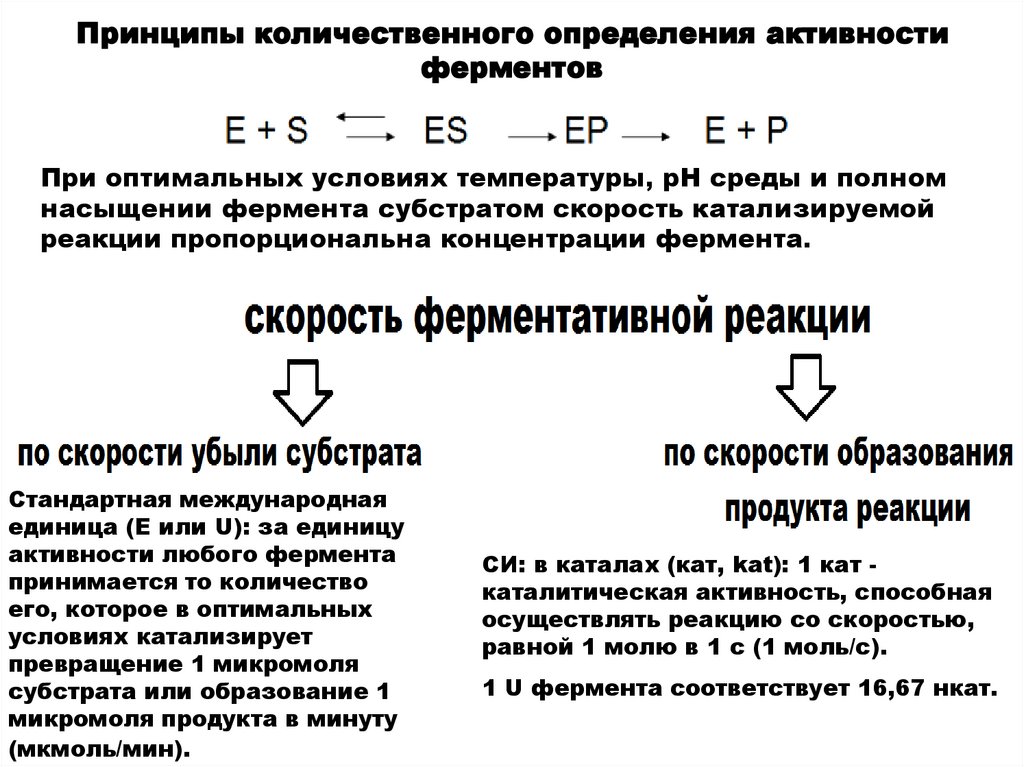
Принципы количественного определения активностиферментов
При оптимальных условиях температуры, рН среды и полном
насыщении фермента субстратом скорость катализируемой
реакции пропорциональна концентрации фермента.
Стандартная международная
единица (Е или U): за единицу
активности любого фермента
принимается то количество
его, которое в оптимальных
условиях катализирует
превращение 1 микромоля
субстрата или образование 1
микромоля продукта в минуту
(мкмоль/мин).
СИ: в каталах (кат, kat): 1 кат каталитическая активность, способная
осуществлять реакцию со скоростью,
равной 1 молю в 1 с (1 моль/с).
1 U фермента соответствует 16,67 нкат.
24.
Мультиферментныекомплексыэто
надмолекулярные
образования, которые включают, несколько ферментов,
соединенных нековалентными связями, катализирующие
последовательные превращения одного субстрата.
Пируватдегидрогеназный комплекс включает три фермента: пируватдегидрогеназу,
дигидролипоилтрансацетилазу и дигидролипоилдегидрогеназу.
Биологическое значение мультиферментных комплексов состоит в том, что благодаря их
существованию облегчается перенос реагирующих веществ между отдельными
ферментами, что ускоряет протекание реакций.
Полифункциональные ферменты обладают несколькими
энзиматическими активностями, но состоят из одной
полипептидной цепи.
Полипептидная цепь полифункционального фермента при формировании третичной
структуры образует несколько функционально и стерически обособленных глобулярных
участков — доменов, каждый из которых характеризуется своей каталитической
активностью.








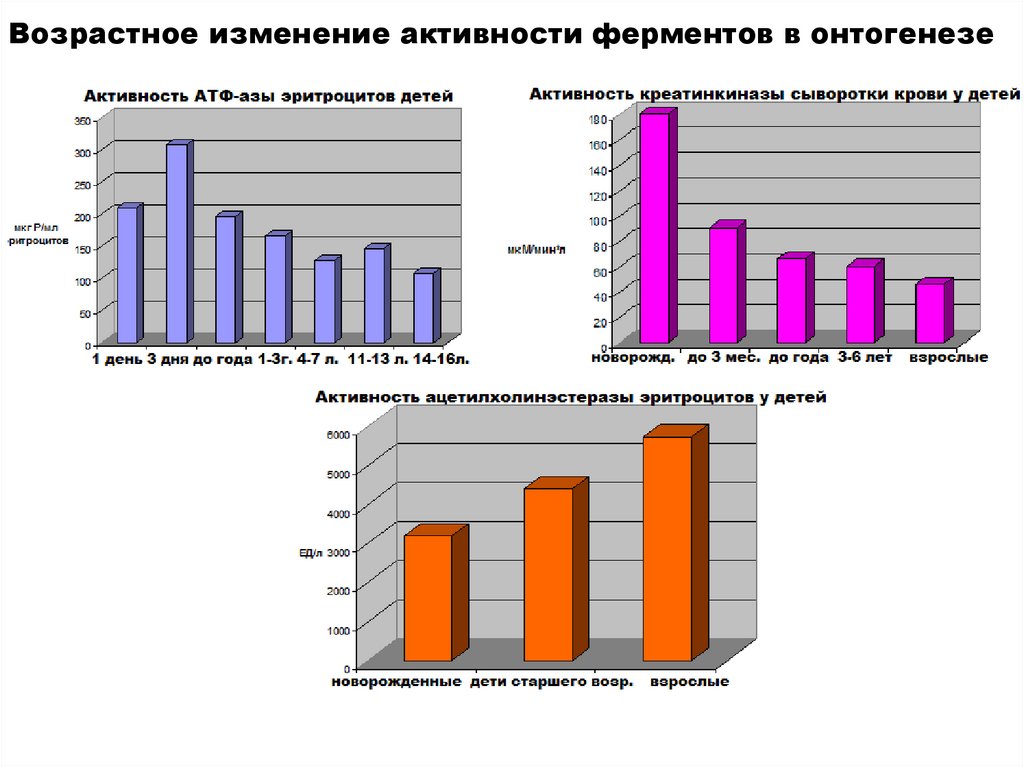
 Биология
Биология








