Похожие презентации:
Сопутствующие явления. Диффузия
1.
Лекция 9СОПУТСТВУЮЩИЕ ЯВЛЕНИЯ
Диффузия
2.
ДИФФУЗИЯ – КОНТРОЛИРУЮЩАЯ СТАДИЯ ГЕТЕРОГЕННОГО ПРОЦЕССАБольшинство процессов в конденсированных системах являются гетерогенными, т.е.
происходят в различных соприкасающихся фазах, отделенных друг от друга поверхностью
раздела. Кинетика гетерогенных реакций, т.е. реакций, протекающих на границе раздела фаз,
боле сложна, так как их «элементарными» стадиями являются диффузионные перемещения
реагентов и продуктов.
Процессом диффузии и сопутствующими явлениями (адсорбцией, объемными реакциями и
др.) в значительной степени определяется реальное распределение элементов, химических
соединений и фаз, обеспечивающих то или иное распределение физических свойств
сложных материалов, при обработке поверхностей и нанесении покрытий. Очевидно, что
обработка поверхности любым из известных технологических способов - очень сложный
процесс, который на данном этапе исследования не может быть описан ни одной из
известных до сих пор моделей. Роль диффузии и ее механизмы в таких условиях весьма
разнообразны.
Несмотря на сложность и взаимообусловленность различных физико-химических процессов,
наблюдающихся при химико-термической обработке поверхностей и нанесении покрытий,
качественное представление о возможном распределении легирующих элементов в
поверхностном слое можно получить на основе достаточно простых моделей, в которых
анализируются различные физические ситуации.
3.
Характерной особенностью гетерогенных процессов является их многостадийность. Наиболеетипична ситуация, когда гетерогенный процесс в двух соприкасающихся фазах включает три
стадии: диффузионный подвод вещества к границе раздела фаз, химическую реакцию (или
адсорбцию) на границе раздела и отвод продуктов превращения (тоже, как правило,
диффузионный).
Что мы знаем о диффузии?
Закон Фика
J D C
C
J D C
t
C
2C
D 2
t
x
Обобщенный закон Фика
n 1
D C
Jk
kl
l
l 1
Dkl
- Парциальные коэффициенты диффузии
4.
Пример 1В материале кислород изначально отсутствует. В окружающей среде всегда
имеется. Концентрация задана и не изменяется.
C
2C
D 2
t
x
x 0:
x
Начальное условие:
x
C x ,t C0 erfc
2 Dt
C 0,t C0
D
C
0
x
(1)
или C 0
C x ,0 0
Л.5
С
Dt
2
Fo
L
Fo=1. - 0,1
2. - 0,2
3. - 0.5
4. - 1.0
5. - 3.0
0,9
0,6
5
2
2
erfc z
exp
x
dx
z
С erfc
2 Fo
0,3
1
2 3
4
0,0
0,0
1,5
3,0
4,5
5.
Пример 2Материал+тонкое покрытие. Свойства покрытия и характер переходной зоны
между двумя материалами определяются, в основном, концентрацией одного
элемента, например, углерода.
C
2C
D 2
t
x
x 0:
D
C
C
h 1
x
t
x :
или C1 0 C0
D
(2)
C
0
x
C x ,0 0
Точное аналитическое
решение
x
Dt
x D
C C0 exp 2 t erfc
2 Dt
h h
h
(3)
6.
Учтем сток элемента из тонкого слоя в окружающую среду, что можетбыть связано, например, с летучестью рассматриваемого элемента.
В этом случае вместо условия (2) имеем
x 0: D
0,8
0,8
C
C
0,6 1
0,6
0,4
0,4
C
C
h 1 C1 Ce
x
t
h
Sh
D
1
2
отношение скоростей
внешней и внутренней
диффузии.= Критерий
Шервуда
2
3
0,2
0,2
3
4
0,0
4
0,0
0
2
4
6
8
10
0
C1 0 C0
2
4
6
8
10
Распределение концентрации диффундирующего элемента в
поверхностном слое обрабатываемого материала без учета (γ=0, а) и с
учетом (γ=0.25, б) потерь массы в окружающую среду
7.
Пример 3Простейшая задача о насыщении бинарной смеси (сплава) третьим компонентом
C1
C1
2C1
2C2
D11
D12
,
2
2
t
x
x
C2 C3
C2
2C1
2C2
D21
D22
,
2
2
t
x
x
C
C
x 0 : C1 C10 ; J 2 D21 1 D22 2 0
x
x
x : J 2 0; t 0 : C1 0; C2 0,5
x
C1 C2 C3 1
0,72
C1
12 3 4 5 6
C2
0,24
7
0,70
0,16
0,08
2
3
4
5
7
6
0,68
0,66
x,cm
1
0,00
0,0
-5
4,0x10
-5
8,0x10
0,0
x,cm
-5
3,0x10
-5
6,0x10
-5
9,0x10
D11 2,5 10 8 , D12 10 8 , D21 7,0 10 9 , D22 1,5 10 8 см2/с
Коэффициенты диффузии выбраны таким образом, чтобы проиллюстрировать
нелинейный характер взаимодействия потоков.
t 1. 2 ,5 10 5 ;2. 5 10 4 ;3. 1,5 10 3 ;4. 3,5 10 3 ;5. 7 ,5 10 3 ;
6. 1,25 10 2 ;7. 2 ,25 10 2
с
8.
ВОЗМОЖНЫЕ МЕХАНИЗМЫ ДИФФУЗИИ В КРИСТАЛЛАХ2
1
4
5
3
6
1.вакансионный; 2.простой межузельный; 3.циклический обменный;
4.межузельный механизм вытеснения; 5.краудионный; 6.простой обменный
9.
Диффузия в объеме и по границам зеренМетод количественной оценки диффузии по границам зерен был впервые
предложен Фишером (1951), а затем уточнялся и развивался в ряде
других работ. Принципиально модель с тех пор не изменилась.
Модель Фишера
C C0 const
D
Db
x
Db D
Поверхность, на которую нанесен диффузант,
перпендикулярна к границе зерна.
y Законы диффузии справедливы как в объеме, так и
вдоль границы
Коэффициенты диффузии - постоянные
Поток диффузанта непрерывен на границе раздела
зерен и кристалла
Толщина границы мала, так что изменением
концентрации по толщине границы можно пренебречь
10.
2C 2CC
, y
D
x 2 y 2
t
2
C C0 const
y
D
Db
Db D
2Cb 2Cb
Cb
, y
Db
x 2
t
2
y 2
Cb
2Cb 2 D C
Db
2
t
y y 0 2
x
Толстое покрытие:
C t , x 0, y C0
t 0 : C 0, Cb 0
R
R
- характерный размер зерна
h Dt 1 2
11.
Классификация режимов диффузии:Идея состоит в том, что диффузионный процесс можно разложить на
несколько элементарных процессов: движение атома вдоль границы
(собственно граничная диффузия), утечка атомов в приграничный объем
и диффузия в объеме, причем как в горизонтальном, так и в
вертикальном направлениях. В зависимости от скоростей тех или иных
стадий различают различные режимы диффузии.
Для диффузии примеси в чистом металле принимается Cb SC t , x, y 2
S
- коэффициент распределения
Модели иного типа: граница зерна рассматривается как фаза со
своими термодинамическими свойствами, отделенная от объема
«стенкой» - поверхностью, на которой скачком меняется подвижность
атомов примеси и растворителя. Распределение примеси между границей
и объемом не является термодинамически равновесным. Из-за большой
разности подвижностей примесь не успевает «уходить» в объем, что
приводит к появлению давления, аналогичного осмотическому давлению
в растворе. Оно зависит от растворимости в объеме и на границе,
соотношения коэффициентов диффузии, времени.
12.
Реальныйполикристалл
Различные варианты аналитических моделей
диффузии по границам зерен
13.
Не смотря на то, что границы фаз по своей структуре и природе болееразнообразны, чем границы зерен (могут возникать при эвтектическом,
полиморфном превращениях, при распаде пересыщенного раствора, в
сильно неравновесных условиях и т.д.), модель Фишера можно легко
«модифицировать» и на этот случай. Тогда в каждой из фаз будет
справедливо уравнение Фика со своим коэффициентом диффузии.
2Ci 2Ci
Ci
Di
2
2
t
y
x
В этом случае в модели с идеальной границей симметрия нарушается
Эффективный коэффициент диффузии:
D2
1 D1
D
2 S1
S2
Если на диаграмме состояния двух элементов есть промежуточные
фазы, то в диффузионной паре могут образовываться и расти слои
промежуточных фаз. Задачи такого типа применительно к объемной
диффузии впервые рассмотрел Вагнер. Вследствие высокой скорости
граничной диффузии промежуточные фазы будут возникать, в первую
очередь, на границе, искажая концентрационные профили.
12
12
12
14.
Диффузия и химические реакцииС1 1 С2 С
C
2C
D 2 kCС1
t
x
Для малой концентрации
примеси С и
соответственно малой
концентрации продукта
реакции
C2
kCС1
t
C2 0 , x 0; C 0, x 0
C
hC0
exp
hp D p k1
w kC1C k C
p k1
x
D
0,8
C
0,6
1
C C0
p k1 p k1 D h
hk1
h p k
1
exp
2
p k1 D h
1
1
0,4
p k1
x
D
2
0,2
3
0,0
0
(Решение громоздкое, не выписываем)
2
4
6
8
15.
Если процесс протекает в несколько последовательных стадий, то суммарная скоростьпроцесса определяется его медленной стадией, которая является контролирующей.
x 0
C
2C
D1
t
x 2
(внешняя область)
коэффициент
диффузии во
внешней области
осуществляется
диффузионный подвод
вещества к поверхности
x 0
Примем, что в слое толщиной , прилегающем к поверхности , установилось стационарное
состояние
C , t C 0
C 0, t C
На поверхности происходит химическая реакция первого порядка со скоростью
kC
В стационарном состоянии все количество вещества, приходящее в единицу объема у
поверхности в единицу времени полностью тратится в реакции, что отражает равенство
коэффициент массоотдачи,
величина которого
определяется величиной
коэффициента диффузии (или
иным механизмом переноса)
во внешней области
kC C 0 C
скорость гетерогенного
процесса есть
C
C 0
k
kC0
k
Процесс может протекать по-разному в зависимости
от того, какая стадия является медленной
16.
Если медленным является подвод вещества к поверхности , тоk
C C 0
C 0
т.е. скорость суммарного процесса определяется коэффициентом массопередачи или
коэффициентом внешней диффузии. Говорят, что процесс контролируется внешней
диффузией или находится во внешнедиффузионной области
Если медленной является химическая реакция на поверхности, то
k
C C0
kC0
т.е. скорость суммарного процесса определяется скоростью химической реакции. Говорят, что
процесс находится в кинетической области
ИЗМЕНИМ ЗАДАЧУ, добавив диффузию во внутренней области с коэффициентом диффузии D ,
причем полагаем, что реакция может происходить во всей внутренней области, а не только на
поверхности раздела. Следовательно, реакция и диффузия во внутренней области происходят
параллельно, а в случае параллельных процессов суммарная скорость определяется
быстрой стадией. По отношению к внешней диффузии оба процесса являются
последовательными.
С учетом химической реакции уравнение, описывающее изменение концентрации во внутренней
области, имеет вид
C
2C
D 2 kC
t
x
(Имеет место прежнее
приближение малых
концентраций)
17.
Решение этого уравнения для стационарного состоянияC , t 0
имеет вид
C
0
t
учетом условий
C 0,t C
k
C C exp
x
D
D k
Глубина диффузии
Суммарная скорость процесса определяется потоком через единицу поверхности
Jx 0 D
C
x
C Dk C
x 0
D
Следовательно, эффективный коэффициент k eff , характеризующий скорость процесса по
уравнению kC , есть
keff Dk D ,
а эффективная энергия активации равна полусумме энергий активации диффузии во
внутренней области и химической реакции
Приравнивая внутренний поток потоку из внешней области (т.е. полагая, сколько вещества
подводится к поверхности , столько же перерабатывается во внутренней области), найдем
C0 C C Dk
18.
Следовательно, концентрация на поверхности раздела естьC
C 0
Dk
Поток через поверхность раздела, характеризующий суммарную скорость процесса, есть
J x 0 C Dk
C 0 Dk
Dk
Отсюда находим эффективный коэффициент диффузии
Deff
D k
Dk
Dk
D
D
Процесс опять протекает по-разному в зависимости от того, какая стадия является медленной.
Если медленным является подвод вещества к границе раздела, то процесс контролирует
внешняя диффузия
Dk
C C 0
J x 0 C0
Если медленным является процесс во внутренней области, то справедлива оценка
Dk
D
C C0
J x 0 C0 Dk C0 D
19.
Здесь важно соотношение между константами внутренней диффузии и реакции. Введемхарактерный геометрический размер для внутренней области, это может быть, например,
размер зерна d
k D d 2
медленной является химическая реакция, то d и в зерне практически
отсутствует градиент концентрации
k D d 2
химическая реакция «поедает» все вещество практически на поверхности.
Задача на дом
Найти решение задачи. Подумать, к какой ситуации задача
может иметь отношение? Чего в ней не хватает, на Ваш
взгляд?
D
Сe
w kC
0
СS
x
d 2C
2
kC 0
dx
x 0:
Сe
x h : СS
20.
Задачи о росте новых фаз(реакционная диффузия)
Теория Вагнера
Окисление металла, растворением кислорода в
металле пренебрегаем
Скорость реакции - высокая
C1
C C
*
D
, D D g
t x x
x 0 : C C1;
C2
x t
x : C C2 ;
На подвижной границе весь кислород идет на образование оксида со
скоростью
C
d
D
C2
x x
dt
2a Dt
Задачу решаем аналогично задачам о кристаллизации
C1 C2
C2
a exp a 2 a
21.
Пусть часть диффундирующего компонента переходит в растворC11
C1 C1
D1
,0 x
t x
x
C12
C21
C22
x t
x
C2 C2
D2
, x
t
x
x
t 0 : C2 C22 , x 0
x 0 : C1 C11
x : C1 C12 , C2 C21 , C12 C21
d
C
C
D2 2 D1 1
dt
x
x
2a D1t
x
C1 A1 Bi
2 Dit
22.
Разные задачиОкисление с диффузией по границам и в объеме
Окисление металлов – это реакция между металлом и кислородом
Ti+O2
TiO, TiO2 , Ti2O3
b
aMe O2 Mea Ob
2
Реакционный механизм может быть очень сложным и зависит от
многих факторов; одна из важнейших стадий - диффузия
TiO, TiO2; ZrO, ZrO2
«подобные» процессы: азотирование, науглероживание сталей;
наводороживание; эрозия
23.
Модель Фишераy
free surface
DV
Db
2H
x
L
2h
24.
T , k скорость реакцииy
h+H
H
h
0
D
C
A
при низкой температуре
B
L
L+2h
2(L+h)
x
Db
1
DV
Ti O TiO
или
Ti O2 TiO2
/ h 1
ox ox ox
D
D
,
t
x x x x
d p
k Me ox ,
dt
ox
x 0 : ox 0 ; x :
0;
x
ox
y 0, y h :
0,
y
25.
oxox
D
X X Y
d p
d
Me ox ,
ox
0;
X
ox 0 ; x :
X 0:
Y 0, y 1 H :
k 2
;
DV
ox
D Y ,
ox
0,
Y
- скорость реакции одинакова в объем и в граничной фазе
коэффициент диффузии D равен либо 1 (в граничной фазе), либо
Полуширина граничной фазы всегда =1
H
h
размер зерна
grain boundary
Y
10.00
grain volume
5.00
0.00
0.00
5.00
10.00
15.00
20.00
25.00
30.00 X
Db DV
26.
20;H 10;
0
boundary grain
Y
8.0
4.0
0.0
0.0
grain
5.0
10.0
15.0
20.0
25.0
30.0 X
Вследствие неоднородной структуры
наблюдается неравномерное
«заполнение» зеренной и граничной
фаз кислородом.
ox
ox
0,20
0,20
Y=0
Y=6
0,15
0,15
0,10
0,05
1
2
6
45
0,10
3
0,05
6
5
123 4
0,00
0,00
0
5
10
15
20
ox
0,18
4
25
X=1
ox
6
0,15
5
10
15
20
25
30 X
X=2
6
5
5
4
3
0,15
0
30 X
0,12
3
2
2
1
0,12
0
0,09
2
4
6
8
10 Y
1
0
2
4
6
8
10
27.
0.2010
10
5
5
0.18
0.16
0.14
0.12
0
0
5
10
15
20
25
30
0
0
10
10
5
5
5
10
15
20
25
30
5
10
15
20
25
30
5
10
15
20
25
30
0.10
0.08
0.06
0.04
0.02
0.00
0
0
5
10
15
20
25
30
0
0
0.00
10
10
5
5
0
0
5
10
15
20
25
30
0
0
28.
На рисунках выделена часть расчетной области:Y
0.20
0.18
0.16
0.14
0.12
0.10
0.08
0.06
0.04
0.02
0.00
8
6
4
2
0
2
4
6
8
10 12
10
10
10
8
8
8
6
6
6
4
4
4
2
2
2
0
X
10
2
4
6
8
10 12 14
8
6
4
2
0
0
2
4
6
8
10 12 14
2
4
6
8
10 12 14
0
2
4
6
8
10 12 14
2
4
6
8
10 12 14
4
6
8
10 12 14
кислород
10
1.00
0.90
0.80
0.70
0.60
0.50
0.40
0.30
0.20
0.10
0.00
0
8
6
4
2
0
10
10
8
8
6
6
4
4
2
2
0
2
4
6
8
2
10 12 14
4
6
8
10 12 14
0
оксид
10
10
10
10
8
8
8
8
6
6
6
6
4
4
4
4
2
2
2
2
0
2
4
6
8
10 12 14
0
2
4
6
8
10 12 14
металл
0
2
4
6
8
10 12 14
0
1.00
0.90
0.80
0.70
0.60
0.50
0.40
0.30
0.20
0.10
0.00
2
29.
5; 20 :H 10
10
10
10
5
5
5
0
5
10
15
20
25
0
0
30
5
10
15
20
25
30
0
10
10
10
5
5
5
0
5
10
15
20
25
0
30
5
10
15
20
25
30
0
10
10
10
5
5
5
0
5
10
15
20
25
0
30
5
10
15
20
25
30
0
10
10
10
5
5
5
0
5
10
15
20
25
0
30
5
10
15
20
25
30
0
10
10
10
5
5
5
0
5
10
15
20
25
0
30
5
10
15
20
25
30
0
10
10
10
5
5
5
0
5
10
15
20
25
0
30
5
10
15
20
25
30
0
10
10
10
5
5
5
0
5
10
15
20
25
0
30
5
10
15
20
25
30
0
10
10
10
5
5
5
0
5
10
15
20
25
30
0
5
10
15
20
25
30
0
10
10
10
5
5
5
0
5
10
15
20
25
30
0
5
10
15
20
25
30
0
5
10
15
20
25
30
5
10
15
20
25
30
5
10
15
20
25
30
5
10
15
20
25
30
5
10
15
20
25
30
5
10
15
20
25
30
5
10
15
20
25
30
5
10
15
20
25
30
5
10
15
20
25
30
30.
Соединение материалов диффузионной пайкойЗадача включает уравнения теплопроводности для каждого слоя
Ti
2Ti
ci i
i 2
t
x
и уравнения диффузии легирующего элемента в слоях
Ci
Ci
Di
t
x
x
с коэффициентами диффузии, зависящими от температуры по закону
Аррениуса
E
Di Di 0 exp i
RT
31.
На границах раздела материалов выполняются условия идеального контактаT1
T2
C1
C2
1
2
, D1
D2
;
x
x
x
x
T1 T2 , C1 C2 , x 0
T3
C3
T2
C 2
2
3
, D2
D3
;
x
x
x
x
T2 T3 , C2 C3 , x
t ts ,
Ti 0 ,
,
i
x i Ti T0 , t t s
t 0:
i 1,3
C2 C0 , C1 0, C3 0
T1 T2 T3 Ts
32.
,100.0100
0
0
C
TT1,1, C
50
D 1010 см2 с-1
1100
10.000
1
1050
2
1000
1.000
1
950
3
0.100
900
2
3
850
4
0.010
4
800
750
-6000
C, %
3
-4000
-2000
0
2000
4000
x, мкм
6000
2
3
4
1
1
0
-4000
-2000
0
2000
4000
x, мкм
6000
Задача поиска оптимальных параметров
процесса электронно-лучевой пайки
ставилась исходя из условий
образования переходной зоны
определенной толщины и минимизации
величин остаточных напряжений в ней.
2
0
-200
0.001
-6000
200
400
600
x, мкм
800
33.
Пайка. Изотермические условияC1
C
D
; C1 1C
z
z
z h : D C D2 C2 ; C 2 2C
z
z
t 0 : C1 0; C2 0; C C0
z 0 : D1
Вдали от зоны диффузии источники и стоки массы отсутствуют
Задача имеет точное аналитическое решение, которое содержит параметры:
1
1 K2 2
1 K1 1
, K1
, 2
1 K2 2
1 K1 1
D1
, K2
D
D2
D
Вопрос: какие «похожие» параметры мы встречали в чисто теплофизических задачах?
34.
C1
2
3
0,6
C
0,6
0,4
0,4
0,2
0,2
0,0
-3
0,0
h
0
3
6
C
1
2
3
0,6
-3
0,2
0,2
3
6
3
6
-3
1
2
3
0,0
h
0
0
0,6
0,4
-3
h
C
0,4
0,0
1
2
3
h
0
3
6
35.
Взаимодействие лазерного излучения с веществомВ настоящее время лазеры перекрывают диапазон от ультрафиолета
до субмиллиметровых волн, достигнуты первые успехи в создании
рентгеновских лазеров, созданы перестраиваемые по частоте лазеры.
Мощность лазерного излучения в непрерывном режиме может быть
порядка 105 - 106 Вт, в импульсном - до 1012 - 1013 Вт, при этом удается достичь
интенсивностей порядка 1012 - 1016 Вт/cм2. Существенно, что эти мощности могут
быть сконцентрированы в чрезвычайно узких спектральных и временных
интервалах.
Длительность импульса излучения в лазерах, работающих в режиме
синхронизации мод, может составлять 10- 12 - 10- 13 с и специальными методами
доводится до 10- 15 с (за это время свет проходит всего 3 • 10- 5 см), то есть
лазеры обладают удивительно высокой степенью концентрации энергии во
времени . Высокая степень монохроматичности и когерентности делают лазеры
уникальными
источниками
света
и
определяют
возможность
их
многочисленных применений.
Основной процесс лазерного облучения представляет собой
выделение теплоты в результате поглощения света. В гомогенной среде имеем:
I x, t I 0 t 1 f exp x
x*,1
t*
c
x*,2 1
Показатель поглощения σ и
коэффициент отражения f –
функции температуры и состава
36.
1.аНагрев тонкой пленки лазерным излучением
q x, y, z Aq0 exp z
z
c p
A 1 f
T T
T
Aq0 exp z
t z
z
T
z 0, : 0
z
t 0:
T t*
- поглощательная способность
T T0
(1)
(2)
(3)
проинтегрируем уравнение теплопроводности по
толщине образца (пленки)
Поток, пропущенный
пленкой:
Aq0exp
c p
dT
Aq0 1 exp
dt
Радиационный поток тепла, поглощенный пленкой
qa Aq0 1 exp
(4)
37.
T T0 BtЗадача имеет точное решение:
T
q0
B A
1 e
c p
(8)
(6)
Угол наклона прямой (5) зависит от
теплоемкости, плотности, толщины пленки
и эффективных оптических свойств
(5)
T0
(5)
t
1.б
Усложним задачу: пусть поглощательная способность зависит от температуры
A A0 A1T
dT
B0 1 T ,
dt
B0 A0
q0
1 e
c p
t 0 : T T0
1
T T0exp B0t exp B0t 1
Поток, поглощенный пленкой
(7)
(8)
Qa c p B0 1 T0 exp B0t
(9)
A1
A0
38.
2.а Лазерная резка полимерной пленкиИзменим задачу: пленка способна разлагаться при высокой температуре
Пропускательная
способность или
показатель поглощения
Коэффициент
пропускания
1 f exp σ h
Коэффициент
отражения
Поглощательная
способность
Суммарная
реакционная схема
CA
A
,
A B
CB
q0
(10)
A 1 f
A B
h
эксперимент
B
степень
A B
превращения
Продукты реакции содержат поглощающие центры
Закон Ламберта – Бугера-Бэра: ~ Cad
0 , f0 - оптические свойства исходного вещества
f , ff
qa
- оптические свойства продукта
σ σ0
f f0
η (11)
σ f σ 0 ff f 0
Степень
превращения
39.
Скорость химическойреакции
E
T , z 1 m exp a
RT
Простейший вариант модели для тонкой пленки:
dT
d
c h
qa Qch h T T0
dt
dt
(12)
d
E
z 1 m exp a
dt
RT
(13)
T T0 0, t 0
(14)
qa q0 1 exp σ h 1 f
q0 exp σ h 1 f
Поток, поглощенный
пленкой
Поток, пропущенный
пленкой
Если нет химической реакции, задача имеет точное решение
40.
(15) T T0qa
t
1
exp
c h
- температура на стадии инертного прогрева
Если протекает суммарно экзотермическая реакция – на кривой T t
можно выделить отдельные участки, где основную роль
играют разные процессы
Радиационный
поток, покидающий
пленку
(пропущенный)
ln qа
1.
1,4 – температура;
3,6 – степень превращения;
2,5 – поток, пропущенный
пленкой
ti
2.
– время «зажигания» пленки
с меняющимися
оптическими свойствами;
- время «зажигания» пленки
с постоянными
оптическими свойствами
Типичный вид показаний
фотоприемника и термопары
эксперимент
можно определять по скорости роста температуры, или по
величине степени превращения
41.
2,бУсложним задачу
Разложение полимеров, как правило, протекает в две основные стадии.
Первая – эндотермическая. Именно она сопровождается образованием
поглощающих центов. Вторая – экзотермическая, связана с превращением
продукта первой стадии с участием газовой фазы
Две стадии разложения:
Вторая стадия
фактически
приводит к
изменению
толщины пленки
d
E
z 1 m exp
1 (16)
dt
RT
k 2 T
2 , h 0;
dh
1 k 2 T
(17)
dt
h 0,
0 ,
Сосредоточенный источник
r2
qs q0 exp 2
a
Поглощенный поток qa qs 1 exp σ h 1 f
Пропущенный
поток
qs exp σ h 1 f
q0
2a
h0
42.
c hT
T
h
r
qa Q1h 1 2Q2 2 2 T T0 (18)
t
r r r
T T0 0 , h h0 , t 0
σ σ0
f f0
η
σ f σ 0 ff f 0
r=0
Толщина пленки
Поток,
пропущенный
пленкой, Ф
tf
температура
tf ,r
5 – погл. поток
r 0
ti «время зажигания» широким потоком
exp 0 ,22 , 0 ,22 ;
0 ,22
1,
tf ,a c a 2
(19)
43.
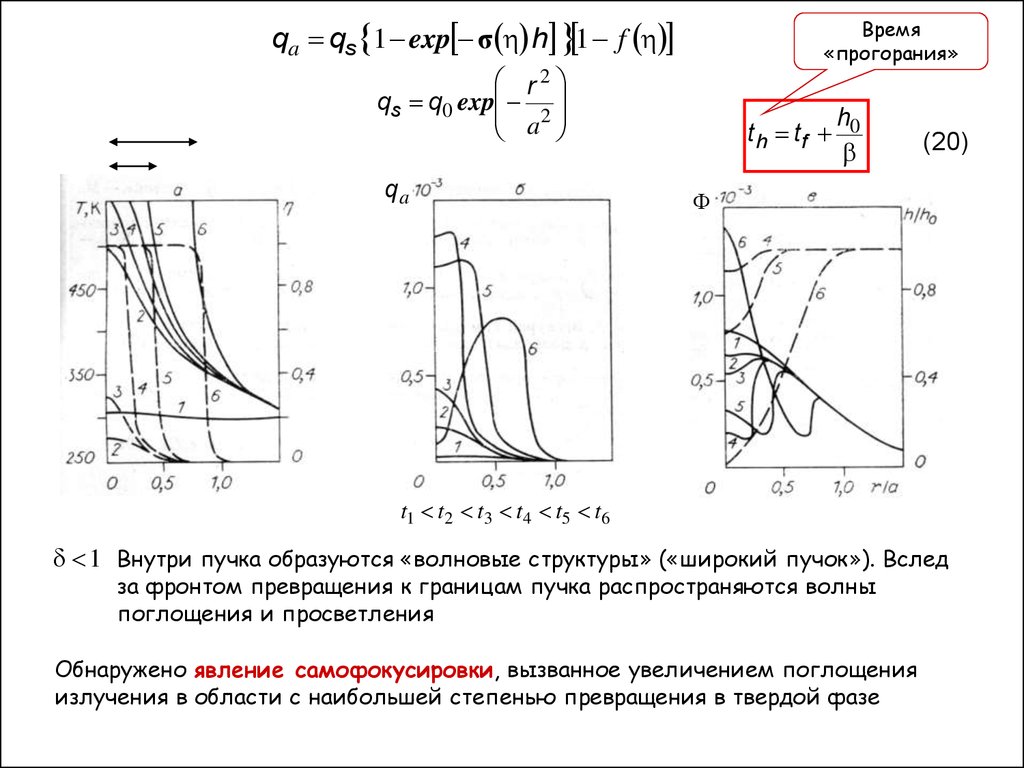
qa qs 1 exp σ h 1 fВремя
«прогорания»
r2
qs q0 exp 2
a
qa
t h tf
h0
(20)
t1 t2 t3 t4 t5 t6
1 Внутри пучка образуются «волновые структуры» («широкий пучок»). Вслед
за фронтом превращения к границам пучка распространяются волны
поглощения и просветления
Обнаружено явление самофокусировки, вызванное увеличением поглощения
излучения в области с наибольшей степенью превращения в твердой фазе
44.
Дома1.Записать систему кинетических уравнений, соответствующих
реакционной схеме
Ti Al TiAl
2Ti TiAl Ti3 Al
TiAl 2 Al TiAl3
2. Сформулировать математическую задачу:
Расплав, находящийся при температуре ТА , охлаждается с поверхности,
которая поддерживается при температуре Т0. При температуре Тm
происходит затвердевание расплава кристаллизация), а затем – фазовый
переход первого рода в твердой фазе при температуре ТВ
T0 TB Tm TA
Попробуйте построить аналитическое решение задачи.











































 Физика
Физика Химия
Химия








