Похожие презентации:
Основные химические понятия и законы
1. Вводная лекция
2. Литература
• Ахметов Н.С. Общая и неорганическаяхимия
• Угай Я.А. Общая и неорганическая химия
• Зайцев О.С. Общая химия
• Коровин Н.В. Общая химия
• Глинка Н.Л. Общая химия
• Хомченко И.Г. Общая химия
3. Ресурсы Internet
• www.xumuk.ru• www.nehudlit.ru
• www.interneturok.ru
4.
5.
6.
7. Основные химические понятия и законы
8.
Понятияхимии
9.
• Химия – наука о превращениях веществ,связанных с изменением электронного окружения
атомных ядер.
• Вещество – это конкретный вид материи,
обладающий определенными физическими и
химическими свойствами, состав которого может
быть выражен химической формулой.
• Простое вещество состоит из атомов одного и
того же химического элемента.
• Химические соединения состоят из атомов
нескольких элементов.
10.
• Химический элемент представляет собой видатомов с одинаковым положительным зарядом
ядра.
• В настоящее время известно 117 химических
элементов, из которых 92 встречаются в природе.
• Атомы – мельчайшие химические частицы,
являющиеся пределом химического разложения
любого вещества.
• Атом – это наименьшая частица химического
элемента, сохраняющая все его химические
свойства.
11.
• Массы атомов химических элементовчрезвычайно малы: ~ 10-27 – 10-25 кг. В
химии пользуются относительными
значениями масс атомов (Ar, где r –
«относительный», от англ. relative).
12.
• Относительная атомная масса – этомасса атома, выраженная в атомных
единицах массы. За атомную единицу
массы принята 1/12 часть массы атома
нуклида :
26
• 1 а.е.м. = 1
1,993 10 кг
27
mа (С )
1,661 10 кг
12
12
• Относительная атомная масса – величина
безразмерная.
13.
• Абсолютное большинство различных веществсостоит из молекул.
• Молекула – наименьшая частица вещества,
способная существовать самостоятельно и
сохраняющая основные химические свойства
вещества.
• Относительная молекулярная масса Mr вещества
– это масса его молекулы, выраженная в а.е.м.
(символ Mr – безразмерная величина). Например,
Mr(H2SО4) = 98
14.
• Единицей измерения количества вещества (n) являетсямоль.
• Моль – количество вещества, содержащее столько
структурных элементарных единиц (атомов, молекул,
ионов, электронов и т.д.), сколько содержится атомов в
0,012 кг изотопа углерода 12С.
• Число атомов NА в 0,012 кг углерода, или в 1 моль, легко
определить следующим образом:
0,012 кг / моль
• .
N
6,02 10 23 моль 1
A
1,993 10 26 кг
• Величина NA называется постоянной Авогадро.
15.
Масса одного моля вещества называется молярноймассой (символ М(В), единица – г/моль или
кг/моль). Молярная масса вещества численно
равна его относительной молекулярной массе.
Например. Mr(H2SО4) = 98, a M(H2SО4) = 98 г/моль.
Молярная масса вещества (М(В)), количество
вещества (n(В)) и масса вещества (m(В))связаны
между собой соотношением:
n=m/M
16.
• Химической реакцией называется процесспревращения одних веществ в другие.
Способность вещества участвовать в тех или
иных химических реакциях характеризует
его химические свойства.
17.
Законыхимии
18. Закон сохранения массы
• масса веществ, вступающих в химическуюреакцию, равна массе веществ,
образующихся в результате реакции.
• Автор закона Лавуазье
19. Закон постоянства состава
• всякое чистое вещество, независимо отспособа его получения, имеет постоянный
качественный и количественный состав.
• Закон применим только к соединениям с
молекулярной структурой.
• Автор закона Ж. Л. Пруст
20. Закон эквивалентов
Эквивалент – условная или реальносуществующая частица вещества в Z раз
меньшая, чем соответствующая ФЕ
вещества, участвующего в конкретной
реакции
Э = ФЕ / Z
где Z – эквивалентное число, которое может
быть равно или больше единицы (Z 1).
21. Закон эквивалентов
Первая формулировка закона эквивалентов: вреакции эквивалентные количества реагирующих
и образующихся веществ одинаковы.
Для реакции, записанной в общем виде
А + В + … = Д + F + ...
закон эквивалентов
nэк(А) = nэк(В) = ... = nэк(Д) = nэк(F) = ... .
22.
Вторая формулировка закона эквивалентов:массы реагирующих веществ
пропорциональны молярным массам
эквивалентов этих веществ:
m(В1) / Мэк(В1) = m(В2) / Мэк(В2)
23.
Эквивалентное количество вещества (символ nэк(В),единица – моль) – физическая величина,
пропорциональная числу эквивалентов вещества
Nэк(В):
n(эк) = N(эк) / N(A)
Эквивалентное количество вещества связано с
количеством вещества соотношением
nэк(В) = Z n(B).
24.
Масса одного моля эквивалентов вещества называетсямолярной массой эквивалентов этого вещества (символ
Мэк(В)), единица – г/моль или кг/моль).
Молярная масса эквивалентов вещества в Z раз меньше
молярной массы этого же вещества:
Мэк(В) = М / Z
Молярная масса эквивалентов вещества Мэк(В), масса
вещества m(В) и эквивалентное количество вещества nэк(В)
связаны между собой соотношением:
nэк(В) = m(В) / Мэк(В)
25. Определение Z
В кислотно-основных реакциях эквивалентное числоопределяют по числу замещённых ионов водорода (для
кислоты) и по числу замещенных гидроксид-ионов (для
основания) из расчета на одну ФЕ. Эквивалентное число
для иона водорода (Н+ и гидроксид-иона (ОН–) равно
единице (Z(Н+) = 1 и Z(OH–)= 1).
H3PО4 + NaOH = NaH2PO4 + H2О; Z(NaOH) = 1, Z(H3PО4) = 1
H3PО4 + 2 NaOH = Na2HPO4 + 2 H2О;
Z(NaOH) = 1, Z(H3PО4) = 2
H3PО4 + 3 NaOH = Na3PO4 + 3 H2О. Z(NaOH) = 1, Z(H3PО4) = 3
26. Определение Z
В окислительно-восстановительных реакцияхэквивалентное число для восстановителя
определяют по числу отданных электронов, а для
окислителя – по числу принятых электронов.
Расчет ведется на одну ФЕ.
2 Н2 + О2 = 2 Н2О.
Н2 – 2 е 2Н+; Z(H2) = 2;
О2 + 4е 2О2–. Z(О2) = 4,
27. Закон объёмных отношений
• (Гей–Люссака): при неизменныхтемпературе и давлении объемы
вступающих в реакцию газов относятся друг
к другу, а также к объемам образующихся
газообразных продуктов как небольшие
целые числа.
28. Газовые законы
• Закон Авогадро: в равных объемах любыхгазов при одинаковых условиях (Т, р)
содержится равное количество молекул.
29. Следствия из закона Авогадро
При одинаковых условиях 1 моль любого
газа занимает одинаковый объем.
При н.у. 1 моль различных газов занимает
объем 22,4 л (молярный объем газа,
л/моль).
Отношение масс равных объемов
различных газов равно отношению их
молекулярных масс:
30. Следствия из закона Авогадро
m1 M r1,
m2 M r2
M r1 и M r2 –
где m1 и m2 – массы, а
молекулярные массы первого и второго
газов.
m1
Д
m2
относительная плотность первого газа по
второму.
Д
M r1
M r2
М r1 M r2 Д .
31. Объединенный газовый закон
pV p 0V0,
T
T0
р0 = 101325 Па = 760 мм рт. ст. = 1 атм.,
Т0 = 0 ºС (273,15 К),
где р0, V0, Т0 – соответственно давление,
объем, температура при н.у.; р, V, Т – те же
параметры данного количества
газообразного вещества при других
условиях.
32. Объединенный газовый закон
РVR
T
• Для 1 моль любого газа при н.у.:
• R = 8,314 Дж/(моль К)
• Для 1 моля газа уравнение состояния
идеального газа
pV RT .
• уравнение Менделеева – Клайперона
m
pV
RT nRT
M
33. Закон парциальных давлений
• общее давление смеси газов, химически невзаимодействующих друг с другом, равно сумме
парциальных давлений газов, составляющих смесь:
p p1 p2 ...,
• где р – общее давление; р1, р2 … - парциальные давления
газов 1, 2 …
• Парциальное давление газа в смеси – давление, которое
производило бы это же количество данного газа, если бы
он один занимал при этой же температуре весь объем,
занимаемый смесью.
• Автор закона Дальтон




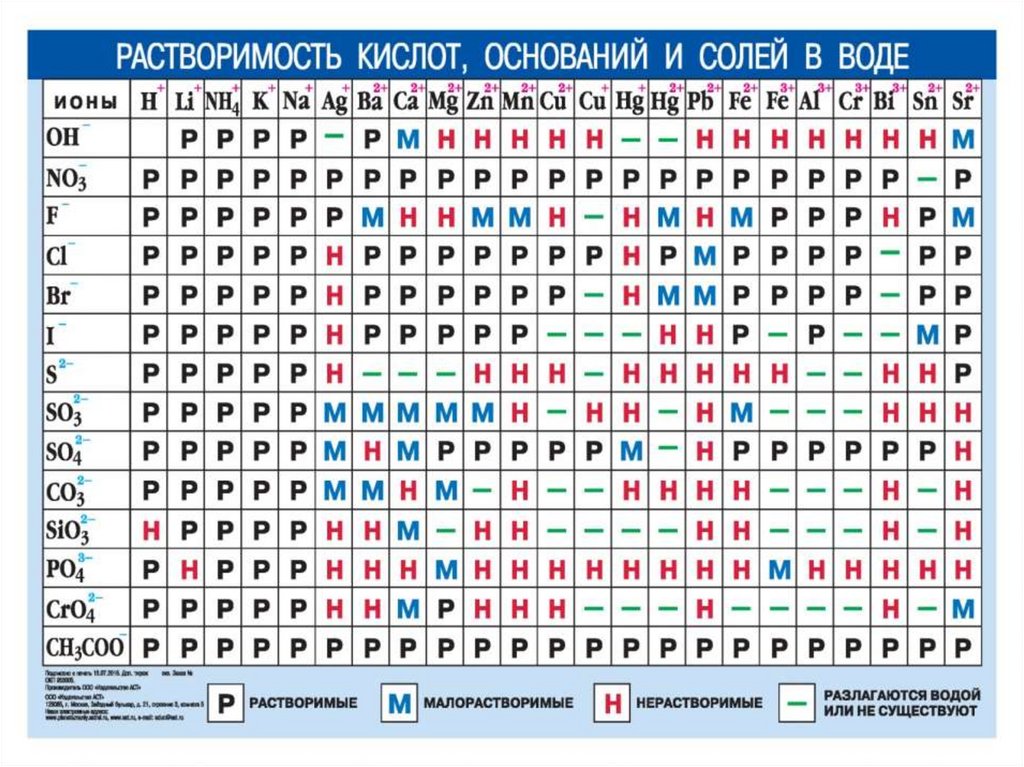
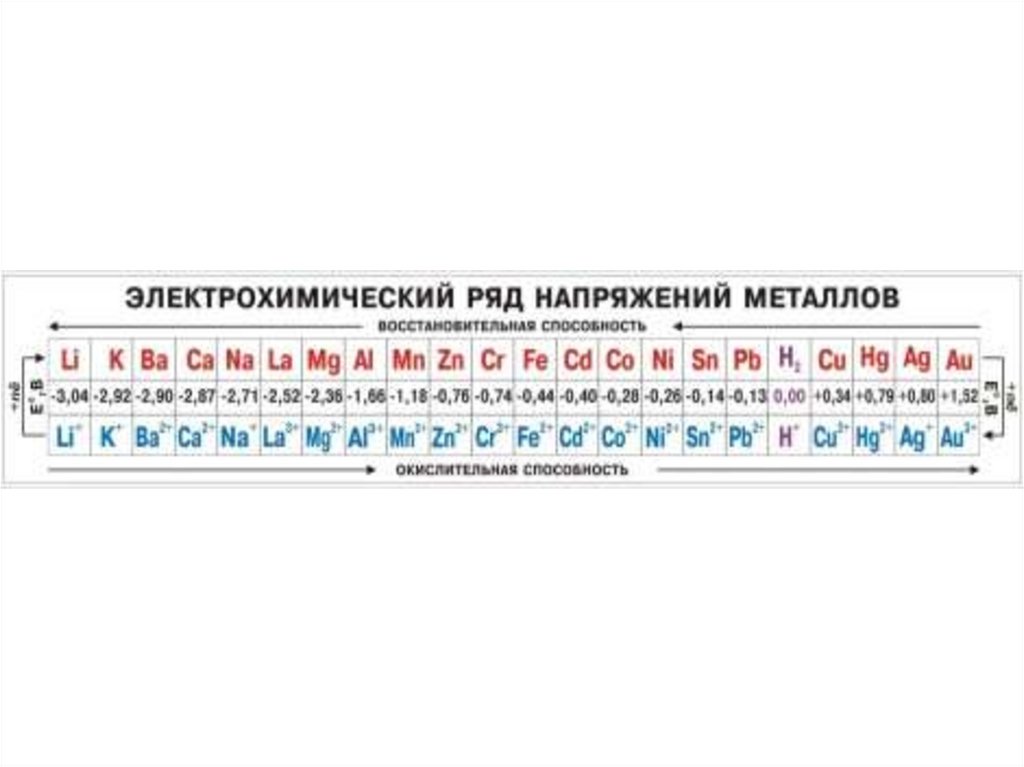




























 Химия
Химия








