Похожие презентации:
Строение электронных оболочек атомов химических элементов
1.
2.
Цель уроканаучиться составлять электронные
формулы атомов элементов первых
трех периодов ПСХЭ;
объяснять зависимость и закономерные
изменения свойств химических
элементов от электронного строения их
атомов.
3.
4.
5.
6.
Атом –наименьшая
электронейтральная частица
химического элемента,
состоящая из ядра и
электронной оболочки
7.
8.
Атом электронейтраленЧисло протонов (+) и число
электронов (-) в атоме одинаково
Их число соответствует
порядковому номеру химического
элемента
9.
10.
Электроны в атоме различаютсясвоей энергией
Электроны, двигаясь вокруг ядра
атома, образуют в совокупности его
электронную оболочку (совокупность
электронов, близких по значению
энергии)
Чем ближе электроны к ядру, тем
они прочнее связаны с ним.
И, наоборот
11.
Электронная оболочка(энергетический уровень)
атома водорода состоит из …
электрона
атома хлора – из… электронов
золота – из… электронов
12.
Число заполняемых электронамиэнергетических уровней в атоме
равно номеру периода (n) в таблице
Д.И. Менделеева, в котором
находится химический элемент
Максимальное число электронов,
которое может вместить
энергетический уровень,
определяется по формуле: (N) = 2n2
13.
1 период - один эн.уровеньмаксимум 2*12=2 e-
+Z
2 период - два э.уровня
максимум 2*22=8 e-
+Z
3 период - три э.уровня
максимум 2*32=18 e4 период - четыре оболочки
максимум 2*42=32 e-
+Z
+Z
)
))
)))
))))
14.
Энергетические уровни,содержащие максимальное
число электронов, называются
завершенными
15.
Число электронов на внешнейоболочке определяется номером
группы, в которой находится
химический элемент (не может
быть больше 8).
I группа - один электрон
+Z
))
))
1e-
II группа - два электрона
+Z
2e-
16.
1. Записываем знак химическогоэлемента и заряд ядра его атома – он
равен порядковому номеру элемента.
2. Определяем количество
энергетических уровней (оно равно
номеру периода) и количество
электронов на каждом уровне.
3. Составляем электронную схему и
формулу.
17.
Распределение электронов поэнергетическим уровням
Н
Не
1 период
+1
)
1e-
I группа
+2
)
2e-
VIII группа
18.
2 периодBе
Li
+3
) )
+4
2e- 1e-
C
))
+9 ) )
+6
F
+5
2e- 2eN
+7
2e- 4e- Ne
2e- 7e-
))
B
+10
))
2e- 3eO
))
))
2e- 5e-
2e- 8e-
+8
))
2e- 6e-
19.
20.
21.
Пространство вокруг ядраатома, где наиболее
вероятно нахождение
данного электрона,
называют орбиталью этого
электрона или электронным
облаком
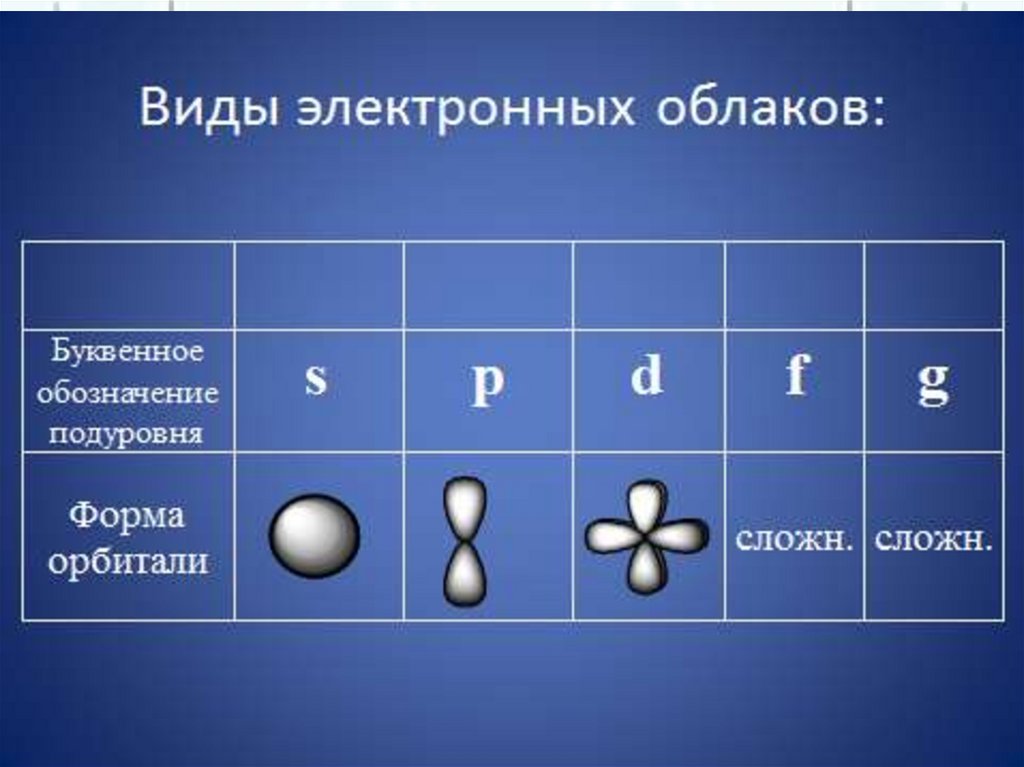
22.
Орбиталиs
f
p
d
23.
24.
Энергетические уровни иэлектронные орбитали
+Z
1s
))) )
2s 2p 3s
4f
4d
3p 4s 3d
4p
25.
26.
ИТАК, имеем1s
2s2p3s3p3d
4s4p4d4f
5s5p5d5f…
6s6p6d6f…
7s7p7d7f…
27.
Распределение электронов поорбиталям
1. s-орбитали заполняются в первую
очередь. Затем заполняются рорбитали.
2. На каждой орбитали (клеточке)
может находиться не более 2
электронов. 3. Электрон
обозначается стрелочками
или
28.
Н+1
He
)
+2
1e-
1s
1s1
)
2e-
1s
Электронно-графические
формулы
1s2
29.
Li+3
) )
Be
+4
2e- 1e-
2e- 2e-
2s
1s
) )
2s
1s22s1
1s
1s22s1
Электронные формулы
30.
B+5
) )
2e- 3e2p
2s
1s
1s22s22p1
31.
C+6
) )
2e- 4e2p
2s
1s
2
2
2
1s 2s 2p
32.
N+7
) )
2e- 5e2p
2s
1s
2
2
3
1s 2s 2p
33.
O+8
) )
2e- 6e2p
2s
1s
2
2
4
1s 2s 2p
34.
F+9
) )
2e- 7e2p
2s
1s
2
2
5
1s 2s 2p
35.
Ne+10
) )
2e- 8e2p
2s
1s
2
2
6
1s 2s 2p
36.
37.
38.
Домашнее заданиеО.С. Габриелян: §9, упр. 1-4 стр.
60.
О.С. Габриелян и другие: §31,
упр. 3-6 стр. 139.
Уметь составлять электронные
схемы и формулы строения атомов
2 и 3 периодов.







































 Химия
Химия








