Похожие презентации:
Условия протекания химических реакций
1.
Условияпротекания
химических
реакций
2.
Из приведенного перечня определитесильные и слабые электролиты:
H2SO4 , Cu (OH)2, H2CO3, K2SO4,
Mg(NO3)2, NiOH, NaOH, H2O
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ
H2SO4
K2SO4
Mg(NO3)2
NaOH
СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Cu (OH)2
H2CO3
NiOH
H2O
3.
ДИССОЦИАЦИЯ ОСНОВАНИЙ,КИСЛОТ,СОЛЕЙ
NaOH
+
Na
+
OH
H2SO4 2H+ + SO42Al2(SO4)3 2Al3+ + 3SO42-
4.
Найдите среди предложенныхреакций реакции обмена:
K2CO3 + H2SO4 ?
Mg + HCl ?
Na2SO4 + Ba(NO3)2?
Zn(OH)2 ?
NaOH + HCl ?
SO3 + MgO ?
5.
Реакции обмена:K2CO3 + H2SO4
Na2SO4 + Ba(NO3)
NaOH + HCl
6.
Определите ключевое понятиесегодняшнего урока, используя
«лабиринт букв»
Ц И И С Р О А Н
К А И О О Г М Е
Р Е Б Н Н О Б К
7.
ТЕМА УРОКА:«РЕАКЦИИ
ИОННОГО
ОБМЕНА»
8.
ТЕРМИНЫИоны– это ?
положительно или отрицательно
заряженные частицы
Реакции ионного обмена– это ?
реакции между ионами.
9.
Алгоритм составленияуравнений реакций ионного
обмена
10.
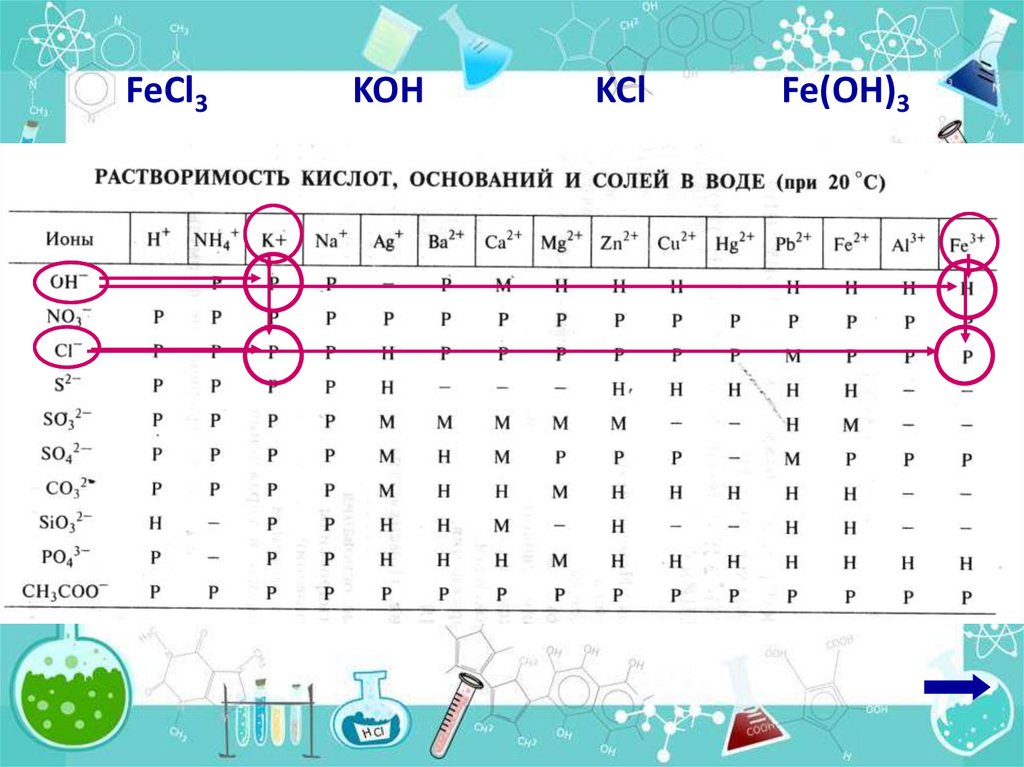
Даны растворы хлорида железа(III) игидроксида калия. Написать
молекулярное и ионные уравнения
реакции между этими растворами.
1. Записать молекулярное уравнение реакции
FeCl3 + 3 KOH =
3 KCl + Fe(OH)3
расставить коэффициенты
11.
2. Подчеркнуть сильныеэлектролитов (растворимые соли,
10!!! щелочей и 10!!! кислот)
FeCl3 + 3 KOH = 3 KCl + Fe(OH)3
12.
FeCl3KOH
KCl
Fe(OH)3
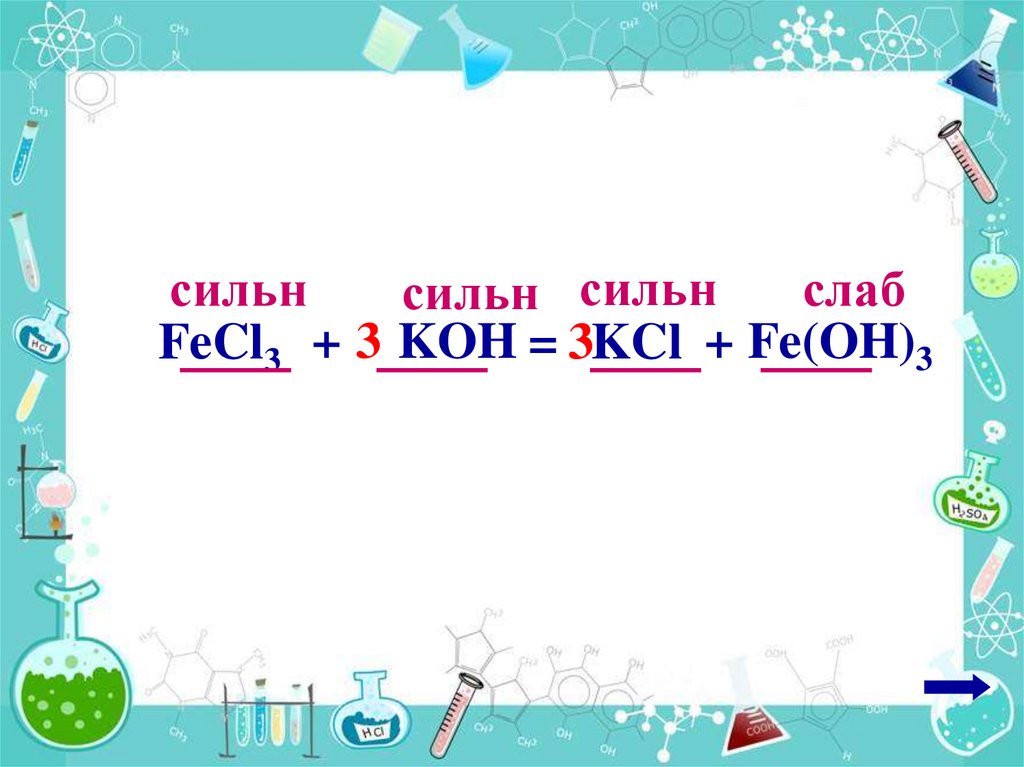
13.
сильнслаб
сильн сильн
FeCl3 + 3 KOH = 3KCl + Fe(OH)3
14.
3. Написать полное ионноеуравнение реакции.
FeCl 3 + 3 KOH = 3 KCl + Fe(OH)3
Fe3+ + 3 Cl-+ 3 K+ + 3OH- = 3 K+ + 3 Cl- + Fe(OH)3
Необходимо учитывать индексы у ионов и
коэффициенты в уравнении реакции.
15.
4. Для составления сокращённого ионногоуравнения надо найти одинаковые ионы справа
и слева от знака равенства и вычеркнуть их.
Fe3+ + 3 Cl- + 3 K+ + 3 OH- = 3 K+ + 3 Cl- + Fe(OH)3
5. Записать уравнение без вычеркнутых ионов.
Fe3+ + 3 OH- = Fe(OH)3
16.
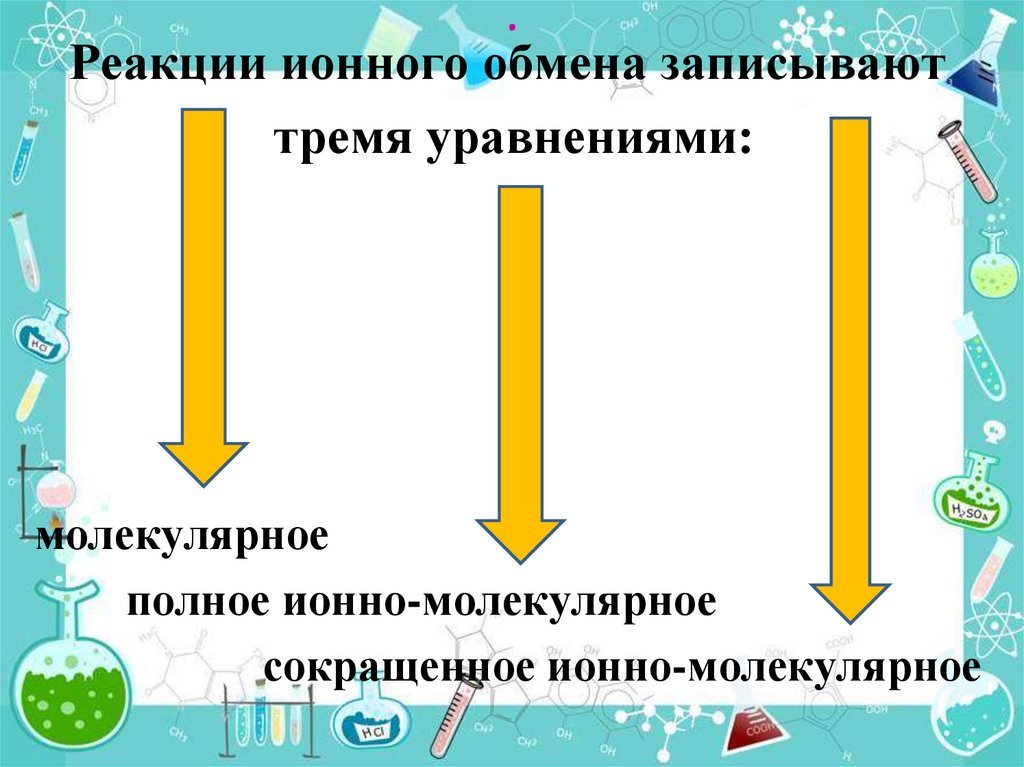
.Реакции ионного обмена записывают
тремя уравнениями:
молекулярное
полное ионно-молекулярное
сокращенное ионно-молекулярное
17.
ПРИЗНАКИПРОТЕКАНГИЯ
РЕАКЦИИ
ИОННОГО
ОБМЕНА
18.
Задание № 1ВЫДЕЛЕНИЕ ГАЗА
• Молекулярное уравнение :
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
• Полное ионное уравнение реакции:
2Na + + CO3 2– + 2H + + 2Cl –→ 2Na+ + CO2↑ +
H2O + 2Cl –
• Cокращенное ионное уравнение реакции:
CO3 2– + 2H + = CO2↑ + H2O
Вывод: реакция идет до конца.
19.
Задание № 2.ВЫПАДЕНИЕ ОСАДКА
• Молекулярное уравнение :
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
• Полное ионное уравнение реакции:
Cu 2+ + 2Cl – + 2Na + + 2OH –→ 2Na + + 2Cl – +
Cu(OH)2↓.
• Cокращённое ионное уравнение реакции:
Cu 2+ + 2OH –→ Cu(OH)2↓
Вывод: реакция идет до конца.
20.
Задание № 3ОБРАЗОВАНИЕ ВОДЫ
Молекулярное уравнение реакции щелочи с
кислотой:
NaOH + HCl → NaCl + H2O (слабый
электролит)
• Полное ионное уравнение реакции:
Na+ + OH– + H+ + Cl– →Na+ + Cl – + H2O
• Cокращённое ионное уравнение реакции:
H + + OH– → H2O
Вывод: реакция идет до конца.
21.
Как называется реакциявзаимодействия сильной
кислоты с щелочью?
22.
Реакциянейтрализации
23.
Задание № 4ПРИЗНАКОВ НЕ НАБЛЮДАЕТСЯ
Молекулярное уравнение:
NaOH + KCl → NaCl + KOH
Полное ионное уравнение реакции :
Na + + OH– + K+ + Cl– → Na+ + Cl– + K+ + OH–
Вывод: РЕАКЦИЯ НЕ ИДЕТ, т.к. не
происходит связывания ионов.
24.
.Условия протекания реакций
ионного обмена до конца
ОСАДОК
(МАЛОРАСТВОРИМОЕ
ВЕЩЕСТВО)
ГАЗ
СЛАБЫЙ ЭЛЕКТРОЛИТ
(ВОДА)
25.
Тест «Проверь себя»:1) Ионные реакции – это реакции между:
а) нейтральными атомами б) ионами
в) молекулами
г) протонами
2) Реакции нейтрализации – частный случай
реакции:
а) обмена
б) замещения
в) соединения г) разложения
3) Какое из приведенных веществ выпадает в
осадок:
а) MgS
б) KОН
в) HNO3
г) Na2SO4
26.
.4) Какое вещество надо добавить к
соляной кислоте, чтобы в результате
реакции выделился газ:
а) KOH
б) NaOH
в) Na2CO3
г) AgNO3
5) Какое вещество является
малодиссоциирующим:
а) H3PO4
б) KOH
в) Na2SO4
г) H2O
27.
Ответы:• 1. б
• 2. а
• 3. а
• 4. в
• 5. г
28.
РЕФЛЕКСИЯ- Cегодня на уроке я
научилась(ся)……
- Мне было легко…
-Мне было сложно…
- Особенно интересным было…


























 Химия
Химия








