Похожие презентации:
Опыт Резерфорда. Постулаты Бора
1. Опыт Резерфорда. Постулаты Бора.
Разработала: НизамутдиноваСветлана Юрьевна, учитель
физики МАОУ «Гимназия №19»
г. Миасса
2. Отыщи всему начало, и ты многое поймешь. Козьма Прутков
400 г. до н.э. Демокрит: «Существуетпредел деления атома».
Аристотель: «Делимость вещества
бесконечна».
1626 г., Париж: учение об атоме запрещено
под страхом смерти
3.
1897. Джозеф Джон Томсон (1856 – 1940).Определил заряд и массу отдельного «атома»
электричества.
В природе существует материальный носитель
наименьшего заряда – электрон. 1906 – 1914 г.г.
Роберт Милликен (1868 – 1953). Провел
эксперименты по точному определению массы и
заряда электрона.
me = 9,109389 10 -31 кг ;
qе = 1,602177 10 – 19 Кл
4. Модель атома Томсона
Явление радиоактивности давало основания предположить,что в состав атома входят отрицательно и положительно
заряженные частицы.
Кроме того, было известно, что атом в целом нейтрален.
5. Модель атома Томсона
В 1903г. английский физик ДжозефДжон Томсон предложил одну из
первых моделей строения атома –
«кекс с изюмом»
6. Модель атома Томсона
По предположению Томсона, атом представлял собой шаррадиусом ≈ 10-10 м, по всему объему которого равномерно
распределен положительный заряд.
Внутри этого шара находятся
электроны, которые могут
колебаться около своего положения
равновесия. Положительный заряд
шара равен по модулю суммарному
отрицательному заряду электрона,
поэтому электрический заряд атома
в целом равен нулю.
7. Опыт Резерфорда
Модель строения атома Томсона нуждалась вэкспериментальной проверке.
Важно было проверить,
действительно ли положительный
заряд распределён по всему
объёму атома с постоянной
плотностью.
Поэтому в 1906 г. Резерфорд
совместно со своими сотрудниками
провел ряд опытов по исследованию
состава и строения атомов.
8. Идея опыта
Зондировать атом альфа–частицами.Альфа-частицы возникают при распаде радия.
Масса альфа-частицы в 8000 раз больше массы электрона.
Электрический заряд альфа-частицы в 2 раза больше
заряда электрона.
Скорость альфа-частицы около 15 000 км/с.
Альфа-частицы является ядром атома гелия.
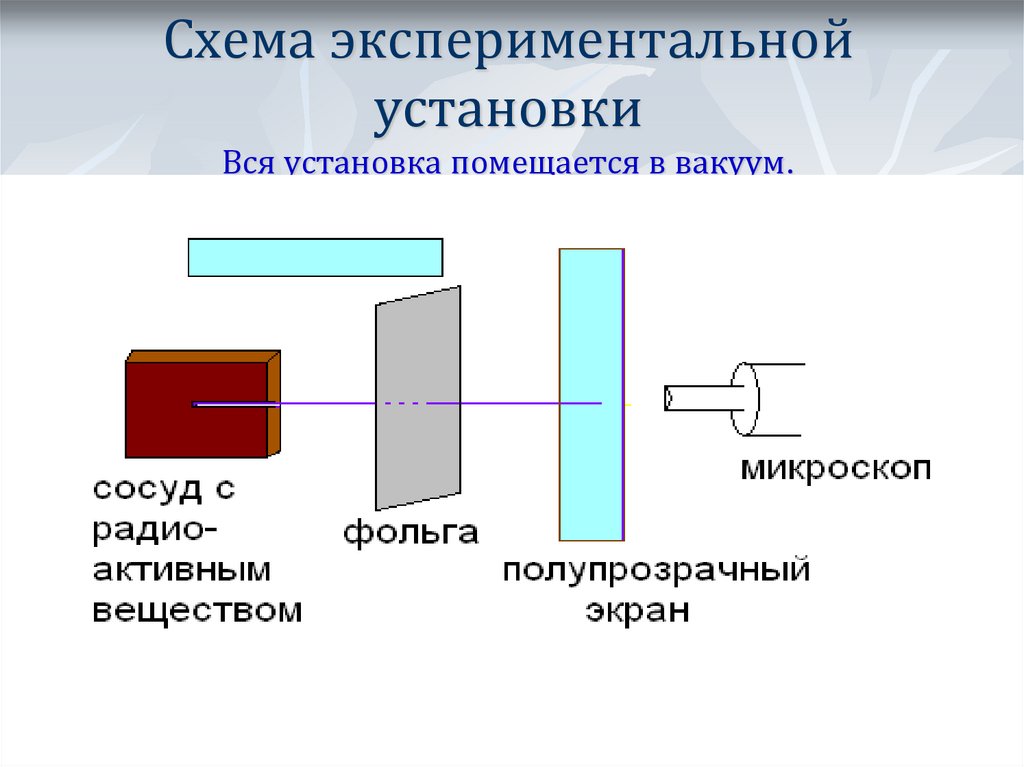
9. Схема экспериментальной установки Вся установка помещается в вакуум.
10. В отсутствии фольги – на экране появлялся светлый кружок напротив канала с радиоактивным веществом.
11. Когда на пути пучка альфа-частиц поместили фольгу, площадь пятна на экране увеличилась. Помещая экран сверху и снизу установки,
Резерфорд обнаружил, чтонебольшое число альфа-частиц отклонилось на углы около 900.
Единичные частицы были отброшены назад.
12. Выводы из опыта Резерфорда
Именно случаи рассеяния α-частиц на большие углыпривели Резерфорда к выводу:
Столь сильное отклонение α-частиц
возможно только в том случае, если
внутри атома имеется чрезвычайно
сильное электрическое поле. Было
рассчитано, что такое поле могло быть
создано зарядом, сконцентрированным в
очень малом объеме (по сравнению с
объемом атома).
13. Выводы из опыта Резерфорда
Поскольку масса электрона примерно в 8 000 раз меньше массыα-частицы, электроны, входящие в состав атома, не могли
существенным образом изменить направление движения αчастиц. Поэтому:
В данном случае речь может идти
только о силах электрического
отталкивания между α-частицами и
положительно заряженной частью
атома, масса которой значительно
больше массы α-частицы.
14. Модель атома Резерфорда
В центре атома находится положительно заряженное ядро,вокруг которого вращаются по определенным орбитам
электроны.
Основная масса атома сосредоточена в ядре m ядра =
99,4% m атома.
В зависимости от массы ядро имеет диаметр порядка
10-14 – 10-15 м, т.е. оно в десятки или даже в сотни тысяч
раз меньше атома (диаметр атома ≈ 10-10 м).
Атом электрически нейтрален: q ядра = +∑ e.
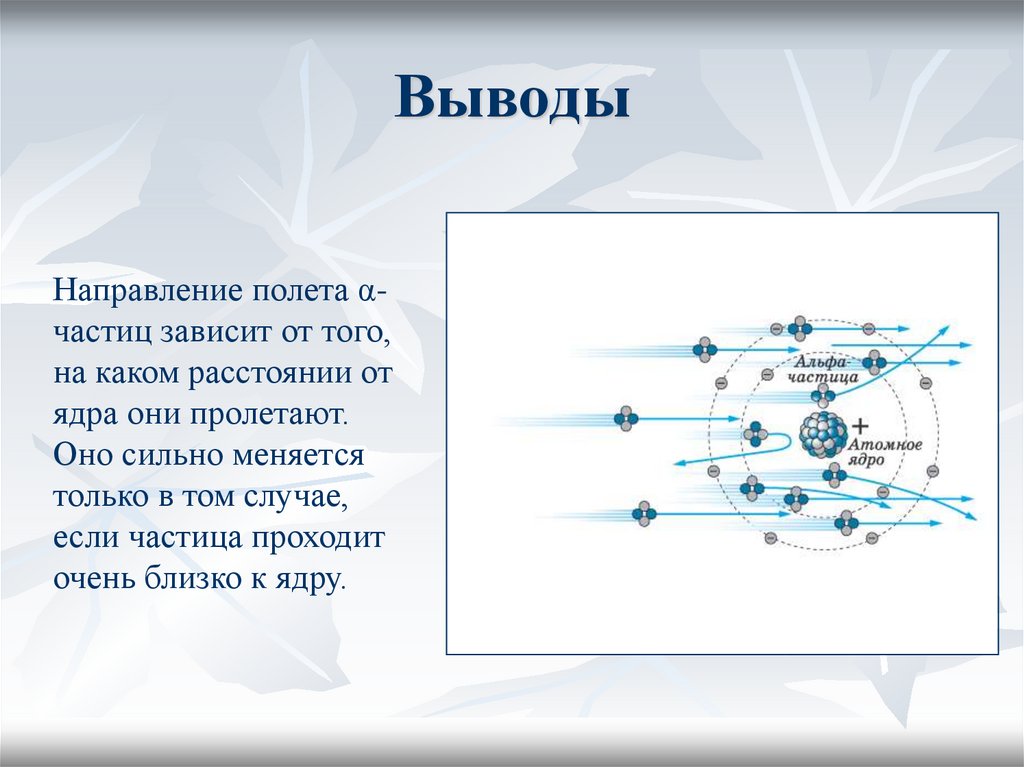
15. Выводы
Направление полета αчастиц зависит от того,на каком расстоянии от
ядра они пролетают.
Оно сильно меняется
только в том случае,
если частица проходит
очень близко к ядру.
16. Выводы
Таким образом, в результате опытов по рассеянию α-частицбыла доказана несостоятельность модели атома Томсона,
выдвинута ядерная модель строения атома и определен
порядок диаметров атомных ядер.
17. Противоречия планетарной модели атома и классической физики
Нельзя объяснить факт существования атома, егоустойчивость. По законам электродинамики Максвелла:
e по орбите с ускорением => излучение ЭМ волн с ν = ν
обращения вокруг ядра => потеря Е => e по спирали к
ядру => время существования e ≈ 10-8 с.
- электрон
+
НО:
АТОМ УСТОЙЧИВ!
18. Первый постулат Бора
Атомная система может находится только в особыхстационарных квантовых состояниях, каждому из
которых соответствует определенная энергия En.
В стационарных состояниях атом не излучает.
-
+
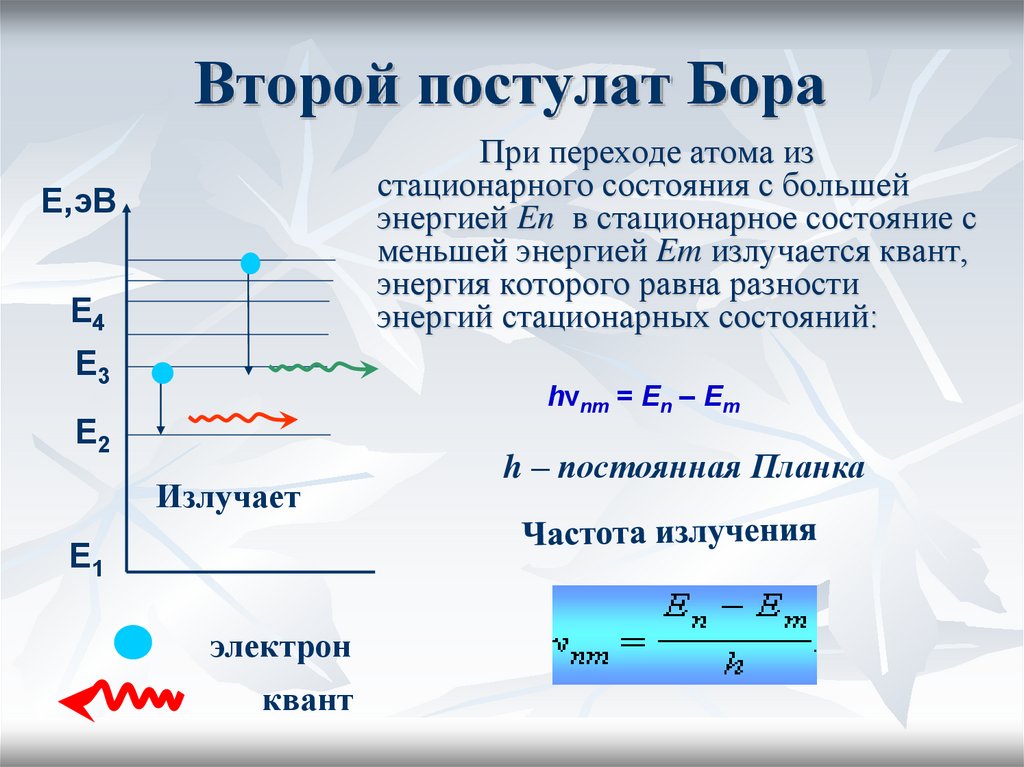
19. Второй постулат Бора
При переходе атома изстационарного состояния с большей
энергией En в стационарное состояние с
меньшей энергией Em излучается квант,
энергия которого равна разности
энергий стационарных состояний:
Е,эВ
Е4
Е3
hνnm = En – Em
Е2
Излучает
Е1
электрон
квант
h – постоянная Планка
20. Второй постулат Бора
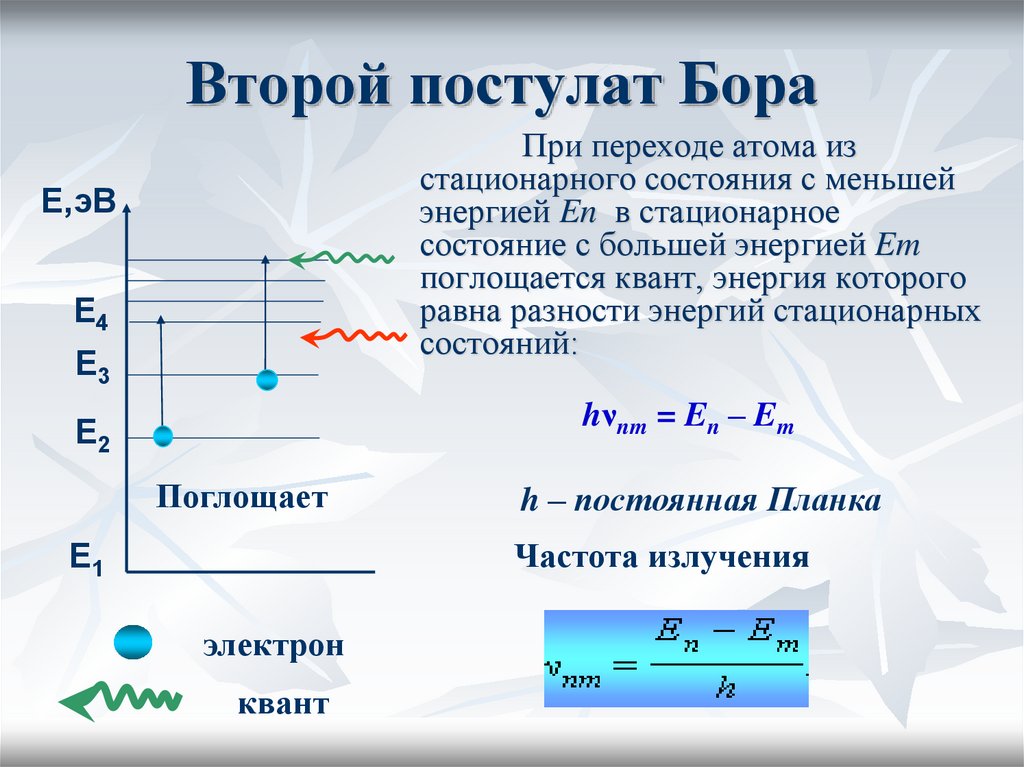
При переходе атома изстационарного состояния с меньшей
энергией En в стационарное
состояние с большей энергией Em
поглощается квант, энергия которого
равна разности энергий стационарных
состояний:
Е,эВ
Е4
Е3
hνnm = En – Em
Е2
Поглощает
h – постоянная Планка
Частота излучения
Е1
электрон
квант
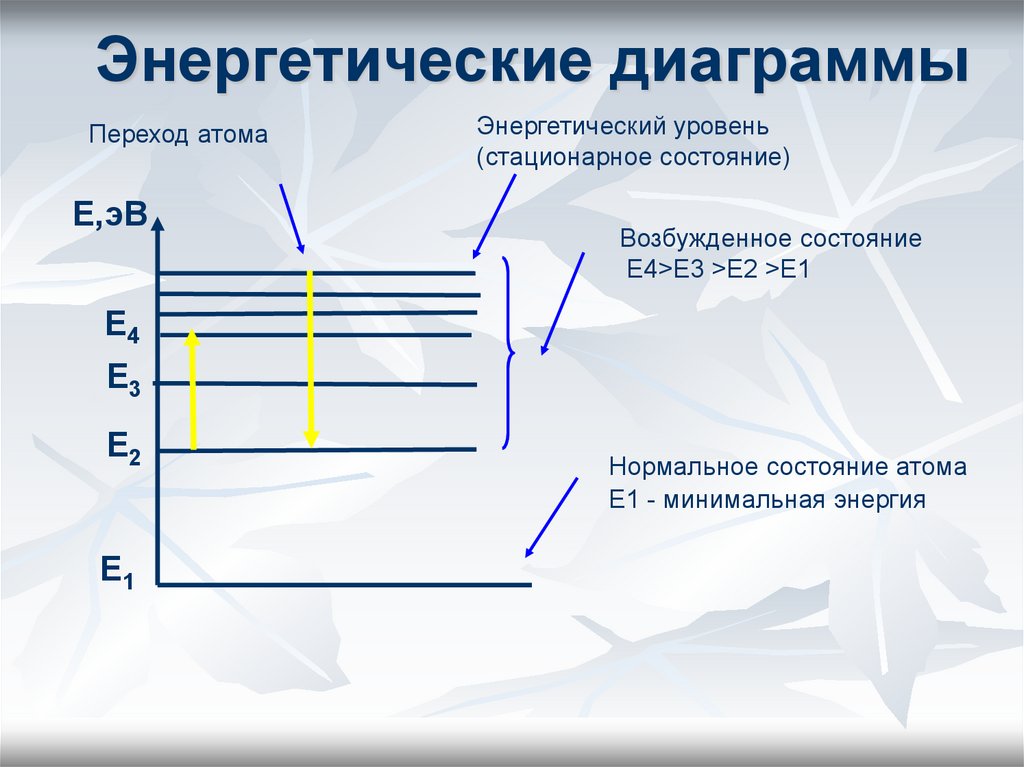
21. Энергетические диаграммы
Переход атомаЕ,эВ
Энергетический уровень
(стационарное состояние)
Возбужденное состояние
Е4>Е3 >Е2 >Е1
Е4
Е3
Е2
Е1
Нормальное состояние атома
Е1 - минимальная энергия
22. Правило квантования Бора
В стационарном состоянии атома электрон, двигаясь покруговой орбите, должен иметь дискретные, квантованные
значения момента импульса
me - масса электрона,
υ – скорость электрона
rn – радиус стационарной круговой
орбиты
Правило квантования Бора позволяет вычислить радиусы
стационарных орбит электрона в атоме водорода и
определить значения энергий
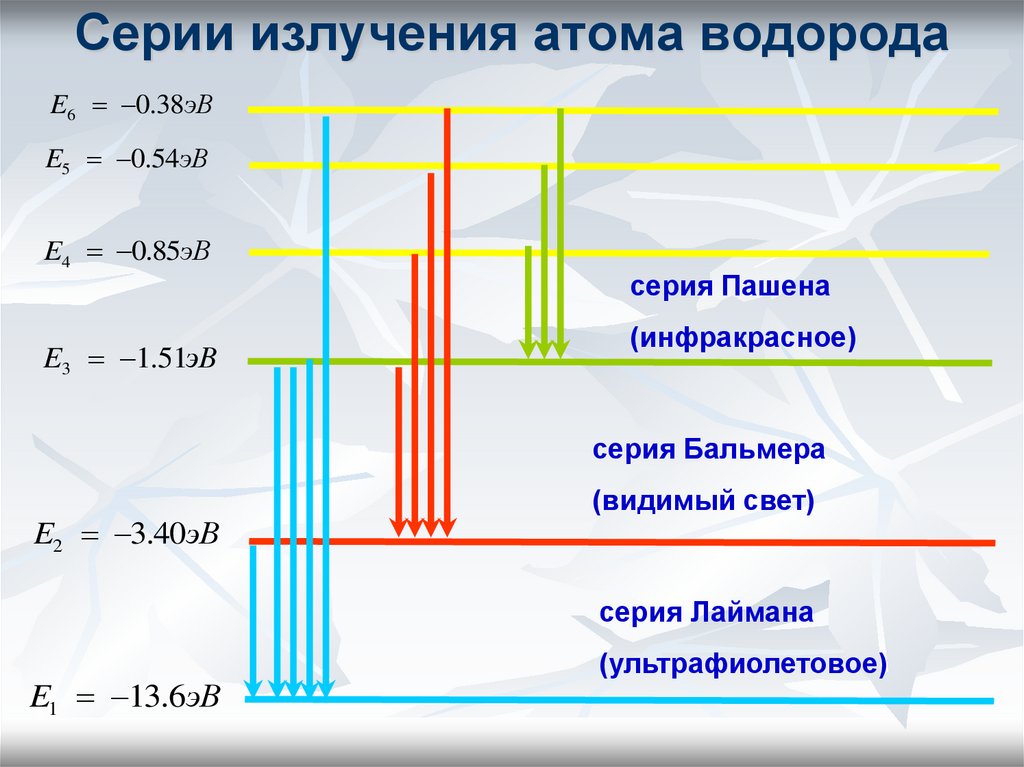
23. Серии излучения атома водорода
E6 0.38эВE5 0.54эВ
E4 0.85эВ
E3 1.51эВ
серия Пашена
(инфракрасное)
серия Бальмера
E2 3.40эВ
(видимый свет)
серия Лаймана
E1 13.6эВ
(ультрафиолетовое)
24. Достоинства теории Бора
Позволила объяснить, почему атомы испускаютлинейчатые спектры и точно предсказать для атома
водорода длины волн испускаемого излучения
Позволила объяснить и спектры поглощения:
столкновение фотона с атомом приводит к переходу
электрона с одного энергетического уровня на другой,
более высокий.
Гарантировала стабильность атомов и позволила
теоретически определить радиус атома водорода.
Точно предсказала энергию ионизации водорода 13,6 эВ.
25. Недостатки теории Бора
На основе теории не удалось количественно объяснитьспектр более сложных атомов (гелия и др.).
Правило квантования Бора применимо не всегда.
Представление об определенных орбитах, по которым
движется электрон в атоме Бора, оказалось условным.



















 Физика
Физика








