Похожие презентации:
Закон сохранения массы веществ. Химические уравнения
1.
Закон сохранения массы веществРоберт Бойль
1627 -1691
Знаменитый английский химик Р. Бойль, прокаливая в открытой реторте различные металлы и
взвешивая их до и после нагревания, обнаружил, что масса металлов становится больше.
Основываясь на этих опытах, он не учитывал роль воздуха и сделал неправильный вывод, что
масса веществ в результате химических реакций изменяется. Р. Бойль утверждал, что
существует какая-то «огненная материя», которая в случае нагревания металла соединяется с
металлом, увеличивая массу.
2.
Закон сохранения массы веществМ. В. Ломоносов
1711 -1765
М. В. Ломоносов в отличие от Р. Бойля прокаливал металлы не на открытом воздухе,
а в запаянных ретортах и взвешивал их до и после прокаливания. Он доказал, что
масса веществ до и после реакции остается неизменной и что при прокаливании к
металлу присоединяется какая-то часть воздуха.
3.
Закон сохранения массы веществМ. В. Ломоносов
1711 -1765
Результаты этих опытов он не опубликовал, хотя и сформулировал в виде закона в
письме (1748): «Все перемены, в натуре случающиеся, такого суть состояния,
что сколько чего у одного тела отнимается, столько присовокупится к другому».
4.
Закон сохранения массы веществНезависимо от М. В. Ломоносова закон сохранения
массы в 1789 году открыл французский химик Антуан
Лавуазье .
Масса веществ, вступивших в химическую реакцию, равна
массе образовавшихся веществ.
5.
Закон сохранения массы веществС точки зрения атомно-молекулярного учения закон сохранения массы объясняется
так: в результате химических реакций атомы не исчезают и не возникают, а
происходит их перегруппировка. Так как число атомов до реакции и после
остается неизменным, то их общая масса также не изменяется.
6.
Закон сохранения массы веществКаково значение закона сохранения массы веществ?
Открытие закона сохранения массы веществ способствовало дальнейшему развитию химии как науки.
На основании закона сохранения массы веществ производят практически важные расчеты.
Например, можно вычислить, сколько потребуется исходных веществ,
чтобы получить сульфид железа(II) массой 44 кг, если железо и сера
вступают в реакцию в массовых отношениях 7:4. Согласно закону
сохранения массы веществ при взаимодействии железа массой 7 кг и
серы массой 4 кг образуется сульфид железа(II) массой 11 кг. А так как
не-обходимо получить сульфид железа(II) массой 44 кг, т. е. в 4 раза
больше, то и исходных веществ также потребуется в 4 раза больше:
28 кг железа (7 • 4) и 16 кг серы (4 • 4).
На основе закона сохранения массы веществ составляют
уравнения химических реакций.
7.
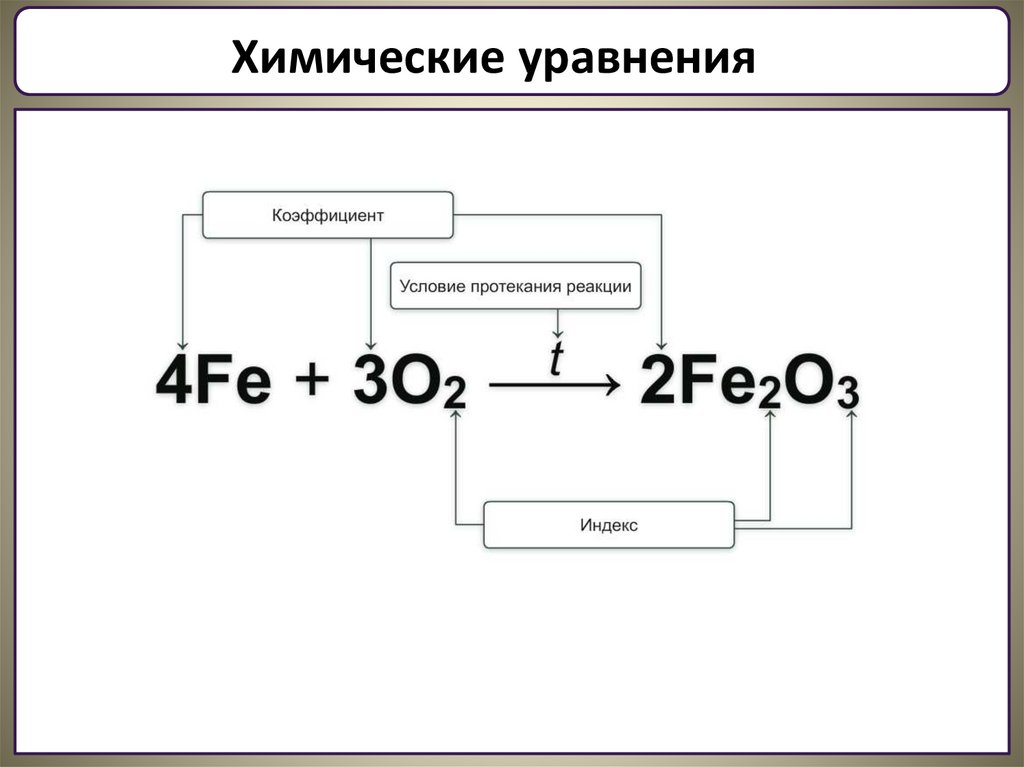
Химические уравненияУравнение химической реакции – это условная запись химического
процесса, посредством химических знаков и формул.
Пример:
N2 + H2
t0C кат.
NH3
- реагирующие вещества
- продукты реакции
- взаимодействие
- условие протекания реакции
8.
Химические уравнения9.
Составление химических реакцийПример: Составить уравнение реакции взаимодействия
фосфора и кислорода.
9. Определи: есть ли еще не уравненные (не соединенные)
1. В
3.
Определи:
левой части
атомов,
уравнения
какогозапиши
элемента
формулы
в левой веществ,
части уравнения
которые
атомы:
2. Определи
4.
5.
В правой фигурной
Соедини
части
Н.О.К.
уравнения
чисел
стрелкой
атомов
запиши
атомы
в левой
формулы
этого
и правой
элемента
веществ
частях
в левой и
вступают
больше.
6.
7.
8.
Раздели
Запиши
(Вначале
вполученный
Н.О.К.
реакцию.
вна
уравнивают
квадратике
число
(Формулы
коэффициент
атомов
число
под
простых
каждого
стрелкой.
атомов,
перед
газообразных
соединенного
формулой.
которых в веществ
левой
элемента.
части
образующихся
правой
частях.
в вернись
результате
реакции.
а)уравнения.
Если
есть,
то
к
пункту
3.
состоят из двух
уравнения
больше.)
атомов: Н2, О2, N2, Cl2 и.т.д.)
б) Если нет, то ВСЁ.
4 :1= 4
4P
4
4 : 4 = 1
+ 5 O2 = 2 P2O5
10 : 2 = 5
10
10 : 5 = 2
10.
Домашнее задание§19,20. стр.65 тест 1-2, стр.67 №3









 Химия
Химия








