Похожие презентации:
Периодический закон в свете учения о строении атома. Лекция 1
1. Основы строения вещества
КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ СПБГЭТУОСНОВЫ СТРОЕНИЯ ВЕЩЕСТВА
ПЕРИОДИЧЕСКИЙ ЗАКОН
В СВЕТЕ УЧЕНИЯ О СТРОЕНИИ АТОМА
ОСЕННИЙ СЕМЕСТР 2016-2017 УЧ.ГОД.
2. Известные к середине 19в. элементы
ЭлементАтомный
вес
Элемент
Атомный
вес
Азот
Алюминий
Барий
14.008
26.98
137.36
Натрий
Никель
Ниобий
22.991
58.71
92.91
Бериллий
Бор
Бром
Ванадий
Висмут
Водород
Вольфрам
Железо
Золото
Иридий
Иттрий
Иод
Кадмий
Калий
Кальций
Кислород
Кобальт
Кремний
Литий
Магний
Марганец
Медь
Молибден
Мышьяк
9.013
10.82
79.916
50.95
209.00
1.0080
183.86
55.85
197.0
192.2
88.92
126.91
112.41
39.100
40.08
16.0000
58.94
28.09
6.940
24.32
54.94
63.54
95.95
74.91
Олово
Осмий
Палладий
Платина
Родий
Ртуть
Свинец
Селен
Сера
Серебро
Стронций
Сурьма
Тантал
Теллур
Титан
Торий
Углерод
Уран
Фосфор
Хлор
Хром
Церий
Цинк
Цирконий
118.70
190.2
106.4
195.09
102.91
200.61
207.21
78.96
32.066
107.88
87.63
121.76
180.95
127.61
47.90
232.05
12.011
238.07
30.975
35.457
52.01
140.13
65.38
91.22
ИТОГО: 54 элемента
3.
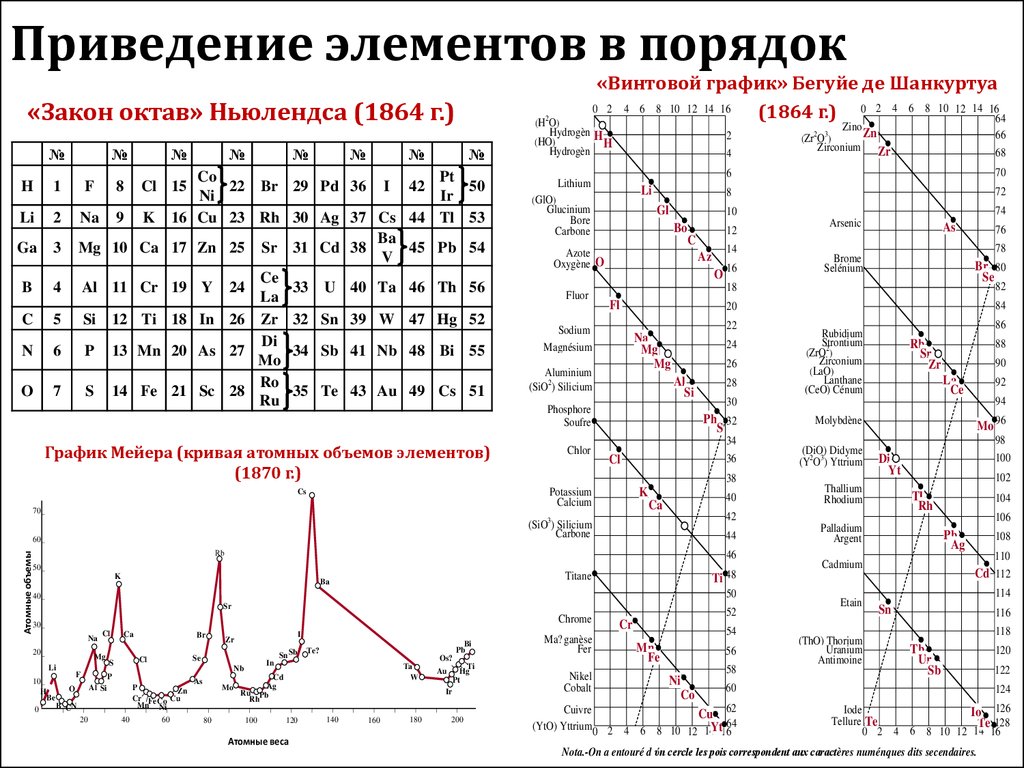
Приведение элементов в порядок«Закон октав» Ньюлендса (1864 г.)
№
H
№
1
F
2
Na
Ga
3
Mg 10
4
C
Si
6
O
9
Al 11
5
N
№
№
№
Co
Cl 15
22 Br 29 Pd 36 I
Ni
K 16 Cu 23 Rh 30 Ag 37 Cs
Ba
Ca 17 Zn 25 Sr 31 Cd 38
V
Ce
Cr 19 Y 24
33 U 40 Ta
La
Ti 18 In 26 Zr 32 Sn 39 W
Di
Mn 20 As 27
34 Sb 41 Nb
Mo
Ro
Fe 21 Sc 28
35 Te 43 Au
Ru
8
Li
B
№
12
P
7
13
S
14
«Винтовой график» Бегуйе де Шанкуртуа
0 2 4 6 8 10 12 14 16
(1864 г.) 0 2 4 6 8 10 12 14 1664
2
(H O)
№
№
Pt
42
50
Ir
44 Tl 53
Hydrogèn H
H
Hydrogèn
e
Lithium
Glucinium
Bore
e
Carbone
49 Cs 51
Gl
Fluor
e
Bo
Na
Mg
Mg
26
Al
Si
Атомные объемы
28
30
Ph 32
S
34
36
Cl
38
K
40
Ca
44
46
K
Ti 48
Titane
Ba
50
40
Sr
Chrome
30
Na
20
Cl
Mg
Li
F
Ca
In
Nb
P
P
Zn
Cr Fe Co Cu
Mn Ni
Be
B CN
20
Zr
Se
Cl
S
Al Si
O
Br
I
40
60
As
Mo
80
Sn Sb
Bi
Pb
Te?
Os?
Ta
W
Cd
Ag
Ru Pb
Rh
100
Ti
Hg
Pt
Au
Ir
120
Атомные веса
140
160
180
200
Ma? ganèse
Fer
Nikel
Cobalt
74
Arsenic
As
76
78
Brome
Selénium
Br 80
Se
82
84
86
Rubidium
Strontium
2
(ZrO )
Zirconium
(LaO)
Lanthane
(CeO)
e Cénum
Rb
Sr
Zr
52
Cr
54
Mn
Fe
56
58
Ni
88
90
La
Ce
(DiO) Didyme
(Y2O3) Yttrium
Mo 96
98
100
Di
Yt
Thallium
Rhodium
102
Tl
Rh
Palladium
Argent
(ThO) Thorium
Uranium
Antimoine
104
106
Pb
Ag
Cadmium
Etain
92
94
Molybdène
42
(SiO ) Silicium
Carbone
50
0
16
24
Rb
10
H
72
20
3
60
8
22
Potassium
Calcium
70
66
68
Zr
18
Fl
Phosphore
Soufre
Cs
Zn
Zirconium
70
14
O
Aluminium
(SiOe2) Silicium
Chlor
Zino
6
12
C
Az
Sodium
Magnésium
График Мейера (кривая атомных объемов элементов)
(1870 г.)
2 3
(Zr O )
10
Azote
Oxygène O
46 Th 56
48 Bi 55
Li
(GlO)
45 Pb 54
47 Hg 52
2
4
(HOe)
108
110
Cd 112
114
Sn
116
118
Tb
Ur
Sb
120
122
60
124
Cuivre
Cu 62
(YtO) Yttrium 0 2 4 6 8 10 12 14Yt1664
Iode
Io 126
Tellure Te
Te 128
0 2 4 6 8 10 12 14 16
Co
Nota.-On a entouré d ύn cercle les pois correspondent aux caractères numénques dits secendaires.
4.
Приведение элементов в порядок1869 г. – статья в «Журнале русского
химического общества»
Д.И. Менделеев впервые подробно изложил
основы Периодической системы элементов
H=1
Ag
Cs
-
Ti=50
Zr=90
?=180.
V=51
Nb=94
Ta=182.
Cr=52
Mo=96
W=186.
Mn=55
Rh=104,4
Pt=197,4
Fe=56
Ru=104,4
Ir=198.
Ni=Co=59
Pl=106
Os=199.
Cu=63,4
Ag=108
Hg=200.
Be=9,4
Mg=24
Zn=65,2
Cd=112
B=11
Al=27,4
?=68
Ur=116
C=12
Si=28
?=70
Sn=118
204
N=14
P=31
As=75
Sb=122
Na
K
Cu
Rb
7
23
36
63,4
85,4
Be
Mg
Ca
Zn
Sr
Cd
Ba
-
Pb
O=16
S=32
Se=79,4
Te=128?
B
Al
-
-
-
Ur
-
-
Bi
F=19
Cl=35,5
Br=80
I=127
C
Si
Ti
-
Zr
Sn
-
-
-
Na=23
K=39
Rb=85,4
Cs=133
Tl=204
N
P
V
As
Nb
Sb
-
Ta
-
Ca=40
Sr=87,6
Ba=137
Pb=207
O
S
-
Se
-
Te
-
W
-
?=45
Ce=92
F
Cl
-
Br
-
J
-
-
-
?Er=56
La=94
?Yt=60
Di=95
19
35,5
58
80
190
?In=75,4
Th=118?
108 133
Tl
Au=197?
Li
127 160 190 220
Li=7
Bi=210
5.
Периодический закон Д.И. Менделеева«Свойства
простых тел, а так же
формы и свойства соединений
элементов находятся в прямой
зависимости от атомных весов
элементов»
6.
Строение атомаАтом – мельчайшая неделимая частица вещества
В 1911 г. – планетарная модель
V век до нашей эры
… Размещение электронов на стационарных
орбитах было очень важным шагом в
понимании строения атома…
Э. Резерфорд
противоречие с классической механикой:
…при движении электрона по орбите он
должен был терять потенциальную
энергию и в конце концов "упасть" на
ядро и атом должен был прекратить свое
существование…
Демокрит
В 1913 г. – постулаты Бора
• электрон двигается по стационарным орбитам
вокруг ядра
• при нормальных условиях не поглощал и не
испускал энергию.
Н. Бор
1920 -е годы –
Л. де Бройль, В. Гейзенберг, Э. Шреденгер, П. Дирак
7. Строение атома
Атом – сложная электромагнитная система, включающаяэлементарные частицы - нуклоны (протоны, нейтроны)
Частица
Символ
Масса, а.е.м
Масса, г
Заряд, e
и электроны
10-11, м
Протон
Нейтрон
Электрон
Позитрон
11p
10n
ee+
1.0073
1.0087
0.00055
0.00055
1.67·10-24
1.67·10-24
9.1·10-28
9.1·10-28
+1
0
-1
+1
Ядро (протоны и нейтроны) –
определяют массу атома, заряд ядра и
радиоактивные свойства
10-15, м
Электроны – определяют химические свойства
Изотопы – разновидности атомов одного и того же химического элемента ,
различающиеся массовыми числами, но имеющие одинаковый заряд ядра
Устойчивость атомного ядра:
«число нейтронов/число протонов»
Легкие элементы: ~ 1
Тяжелые элементы: ~ 1.6
8. Квантово-механическая модель атома
1924 г.h
mV
…волновые и корпускулярные свойства
квантовой частицы фундаментальным образом
взаимосвязаны…
Л. де Бройль
1927 г.
Принцип неопределенности
h
х V
m
В. Гейзенберг
9. Квантово-механическая модель атома
2 2 2 8 2m E U 0h
x2 y2 z2
Уравнение Шредингера
2
(x,y,z)
Величина, пропорциональная вероятности нахождения
электрона в некотором объеме, окружающем точку с
координатами x, y, z. Электронная плотность
Область пространства, в которой вероятность нахождения электрона
составляет не менее 95%, называется
атомной орбиталью, она характеризуется определенной формой и
расстоянием от ядра
Состояние электрона в атоме полностью определяется четырьмя квантовыми
числами, три из которых (n, l, ml) характеризуют электронную орбиталь, а
четвертое (ms) – собственный момент электрона
10. Квантовые числа
Квантовоечисло
Принимаемые
значения
Характеризуемое
свойство
Примечание
Главное (n)
1, 2, 3, …, ∞
Энергия (E) уровня
Среднее расстояние от
ядра
n=∞ - отсутствует
взаимодействие с
ядром. E = 0
Орбитальное
(l)
0, 1, …, (n-1)
Всего n значений
для данного n
Орбитальный момент
количества движения –
форма орбитали
Обычно используются
буквенные символы:
l: 0 1 2 3 4
spdfg
Магнитное
(ml)
-l, …,0, …, +l
Всего 2l+1
значение для
данного l
Ориентация момента
количества движения –
расположение орбитали
в пространстве
При помещение в
магнитное поле
орбитали с разными
ml имеют разную
энергию
Спиновое (ms)
±1/2
Ориентация
собственного
магнитного момента
электрона
Обозначают ↑ или ↓
Не зависит от
свойств орбитали
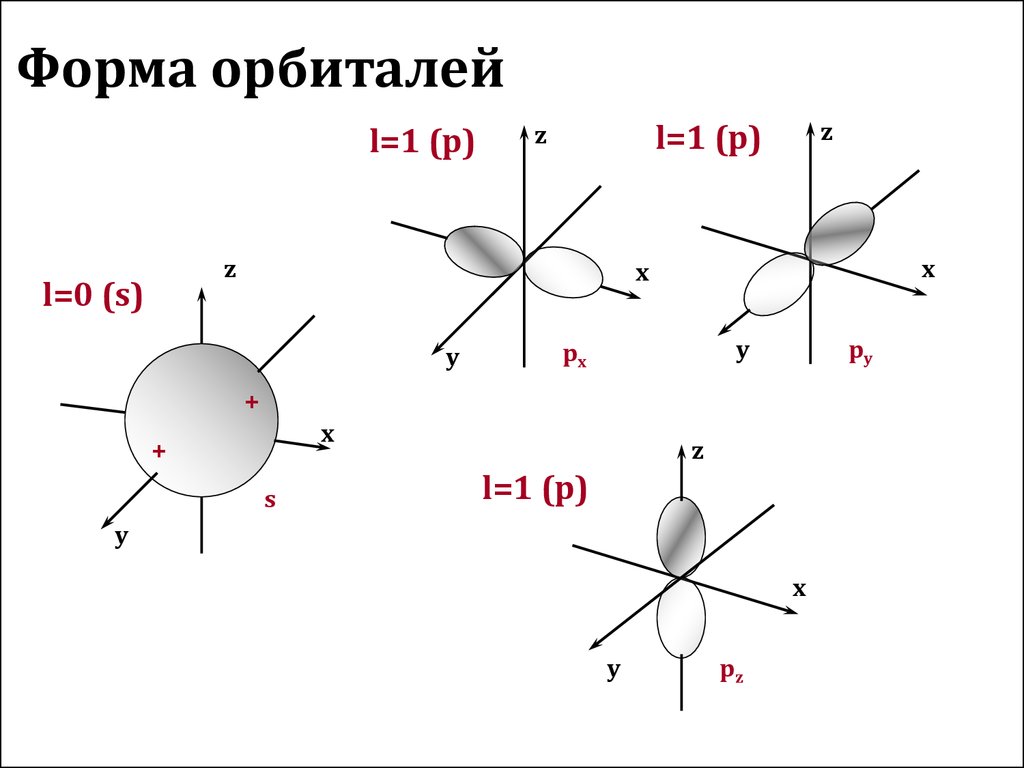
11. Форма орбиталей
l=1 (p)z
l=0 (s)
z
l=1 (p)
z
x
x
y
y
px
py
+
x
+
s
z
l=1 (p)
y
x
y
pz
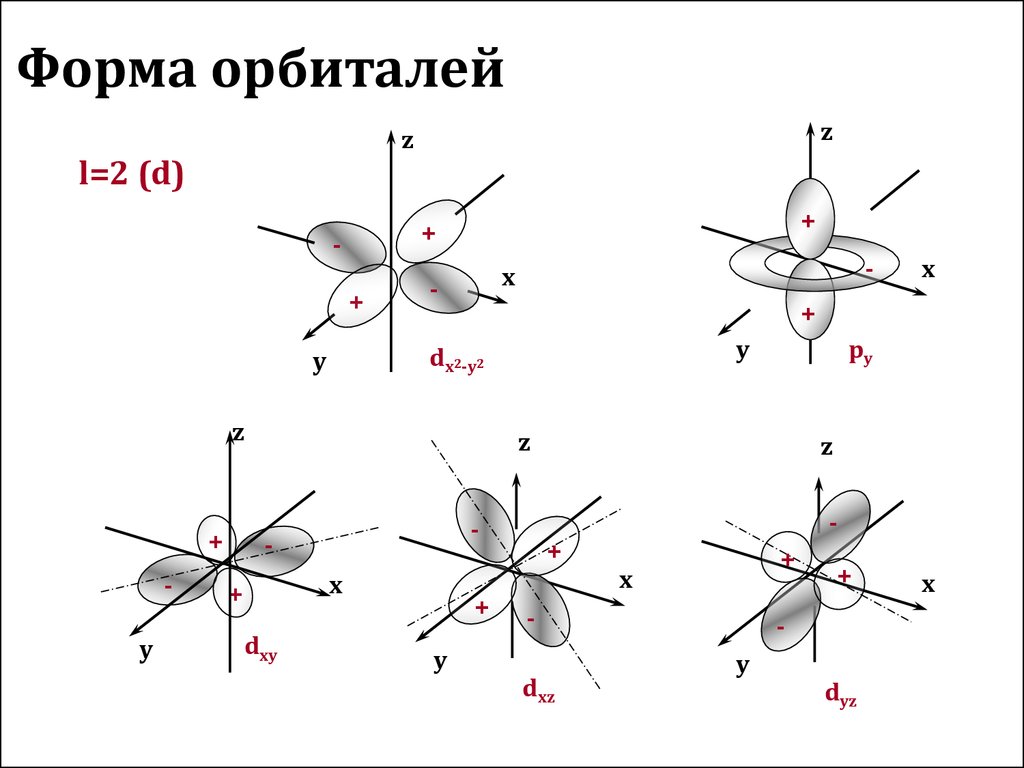
12. Форма орбиталей
zz
l=2 (d)
+
+
+
-
z
y
y
py
z
-
x
+
dxy
+
y
x
+
dx2-y2
y
+
-
x
z
+
-
+
x
dxz
+
y
dyz
x
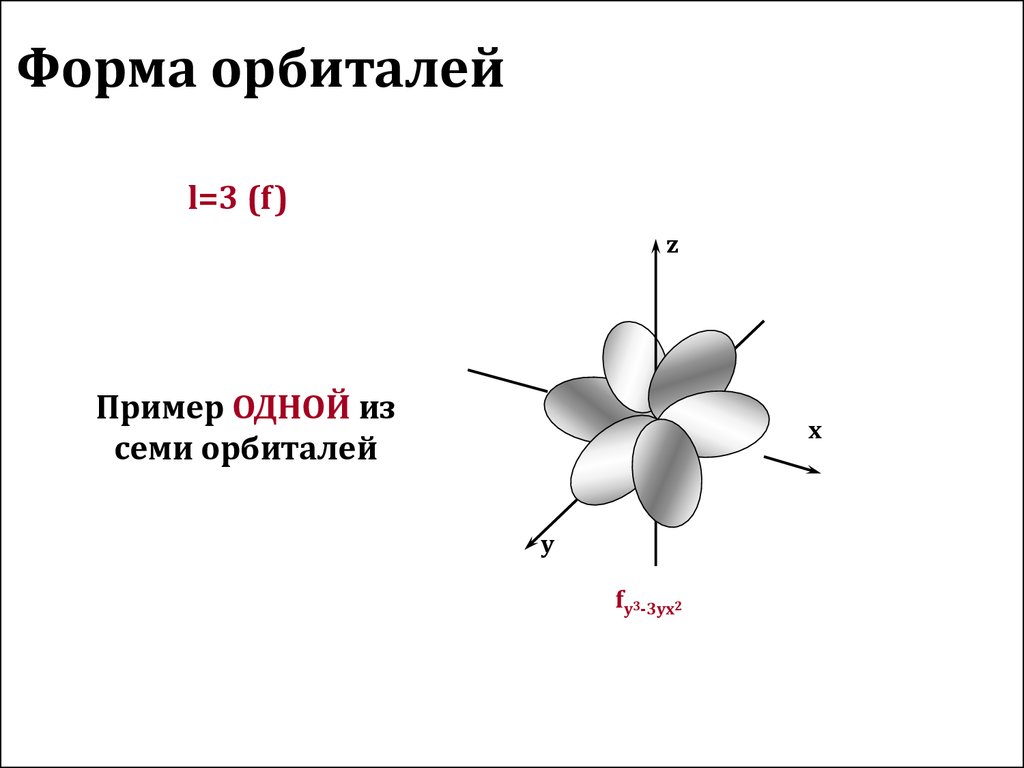
13. Форма орбиталей
l=3 (f)z
Пример ОДНОЙ из
семи орбиталей
x
y
fy3-3yx2
14. Основные принципы заполнения орбиталей электронами
Zэфф – на электрон внешнего уровня действует зарядменьшего истинного заряда ядра
1.
2.
В многоэлектронном атоме подуровни имеют различную
энергию. Для одноэлектронного приближения их
распределение по энергиям показано далее…
Зависимость энергии орбитали от заряда ядра носит
сложный немонотонный характер
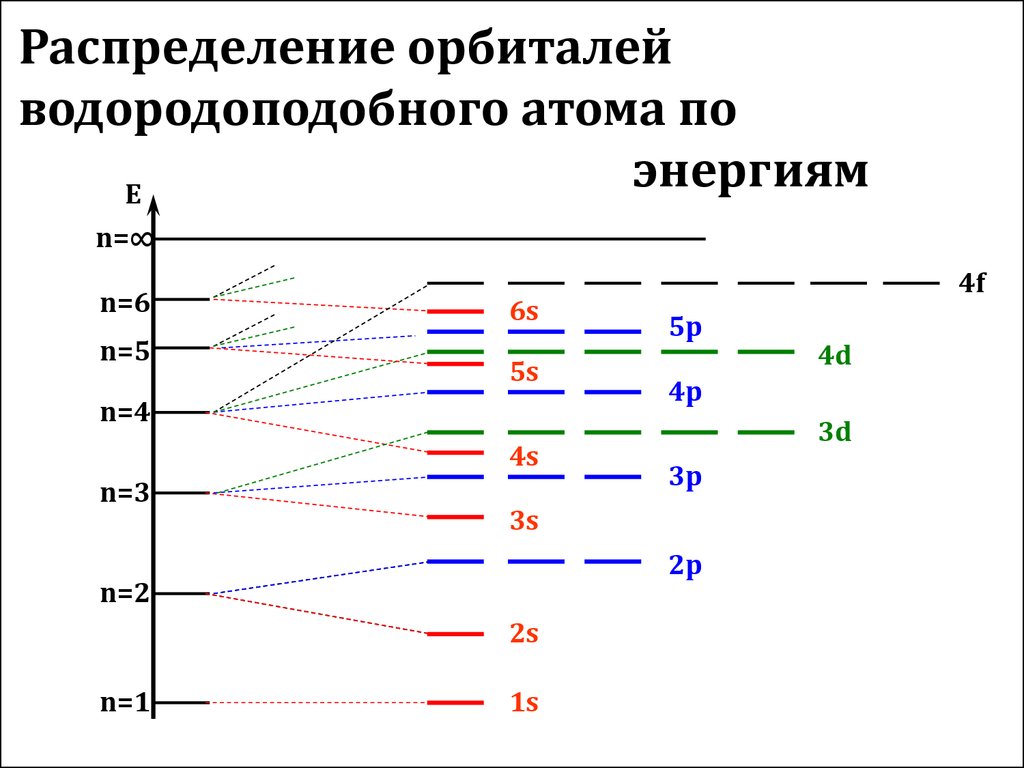
15. Распределение орбиталей водородоподобного атома по энергиям
En=∞
n=6
n=5
6s
5s
n=4
4s
n=3
5p
3d
3p
2p
2s
1s
4d
4p
3s
n=2
n=1
4f
16. Основные принципы заполнения орбиталей электронами
1. Принцип наименьшей энергииВ многоэлектронном атоме стабильной является такая
конфигурация, для которой достигается минимум полной
энергии. В первую очередь заполняются орбитали с
наименьшей энергией, т.е. выполняется
последовательность:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<6d<5f
Энергия орбиталей увеличивается в порядке возрастания
суммы квантовых чисел n+l, а при одинаковой сумме этих
чисел – в порядке возрастания главного квантового числа
(Правило Клечковского)
17. Основные принципы заполнения орбиталей электронами
2.Принцип Паули
В атоме не существует двух электронов, состояние которых
описывается одинаковым набором квантовых чисел (n, l, ml, ms).
Следовательно на одной орбитали (она характеризуется тремя
квантовыми числами (n, l, ml) может находится не более двух
электронов с разными значениями спинового квантового числа
(↑и ↓).
3.
Правило Хунда
В пределах одного подуровня (т.е. на орбиталях с одним и тем же
значением l) Электроны распределяются так, чтобы
суммарный спин (Σms) был максимален.
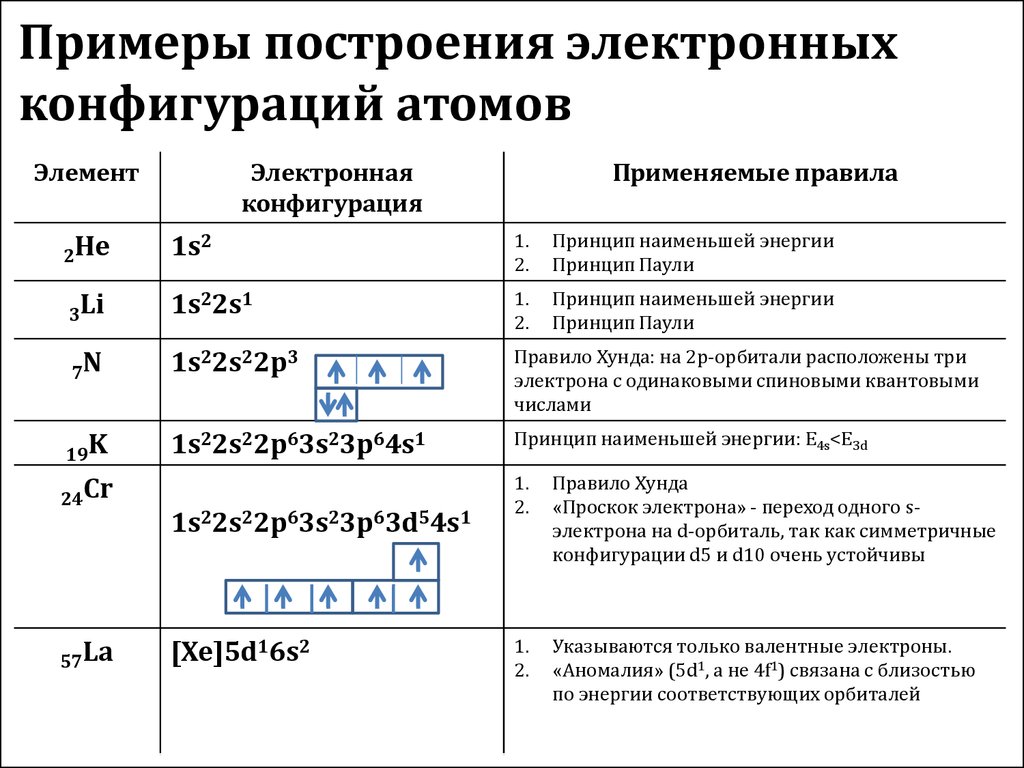
18. Примеры построения электронных конфигураций атомов
ЭлементЭлектронная
конфигурация
Применяемые правила
2He
1s2
1.
2.
Принцип наименьшей энергии
Принцип Паули
3Li
1s22s1
1.
2.
Принцип наименьшей энергии
Принцип Паули
7N
1s22s22p3
Правило Хунда: на 2p-орбитали расположены три
электрона с одинаковыми спиновыми квантовыми
числами
19K
1s22s22p63s23p64s1
Принцип наименьшей энергии: E4s<E3d
24Cr
57La
1s22s22p63s23p63d54s1
[Xe]5d16s2
1.
2.
Правило Хунда
«Проскок электрона» - переход одного sэлектрона на d-орбиталь, так как симметричные
конфигурации d5 и d10 очень устойчивы
1.
2.
Указываются только валентные электроны.
«Аномалия» (5d1, а не 4f1) связана с близостью
по энергии соответствующих орбиталей
19. Основные характеристики атомов
Размер атома
Энергетические характеристики, включая
потенциал ионизации и сродство к
электрону
Спектральные характеристики
(спектры испускания и поглощения)
Магнитные свойства
20. Атомные радиусы
Ван-дер-Ваальсов радиус (rв)d
Ковалентный радиус (rк)
b
rв=d/2
Металлический радиус (rв)
b – длина связи
Ионные радиусы
-
-
b
-
r-=a/2
+
d
rм=d/2
a
r+=b-a/2
21. Потенциал ионизации
Минимальная энергия, которую необходимозатратить для удаления электрона из атома,
находящегося в основном состоянии
X → X++ eI1< I2< I3… <In
- ПЕРВЫЙ ПОТЕНЦИАЛ ИОНИЗАЦИИ (I1)
Сродство к электрону
Способность атома присоединять электрон с
образованием отрицательно заряженного иона
количественно характеризуется изменением
энтальпии (энергии) процесса X + e- →X- СРОДСТВО К ЭЛЕКТРОНУ(Ae)
22. Магнитный момент
μэфф – Эффективный магнитный моментZ<30 – основной вклад: собственный магнитный
эфф 2 S ( S 1)
момент электрона ф
S ms – суммарный спин атома
Т.к. в суммарный спин атома вклад вносят только
неспаренные электроны (n), то
эфф 2 n(n 2)
Z>>30 – основной вклад: спин-орбитальное
взаимодействие
μэфф =0 (атом или ион, все электроны которого спарены)
ДИАМАГНЕТИК
μэфф ≠0 (атом или ион, имеющий неспаренные электроны)
ПАРАМАГНЕТИК
23.
Периодический законД.И. Менделеева
Li
Na
K
Cu
Rb
Ag
Cs
7
23
36
63,4
85,4
Be
Mg
Ca
Zn
Sr
Cd
Ba
B
Al
-
-
-
Ur
C
Si
Ti
-
Zr
N
P
V
As
O
S
-
F
Cl
19
35,5
-
108 133
Tl
204
Ti=50
Zr=90
?=180.
-
Pb
V=51
Nb=94
Ta=182
-
-
Bi
Cr=52
Mo=96
W=186
Sn
-
-
-
Mn=55
Rh=104,4
Pt=197,4
Nb
Sb
-
Ta
-
Fe=56
Ru=104,4
Ir=198
Se
-
Te
-
W
-
Ni=Co=5
9
Pl=106
Os=199
-
Br
-
J
-
-
-
Cu=63,4
Ag=108
Hg=200.
58
80
190
H=1
127 160 190 220
«Свойства
простых тел, а
так же формы и свойства
соединений элементов
находятся в прямой
зависимости от атомных
весов элементов»
Li=7
Be=9,4
Mg=24
Zn=65,2
Cd=112
B=11
Al=27,4
?=68
Ur=116
C=12
Si=28
?=70
Sn=118
N=14
P=31
As=75
Sb=122
O=16
S=32
Se=79,4
Te=128?
F=19
Cl=35,5
Br=80
I=127
Na=23
K=39
Rb=85,4
Cs=133
Tl=204
Ca=40
Sr=87,6
Ba=137
Pb=207
?=45
Ce=92
?Er=56
La=94
?Yt=60
Di=95
?In=75,4
Th=118?
1869 г. – статья в журнале Русского Химического общества»
Au=197?
Bi=210
24.
Периодический законД.И. Менделеева
«Свойства
простых тел, а так же формы и свойства
соединений элементов находятся в прямой
зависимости от атомных весов элементов»
1869 г. – статья в «Журнале русского химического общества»
«Свойства простых веществ, а так же
формы и свойства соединений
элементов находятся в
периодической зависимости
от заряда ядра атомов элементов»




















 Физика
Физика Химия
Химия








