Похожие презентации:
Практическая работа №1. Анализ почвы пришкольного участка
1.
Практическая работа №1Анализ почвы пришкольного участка
2.
Почва – поверхностный слой литосферы Земли, обладающийплодородием и представляющий собой полифункциональную
гетерогенную открытую четырёхфазную структурную систему,
образовавшуюся в результате выветривания горных пород и
жизнедеятельности организмов.
Состав почвы:
• Твердые частицы
Минеральные: остатки горных пород и минералов, глина, песок, кварц,
окислы железа и алюминия, гипс и прочее.
Органические: перегной (гумус) – остатки растений, животных и
микроорганизмов после их глубокого разложения под влиянием
микроорганизмов), а также продукты жизнедеятельности живых организмов.
• Почвенный раствор – вода с растворенными в ней солями и воздухом и
с содержащимися в ней микроорганизмами.
• Почвенный воздух – богат углекислым газом СО2 и беден кислородом О2
• Живое население
3.
Изменение состава почвы со временемЕстественные изменения
• дробление, выветривание, размывание водой, влияние жизнедеятельности
живых организмов.
Антропогенное влияние - где почва выступает в качестве накопителя
вредных веществ.
• Загрязнение ядовитыми компонентами выхлопных газов транспортных
двигателей, нефтью, смазочными материалами, обмывочными водами,
металлической и синтетической пылью.
• Развитие сельского хозяйства – внесение в почву минеральных удобрений и
пестицидов.
• Тяжелые металлы, как правило, концентрируются в приповерхностном слое
почвы на глубине 10 – 20 см. Накопление тяжелых металлов в почве
нарушает физико-химическое равновесие природной системы и дает толчок
ряду процессов, действующих на почвенные свойства. Изменяется величина
рН, разрушается почвенный поглощающий комплекс, нарушаются
микробиологические процессы, в результате разрушения структуры
ухудшается водно - воздушный режим, деградирует почвенный гумус, и в
конечном итоге почва теряет плодородие.
4.
Цель практической работыОпределить актуальную кислотность почвы
и содержание в ней тяжёлых металлов.
5.
Влияние на развитие растений степеникислотности и щелочности почвы
Определяется показателем рН почвенной вытяжки.
• рН = 7 – нейтральная среда. Тяжелые металлы остаются
связанными в почве и незначительно попадают и
накапливаются в растениях.
• рН < 7 – кислая среда. Кислые почвы содержат огромное
количество железа, марганца, алюминия, цинка, меди,
свинца в форме соединений, ядовитых для растений и
являются благоприятным условием для накопления в
растениях тяжелых металлов. Нейтрализуется деятельность
полезных бактерий, участвующих в накоплении азота
растениями, а также разложении торфа, компостов и прочих
местных удобрений.
В результате пищевых цепей тяжелые металлы
попадают и накапливаются в организме человека!
6.
Зависимость кислотности почвы от рНрН
Степень кислотности почв
Меньше 4,5
Сильнокислые почвы
4,5 – 5,0
Среднекислые почвы
5,0 – 6,0
Слабокислые почвы
6,0 – 7,0
Близкие к нейтральным
7,0
Нейтральные почвы
Больше 8,0
Щелочные почвы
7.
Подвижность микроэлементов взависимости от кислотности почвы
Реакция
почвы
Pb
Cu
Zn
Hg
Ni
Со
Кислая
СП
П
П
П
СП
СП
Нейтральная
ПН
СП
П
СП
СП
СП
Щелочная
ПН
СП
СП
ПН
ПН
ПН
ПН – практически неподвижные; СП – слабоподвижные; П - подвижные
8.
Анализ почвы — совокупность операций, выполняемых сцелью определения состава, физико-механических, физикохимических, химических, агрохимических и биологических
свойств почвы.
Почвенная вытяжка - экстракт, полученный после обработки
почвы раствором заданного состава, действовавшим на почву
определенное время при определенном соотношении почва раствор.
• Водная вытяжка – фильтрат водного раствора, полученного
после взбалтывания почвы с дистиллированной водой.
• Кислотная вытяжка - фильтрат от обработки почвы какой-либо
кислотой, взятой в определенной концентрации и в
определенном соотношении с почвой и взаимодействующей с
ней заданное время.
• Солевая вытяжка - вытяжка, полученная в результате
взаимодействия раствора соли с почвой.
9.
Токсическое действие тяжелых металлов –цинка, никеля и железа на организм
человека
Избыток ЦИНКА вызывает аллергические реакции,
расстройство желудочно – кишечного тракта, почечный
стресс, хронический бронхит, снижение функции легких, рак
легких.
Избыток НИКЕЛЯ нарушает усвоение фосфора организмом,
способствует развитию остеопороза, конъюнктивита,
дерматита, малокровия, вызывает расстройство
желудочно - кишечного тракта.
Избыток ЖЕЛЕЗА может вызывать гемосидероз печени,
поражать сердце, вызывать рак!
10.
Ход работы.Подготовка почвенных вытяжек.
• Взять образцы почвы с пришкольного участка с глубины 10 – 20 см.
• Высушить отобранные образцы почвы в сушильном шкафу (при
температуре 40 - 60С) или на воздухе, расположив почву в кювете слоем
толщиной не более 2 см. Предварительно удалив посторонние примеси и
частицы при помощи набора сит с отверстиями разного диаметра от 5 до 1
мм.
• Поместить образец почвы в стакан и прилить дистиллированной воды (в
отношении почва – вода 1:2) для получения водной вытяжки, или же 1М
раствора азотной кислоты (в отношении почва – азотная кислота 1:3) для
получения кислотной вытяжки и перемешать стеклянной палочкой в
течение 3 – 5 минут.
• Отфильтровать содержимое стакана (сбросив первые
капли фильтрата – могут содержать примеси с фильтра).
• Определить актуальную кислотность почвы (рН водной
вытяжки) и обнаружить ионы тяжелых металлов
(кислотная вытяжка) в фильтратах.
11.
Определение актуальной кислотности почвы(рН водной вытяжки)
• При помощи цифровой лаборатории RELAB и
программы Relablite для работы с датчиком рН
• При помощи тест - системы
12.
Обнаружение ионов тяжелых металлов в почве(кислотная вытяжка): Fe³+ Zn²+ Ni2+
• При помощи тест – систем
• Проведение качественных реакций на ион Fe³+
Ионы железа +3 определяют реакцией с роданидом калия.
Образуется раствор кроваво-красного цвета – комплексная соль
гексароданоферрат (III) калия:
FeCl3 + 6KCNS = K3[Fe(CNS)6] ↓ +3 KCl – кроваво-красный раствор.
Также ионы железа +3 дают характерное синее окрашивание с
желтой кровяной солью – образуется берлинская лазурь
гексацианоферрат железа калия
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] ↓+ 3KCl – осадок синего цвета
Берлинская лазурь
13.
Подведение итогов.Анализ почвы пришкольного участка
Измеряемые
параметры
Значение/наличие
в почвенной вытяжке
рН
Fe³+
Zn²+
Ni2+
14.
Практическая работа №2.Изучение процессов кипения
воды
15.
Цель работы• Сравнить температуры кипения воды при измерении
различными приборами.
• Выявить зависимость температуры нагревания воды от высоты
положения термометра в сосуде.
• Рассмотреть зависимость температуры кипения от
давления.
16.
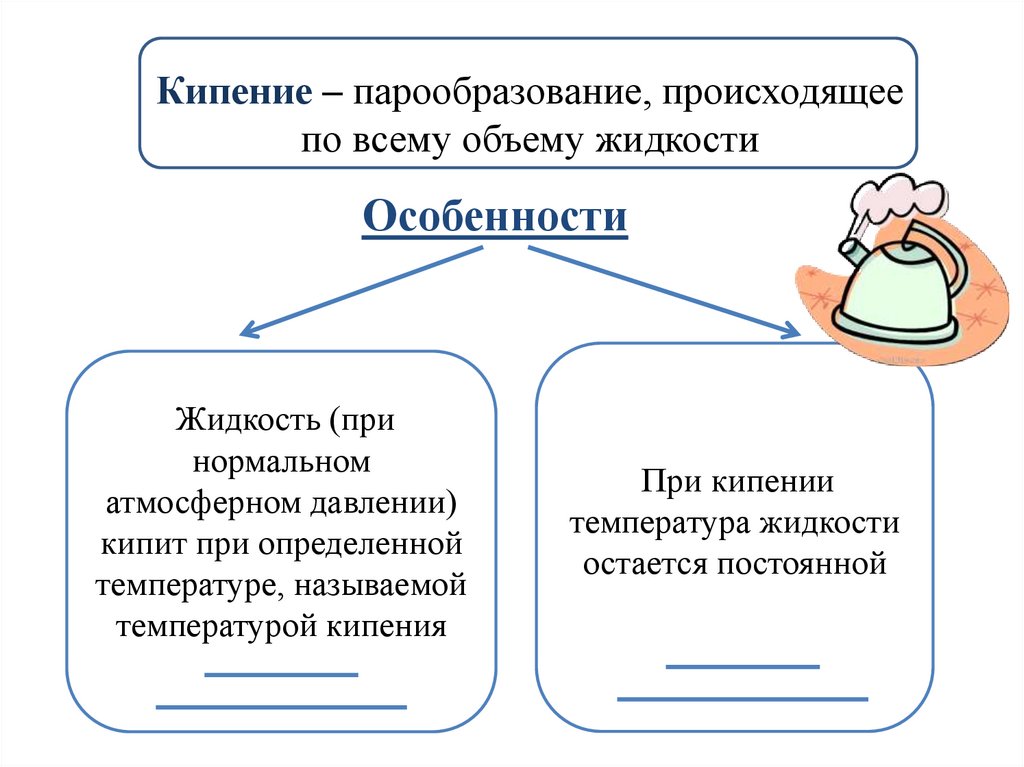
Кипение – парообразование, происходящеепо всему объему жидкости
Особенности
Жидкость (при
нормальном
атмосферном давлении)
кипит при определенной
температуре, называемой
температурой кипения
При кипении
температура жидкости
остается постоянной
17.
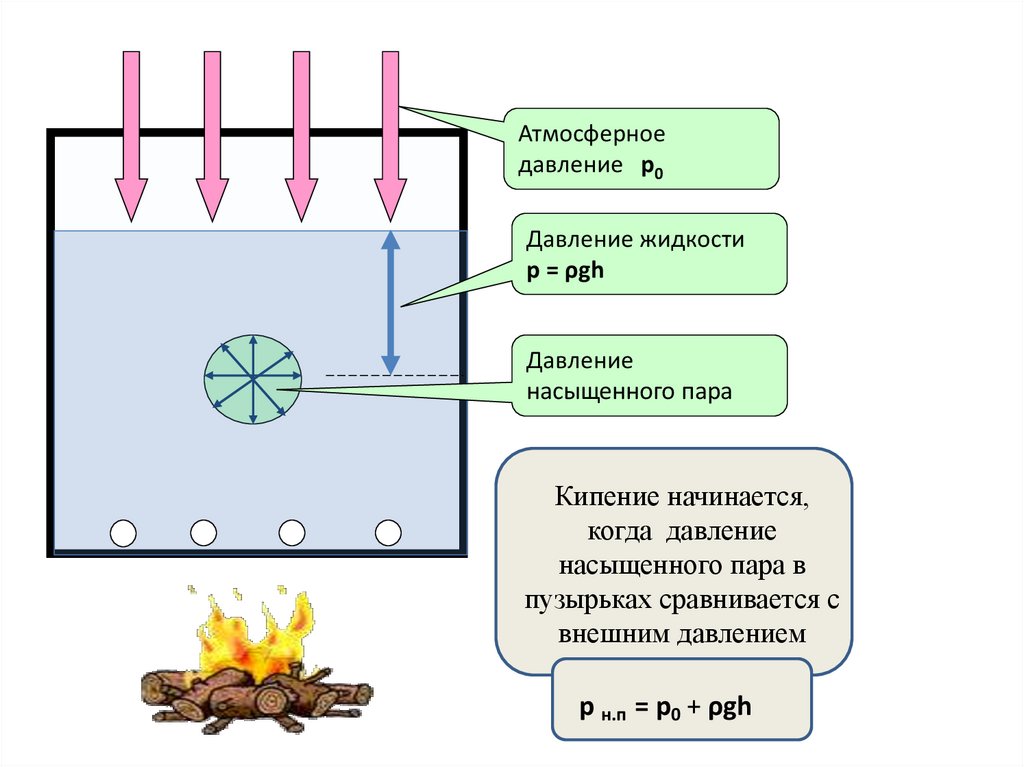
Атмосферноедавление р0
Давление жидкости
p = ρgh
Давление
насыщенного пара
Кипение начинается,
когда давление
насыщенного пара в
пузырьках сравнивается с
внешним давлением
р н.п = р0 + ρgh
18.
Стадии кипенияПервая стадия кипения
«рыбий глаз»
Пузырьки на дне сосуда появляются при
температуре 55 градусов
19.
Вторая стадия кипения«крабий глаз»
Мелкие пузырьки на дне увеличиваются при
температуре 77 градусов в объеме, напоминая
глаза краба
20.
Третья стадия кипения«жемчужные нити»
Множество мелких пузырьков образовывают
«жемчужные нити», которые поднимаются к
поверхности воды, не достигая её. Процесс
начинается при температуре в 83 градуса
21.
Четвертая стадия кипения«бурлящий источник»
Пузырьки растут, поднимаясь на поверхность
воды, и лопаются, создавая бурление воды.
Процесс проходит при температуре 100
градусов
22.
ГипотезаПри нагревании вещества в нем
устанавливается тепловой баланс:
скорость подвода тепла в какой – то
момент становится равной скорости его
рассеивания. Поскольку и скорость
подвода, и скорость рассеивания зависит
от разности температур между объектом и
средой, в состоянии теплового равновесия
у вещества устанавливается определенная
температура.
23.
Ход работы• В
круглодонную
колбу
налить
около
25
мл
дистиллированной воды и закрепить ее в штативе.
• Закрепить датчик температуры в штативе с помощью
держателя так, чтобы чувствительный элемент на самой
нижней части емкости. В этой же части закрепите термометр.
Датчик и термометр не должны соприкасаться с дном
емкости!
• Подключить датчик к USB разъему мобильного планшета
(регистратора данных).
• Поставить спиртовку под дно круглодонной колбы. Зажечь
спиртовку.
• Запустить программу измерений Relablite. Начать сбор
данных клавишей «Пуск»
• Нагрейте воду до кипения и подождите установления
показаний в течение нескольких секунд.
24.
25.
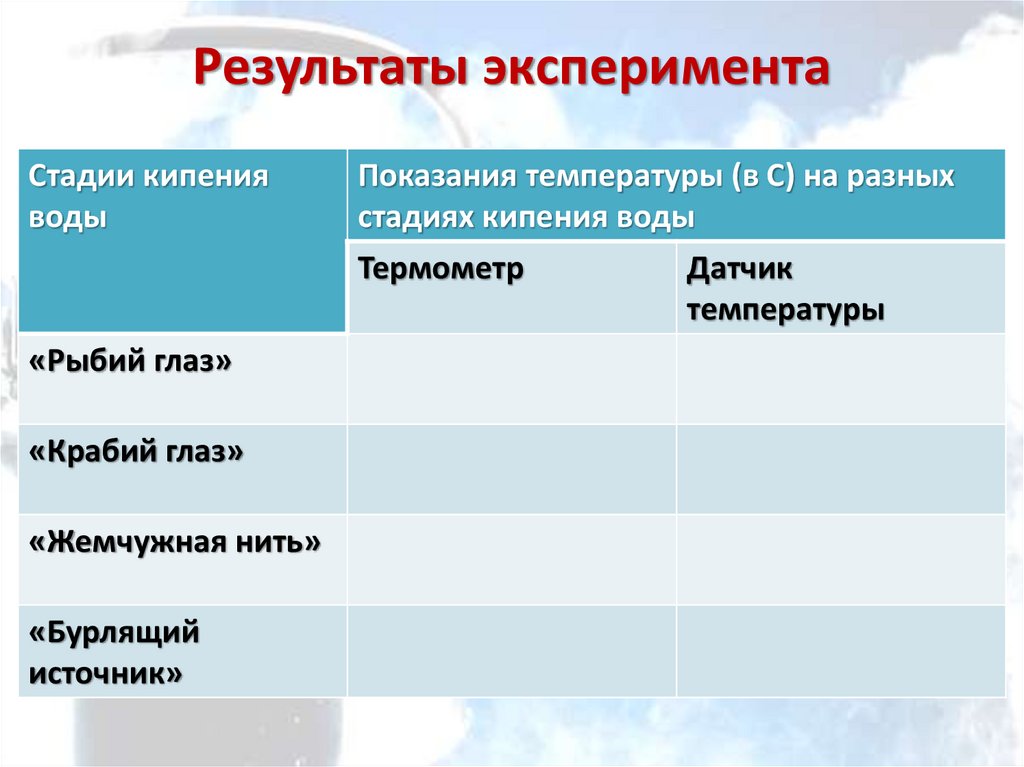
Результаты экспериментаСтадии кипения
воды
Показания температуры (в С) на разных
стадиях кипения воды
Термометр
«Рыбий глаз»
«Крабий глаз»
«Жемчужная нить»
«Бурлящий
источник»
Датчик
температуры
26.
Зависимость температуры кипения от давленияР (атм)
Т (С)
0,7
89,45
0,8
92,99
0,9
96,18
1,0
99,09
1,033
100,0
1,5
110,79
2,0
119,62
2,5
126,79
3,0
132,88
























 Биология
Биология Экология
Экология








