Похожие презентации:
Агрегирование ПАВ в воде и неполярных растворителях
1.
Кафедра коллоидной химии им. С.С. ВоюцкогоКандидат химических наук, доцент Буканова Е.Ф.
Москва, 2016
1
2.
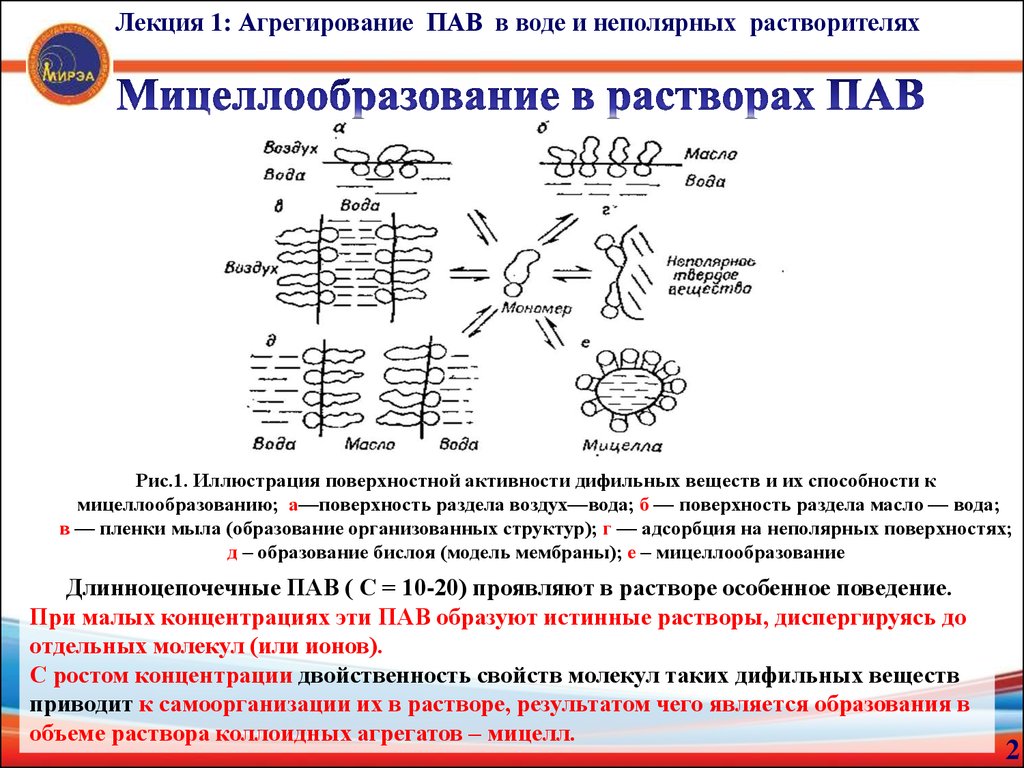
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхРис.1. Иллюстрация поверхностной активности дифильных веществ и их способности к
мицеллообразованию; а—поверхность раздела воздух—вода; б — поверхность раздела масло — вода;
в — пленки мыла (образование организованных структур); г — адсорбция на неполярных поверхностях;
д – образование бислоя (модель мембраны); е – мицеллообразование
Длинноцепочечные ПАВ ( С = 10-20) проявляют в растворе особенное поведение.
При малых концентрациях эти ПАВ образуют истинные растворы, диспергируясь до
отдельных молекул (или ионов).
С ростом концентрации двойственность свойств молекул таких дифильных веществ
приводит к самоорганизации их в растворе, результатом чего является образования в
объеме раствора коллоидных агрегатов – мицелл.
2
3.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхПервые количественные исследования природы
растворов мицеллообразующих ПАВ принадлежат
Мак Бэну (в 1913 г.). Он сформулировал
представление об образовании мицелл путем
ассоциации индивидуальных молекул или ионов
мыла. В дальнейшем развитие теории
мицеллообразования связано с именами Г. Гартли,
В. Гаркинса, П. Дебая. Огромный вклад в эту
область внесли работы П. А. Ребиндера и его
научной школы.
Мицеллами называют агрегаты из длинноцепочечных
дифильных молекул или ионов ПАВ, образующиеся
самопроизвольно в их растворах при определенной
концентрации, зависящей от природы полярной группы
и особенно от длины цепи молекулы.
Образование
мицелл происходит при кооперативном
связывании между собой мономеров при концентрациях,
превышающих довольно узкую область, называемую
критической концентрацией мицеллообразования (ККМ).
3
4.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхККМ – это сравнительно узкий интервал концентраций, обладающих пределом,
ниже которого мицеллы практически не образуются, а выше которого практически
все добавляемое ПАВ образует мицеллы. Во-вторых, это диапазон, в котором многие
свойства растворов ПАВ, графически построенные как функция концентрации,
претерпевают существенные изменения.
достаточно низкое
значение ККМ
резкий рост степени
агрегации в области
ККМ и его
неизменность с
дальнейшим
увеличением
концентрации ПАВ.
отсутствие при
концентрациях,
равных или выше
ККМ, ассоциатов с
числами агрегаций,
существенно
меньшими среднего
Важнейшие
признаки
мицеллообраз
ующего ПАВ
следующие:
Существенным следствием этих признаков является тот факт, что при ККМ и
несколько выше мицеллы ПАВ практически монодисперсны, а концентрация
мицеллообразующего ПАВ почти постоянна
4
5.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхРис.2. Зависимость ПАВ, перешедших в мицеллы
от концентрации растворов ПАВ
Рис.3. Зависимость количества вещества в молекулярнорастворенной и мицеллярной форме от общей
концентрации.
Смиц может на несколько порядков превышать См. Поэтому мицеллы являются
депо для поддержания постоянной концентрации ПАВ при его расходовании
5
6.
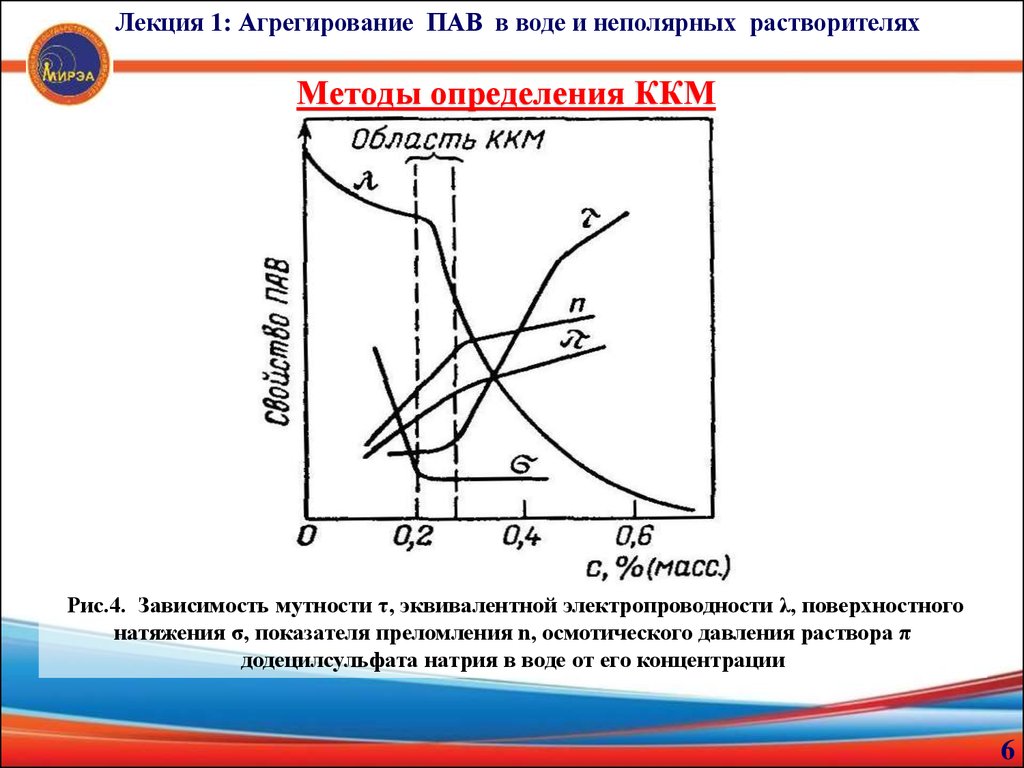
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхМетоды определения ККМ
Рис.4. Зависимость мутности τ, эквивалентной электропроводности λ, поверхностного
натяжения σ, показателя преломления n, осмотического давления раствора π
додецилсульфата натрия в воде от его концентрации
6
7.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхСтроение сферических мицелл
Рис.5. Схема сферической мицеллы (на
примере додецилсульфата натрия),
подчёркивающая жидкообразной характер
неупорядоченного углеводородного ядра и
шероховатость поверхности мицеллы
Рис.6. Строение сферической мицеллы ПАВ в
воде (мицелла Гартли)
7
8.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителях1)
Мицеллообразование также как и адсорбция протекает самопроизвольно, т.е.
с уменьшением энергии Гиббса;
2)
Силы когезии между полярными молекулами воды значительно выше, чем
силы взаимодействия между углеводородными цепями и водой. Поэтому
любые процессы, связанные с переходом углеводородного радикала из воды в
близкую по полярности фазу, энергетически выгодны.
3)
В разбавленных растворах уменьшение свободной энергии
за счет перехода молекул ПАВ в поверхностный слой;
4)
При дальнейшем повышении концентрации ПАВ уменьшение ∆ F может
быть реализовано только за счет структурных изменений в объеме раствора,
т.е. за счет образования мицелл. При этом гидрофобные цепи
выталкиваются из воды в углеводородные ядра мицелл;
5)
Гидрофильная наружная оболочка, состоящая из полярных групп,
экранирует углеводородное ядро от контакта с водой. При этом σ12
оказывается сниженным до σ12 < σкр.
6)
Указанные особенности состояния мицеллообразующих ПАВ при С выше
ККМ позволяют отнести их к лиофильным наноразмерным системам.
реализуется
8
9.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхХарактеристика лиофильных коллоидных систем
Частицы д. ф.
сольватированы
образуются
самопроизвольно
σмф < σкр
Лиофильные системы
( дисперсная фаза и дисперсионная среда
хорошо взаимодействуют)
термодинамически
равновесны
агрегативно
устойчивы
обратимы
В таких системах существует равновесие
мицеллы ПАВ ↔ молекулы (ионы).
9
10.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителях10
11.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхВ зависимости
от размера частиц (от 100 до1
нм) σкр меняется в пределах от 1,4∙10-7 до
1,4∙10-3 Дж/м2
11
12.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхККМ – наиболее важная характеристика ПАВ, связанная с
гидрофильно-липофильным балансом молекул ПАВ и
использующаяся при рассмотрении всех вопросов
практического использования ПАВ.
Величина ККМ зависит:
от строения молекулярного ПАВ;
от присутствия в растворе различных веществ;
от температуры.
12
13.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхДля ПАВ с одной полярной группой кооперативность мицеллобразования растет
(ККМ уменьшается) с ростом длины алкильной цепи в ряду гомологов.
Зависимость ККМ в водной среде от числа углеводородных атомов в
алкильной цепи выражается полулогарифмической зависимостью:
RT ln KKM = А – Вn
где А – постоянная, характеризующая энергию растворения
функциональных групп;
В – постоянная, характеризующая энергию растворения, приходящуюся на
одну группу СН2;
n – число групп СН2.
Физический смысл этих констант установлен К.Шинодой:
А содержит вклад в свободную энергию мицеллообразования гидрофильной
группы ПАВ,
В – инкремент группы –СН2 - равный (1,0-1,4 ) КТ.
Чем длиннее углеводородная цепь, тем больше окажется выигрыш энергии и
тем меньше концентрация ПАВ необходима для образования мицелл.
Величина ККМ уменьшается с ростом длины цепи.
13
14.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителях№
п/п
ПАВ
Формула
ККМ, моль/м3
Точка Крафта, 0С
1
Децилсульфат Na
С10Н21OSO3Na
33,2
8
2
Додецилсульфат Na
С12Н23OSO3Na
8,16
8-20
3
Тетрадецилсульфат Na
С14Н29OSO3Na
2,05
20,5-36
4
Цетилсульфат Na
С16Н33OSO3Na
0,52
31-46
5
Додецилсульфонат Na
С12Н25OSO3Na
10
38
6
Н-додецилбензолсульфонат Na
C12H25C6H4SO3Na
1,3
52
7
Додецилэтоксисульфат Na
C12H25OC2H4OSO3Na
4,2
5
8
Додецилэтокси-2-сульфат Na
C12H25(OC2H4)2OSO3
Na
3,1
0
9
Оксиэтилированный додециловый
спирт
C12H25O(OC2H4)7H
0,61
-
10
Додецилсульфат Li
C12H25OSO3Li
8,77
-
11
Динатрий додецилфосфат
C12H25OPO3Na2
57
20
14
15.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителях.
Величина ККМ уменьшается в результате наращивания углеводородных
радикалов другими гидрофобными группами.
Например, при введении
бензольного кольца, которое является гидрофобным эквивалентом примерно 2,5
метиленовых звеньев.
ККМ додецилсульфоната Na (С12Н25OSO3Na) – 10 моль/м3
ККМ Н-додецилбензолсульфонат Na (C12H25C6H4SO3Na) – 1,3 моль/м3
Введение между алкильной цепью и концевой полярной группой
этиленоксидных звеньев, гидрофильных по своей природе, действует подобно
удлинению цепи.
ККМ додецилсульфата Na (С12Н23OSO3Na) - 8,16 моль/м3
ККМ додецилэтоксисульфата Na (C12H25OC2H4OSO3Na) – 4,2 моль/м3
Это связано с тем, что промежуточная оксиэтиленовая цепочка удаляет заряд от
мицеллярной поверхности и является промотором мицеллообразования.
15
16.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхСферическая форма ионных мицелл устанавливается, если энергия ассоциирования
углеводородных цепей достаточно большая и превышает
энергию электростатического
.
отталкивания между ионными группами.
Гидратация противоионов, окружающих мицеллу, способствует
отталкиванию, а менее гидратированные ионы легче адсорбируются на
поверхности мицелл.
ККМ уменьшается и мицеллярная масса увеличивается:
для катионных ПАВ в ряду Cl- < Br- < Iанионных в ряду Na+ < K+ < Cs+
ККМ додецилсульфата Li - 8,77 моль/м3 ,
ККМ додецилсульфата Na – 8,16 моль/м3 ).
ККМ хлорида додецилтриметиламмония равна 2,03. 10 моль/л,
ККМ бромид додецилтриметиламмония равна 1,56. 10 моль/л.
Двухзарядные противоионы уменьшают ККМ приблизительно в 4 раза.
Наличие ионных концевых групп обеспечивает хорошую растворимость ПАВ в воде.
ККМ для ионогенных ПАВ при одинаковой гидрофобности молекул, значительно
выше, чем для неионогенных ПАВ.
16
17.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхПри равном количестве углеродных атомов кооперативность
уменьшается, ККМ
растет:
.
При циклизации цепи:
для n-тетрадецилсульфонат натрия С14Н29SО3Na
ККМ=2,5ммоль/л,
для n-октибензолсульфонат натрия
C8H17C6H4SO3Na
ККМ=11 ммоль/л.
При введении в углеводородный радикал двойных связей, полярных групп:
(стеарат натрия C17H35COONa – 0,18 моль/м3;
олеат натрия С8Н17СН=СН(СН2)7СООNa – 1,1 моль/л;
рицинолеат натрия СН3(СН2)3СН(ОН)СН2СН=СН(СН2)7СООNa – 75,2 моль/ м3.
Увеличение ККМ связано с тем, что введение ароматических циклов,
кратных связей, полярных групп, гетероатомов приводит к уменьшению
гидрофобности радикала.
17
18.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхПри переходе к перфторуглеродной цепи
наблюдается резкое снижение ККМ.
Величина ККМ октилсульфоната натрия
С8Н17SО3Na составляет 177 моль/ м3, а для
перфтороктилсульфоната С8F17SО3Na ККМ - 8,5
моль/ м3.
Это связано с тем, что фторированные ПАВ
значительно более гидрофобны и обладают
высокой поверхностной активностью, чем
углеводородные аналоги.
18
19.
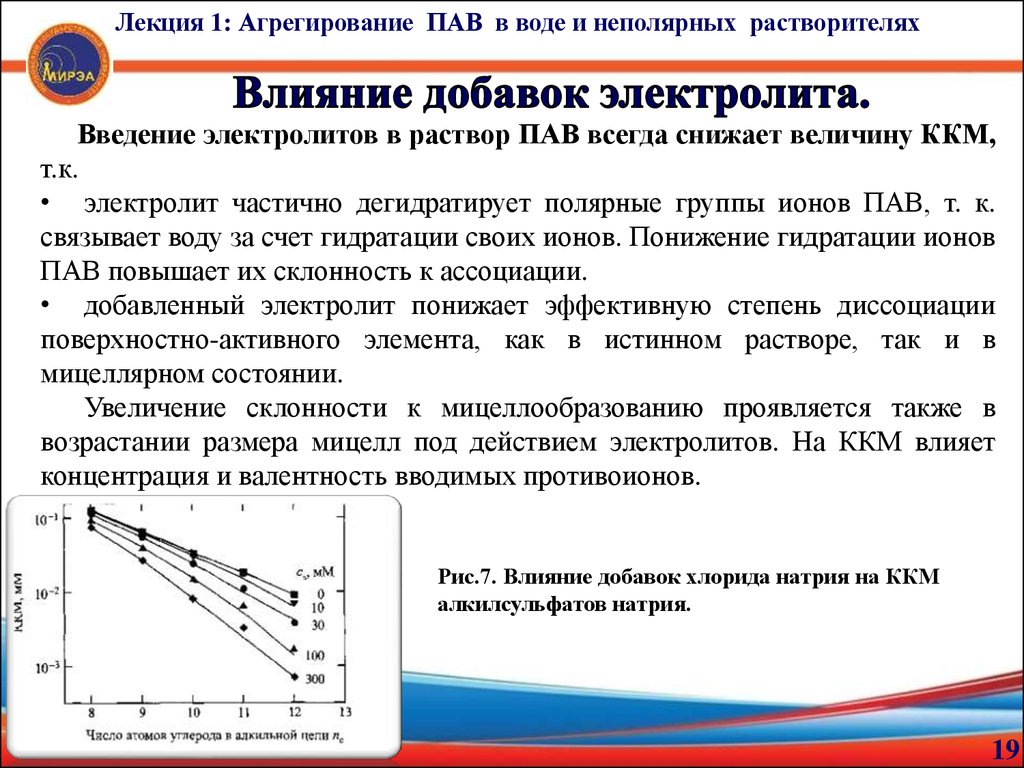
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхВведение электролитов в раствор ПАВ всегда снижает величину ККМ,
т.к.
• электролит частично дегидратирует полярные группы ионов ПАВ, т. к.
связывает воду за счет гидратации своих ионов. Понижение гидратации ионов
ПАВ повышает их склонность к ассоциации.
• добавленный электролит понижает эффективную степень диссоциации
поверхностно-активного элемента, как в истинном растворе, так и в
мицеллярном состоянии.
Увеличение склонности к мицеллообразованию проявляется также в
возрастании размера мицелл под действием электролитов. На ККМ влияет
концентрация и валентность вводимых противоионов.
Рис.7. Влияние добавок хлорида натрия на ККМ
алкилсульфатов натрия.
19
20.
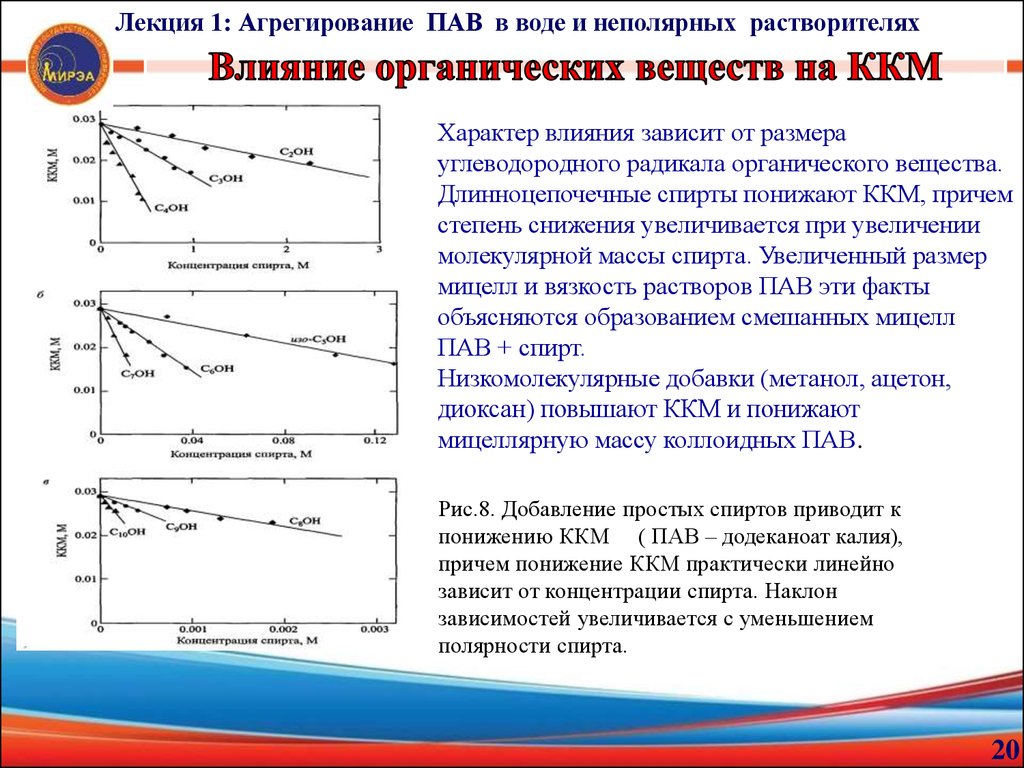
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхХарактер влияния зависит от размера
углеводородного радикала органического вещества.
Длинноцепочечные спирты понижают ККМ, причем
степень снижения увеличивается при увеличении
молекулярной массы спирта. Увеличенный размер
мицелл и вязкость растворов ПАВ эти факты
объясняются образованием смешанных мицелл
ПАВ + спирт.
Низкомолекулярные добавки (метанол, ацетон,
диоксан) повышают ККМ и понижают
мицеллярную массу коллоидных ПАВ.
Рис.8. Добавление простых спиртов приводит к
понижению ККМ ( ПАВ – додеканоат калия),
причем понижение ККМ практически линейно
зависит от концентрации спирта. Наклон
зависимостей увеличивается с уменьшением
полярности спирта.
20
21.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхВлияние температуры на ККМ
Повышение температуры должно затруднять
образование мицелл вследствие
возрастания дезагрегирующего влияния
теплового движения молекул.
Вместе с тем с увеличением
интенсивности теплового движения
уменьшается гидратация полярных групп
молекул (ионов) ПАВ.
Повышение температуры вызывает
разупорядочение воды, увеличивается
энтропия воды, понижается ККМ.
21
22.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхРис.9. Зависимость ККМ от температуры для ионных и неионных ПАВ:
1 — С10Н21О(СНСН2О)12СН3; 2 — C12H28OCCH2CH2CH3; 3 — додецилсульфат натрия;
4 — додециламмонийхлорид.
ККМ ионных ПАВ слабо зависит от температуры.
ККМ неионных ПАВ уменьшается с ростом температуры.
Гидрофильные свойства НПАВ обуславливаются наличием в
полиоксиэтилированной цепи гетероатомов кислорода. Дегидратация
полиоксиэтилированных цепочек при повышении температуры резко понижает
истинную растворимость НПАВ в воде и понижает ККМ. Гидрофобное
взаимодействие усиливается, уменьшается структурирование воды.
22
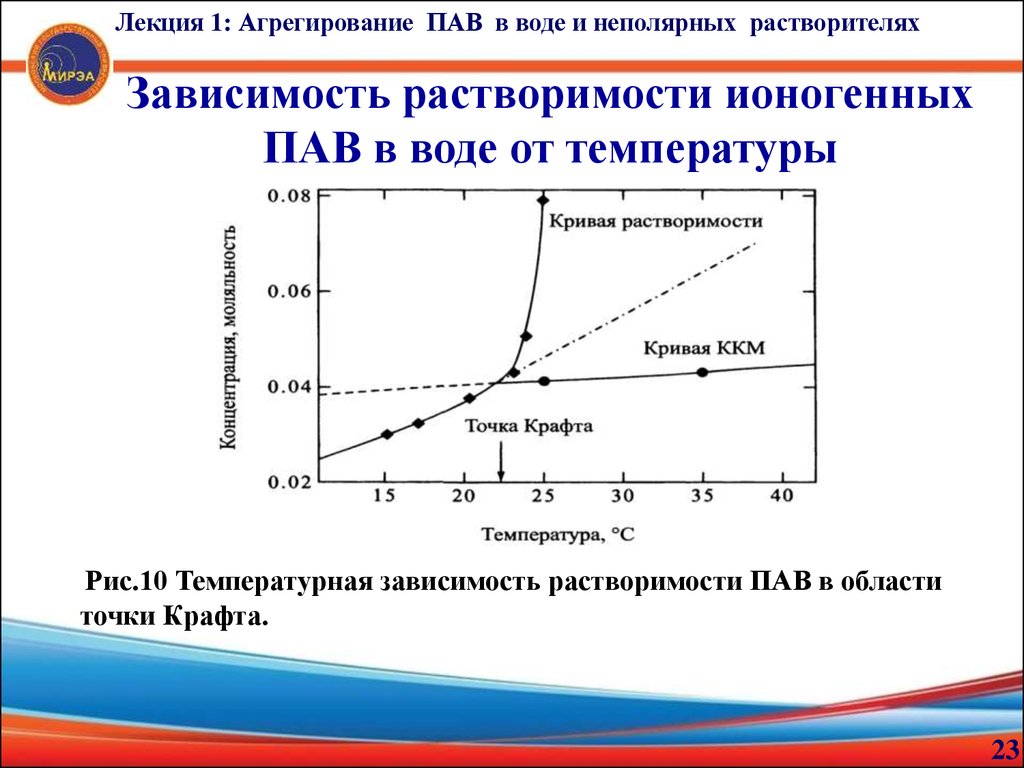
23.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхЗависимость растворимости ионогенных
ПАВ в воде от температуры
Рис.10 Температурная зависимость растворимости ПАВ в области
точки Крафта.
23
24.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхТочка Крафта характеризуется двумя параметрами:
концентрационным и температурным.
Поэтому имея в виду температуру точнее говорить температурный параметр
точки Крафта.
Температурный параметр точки Крафта связан с ее концентрационным
параметром (ККМк) логарифмической зависимостью:
ТКр = α – β lg ККМк
где α и β - постоянные, определяемые экспериментальным путем.
Для ПАВ типа 1:1 коэффициент β =11-19 и повышается с введением
дополнительных полярных групп до 22-53.
Величина точки Крафта зависит от молекулярного строения ПАВ,
природы и концентрации добавок.
Величина ТКр повышается в гомологических рядах ПАВ по мере роста
длины углеводородного радикала.
24
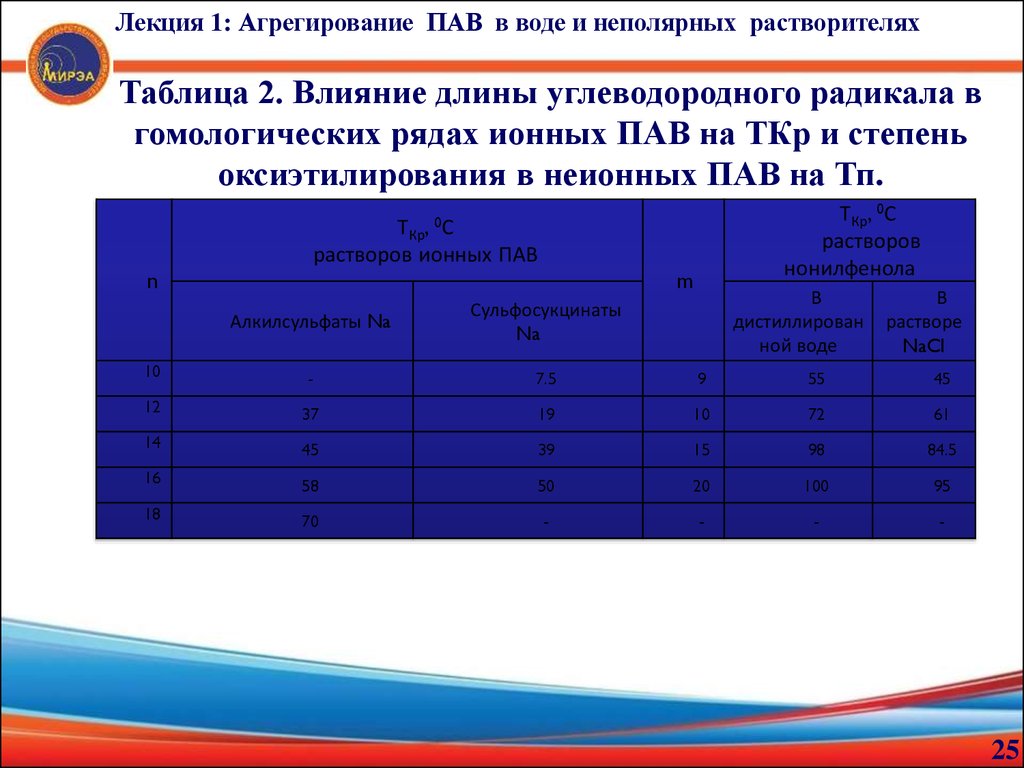
25.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхТаблица 2. Влияние длины углеводородного радикала в
гомологических рядах ионных ПАВ на ТКр и степень
оксиэтилирования в неионных ПАВ на Тп.
ТКр, 0С
растворов
нонилфенола
, 0С
n
ТКр
растворов ионных ПАВ
m
В
дистиллирован
ной воде
В
растворе
NaCl
Алкилсульфаты Na
Сульфосукцинаты
Na
10
-
7.5
9
55
45
12
37
19
10
72
61
14
45
39
15
98
84.5
16
58
50
20
100
95
18
70
-
-
-
-
25
26.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхТочка Крафта сильно зависит от природы полярной
группы и противоиона. Добавление солей обычно
приводит к повышению точки Крафта. В то же время
многие растворённые вещества её понижают. В случае
катионных ПАВ точка Крафта обычно выше для
бромидов, чем для хлоридов, и ещё выше для иодидов.
Эффект Крафта объясняется проявлением температурной
зависимости растворимости ПАВ и температурной
зависимости ККМ. Распад мицелл на составные
сольватированные ионы увеличивается с температурой.
Если такое растворение происходит ниже ККМ, мицеллы
не образуются и общая растворимость ПАВ
лимитируется низкой молекулярной растворимостью.
Если же молекулярная растворимость достигает ККМ, то
могут возникать мицеллы.
26
27.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхРазработка ПАВ с пониженными точками
Крафта
Обычно основана на уменьшении выгодности упаковки цепей
в твёрдом состоянии. Для этого используют следующие
приёмы:
1) Введение метильных групп или других заместителей для
разветвления цепей;
2) Введение двойных связей в алкильные цепи;
3) Введение полярных сегментов (обычно, оксиэтиленовой
группы) между алкильной цепью и ионной группой.
Эти же общие принципы используют при
производстве ПАВ, совместимых с жёсткой водой.
27
28.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхВлияние температуры на растворимость
неионных ПАВ
Растворимость НПАВ уменьшается с повышением температуры, для них
характерна точка помутнения. Растворимость оксиэтилированных ПАВ в воде
обусловлена образованием гидратов вследствие возникновения водородных связей
между молекулами воды и эфирными кислородными атомами
полиэтиленгликолевого остатка. При нагревании это связи ослабевают, происходит
их дегидратация, что приводит к появлению опалесценции и к помутнению раствора.
При дальнейшем нагревании происходит укрупнение частиц, то есть их
“высаливание”. Температура помутнения раствора (Тп) и высаливание (Тв) ПАВ
часто используется в качестве характеристики степени
полиоксиэтилирования промышленных продуктов и
влияния различных добавок на их растворимость.
Рис.11. Зависимость точки помутнения от длины
оксиэтиленовой цепи для НПАВ с 12 атомами углерода в
углеводородных радикалах
28
29.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхДве модели мицеллообразования
В настоящее время известно два подхода к описанию мицеллообразования.
Двухфазная (псевдофазная) модель мицеллобразования
Мицеллообразование рассматривается как явление разделения фаз, а ККМ – как
концентрация, соответствующая предельной растворимости ПАВ в молекулярной
форме.
Мицеллобразование как химическое равновесие
Процесс мицеллообразования рассматривается как обратимая химическая
реакция, подчиняющаяся закону действующих масс, а мицеллярные растворы – как
гомогенные системы. Процесс мицеллообразования в соответствии с законом
действия масс можно выразить для неионогенных и ионогенных ПАВ с помощью
уравнений:
m(ПАВ) (ПАВ)m
и nK+ + mR- M(m – n)
K+ - противоион;
R- - поверхностно-активный анион;
М – мицелла;
m – число R в мицелле;
n – число противоионов, связанных с поверхностью мицеллы (m n);
разность (m – n) – заряд мицеллы.
29
30.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхДля этой модели с учётом основного соотношения между
свободной энергией и константой равновесия К:
∆G0 = -RT ln К
Можно вывести приближённое выражение для
мицеллообразования:
∆G0 = -RT ln (KКМ)
где ∆G0 – разность стандартной свободной энергии
молекулы в мицелле и в некотором выбранном стандартном
состоянии сравнения, что служит стартовой точкой для
термодинамического описания мицеллообразования.
Процесс мицеллообразования быстрая
обратимая реакция с периодом τ = 10-7 с.
30
31.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхГидрофобные взаимодействия. Термодинамика
мицеллообразования в водной среде.
Термин «гидрофобные взаимодействия» был предложен Ленгмюром в
1916 г. при выводе уравнения изотермы мономолекулярной адсорбции.
Они возникают только в водных растворах в результате
взаимодействия полярных молекул воды с неполярными
гидрофобными частицами, молекулами (углеводородами) или
неполярными радикалами молекул, в частности, неполярными
радикалами ПАВ.
Гидрофобные взаимодействия вызваны особенностями
структуры воды. Между молекулами воды образуются водородные
связи. Энергия водородной связи между молекулами воды больше
энергии взаимодействия молекул воды с неполярными частицами и
радикалами.
Вода является сильно ассоциированной структурированной
жидкостью. Наряду с упорядоченной тетраэдрической льдоподобной
структурой существует лишенная упорядоченности структура.
.
31
32.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхЭкспериментально установлено (по ИК-спектрам), что при 20 С средний кластер содержит около
57 молекул воды. При повышении температуры заметно уменьшается средняя величина кластеров
(от 90 молекул при 0 до 25 при 70 С).
Растворение в воде углеводородов и углеводородных радикалов ПАВ проводит к
тому, что структура воды становится более упорядоченной. Это подтверждено изменением
диэлектрических свойств растворов, расширением линий ЯМР, снижением коэффициента
самодиффузии. Увеличение структурированности воды предопределяет притяжение гидрофобных
частиц.
Гидрофобные взаимодействия выполняют лишь ориентирующую
функцию – они обеспечивают наиболее предпочтительный контакт между
родственными гидрофобными частицами. Сам же контакт реализуется за счет
межмолекулярных
(ван-дер-ваальсовых),
электростатических,
донорноакцепторных и других сил.
Возникновение
гидрофобных
взаимодействий
1, 2 – неполярные частицы
3 – уплотненный
мономолекулярный слой воды
4 – последующий слой воды
32
33.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхВозникновение гидрофобных взаимодействий имеет и термодинамическое
обоснование.
Мицеллообразование в растворах ПАВ происходит самопроизвольно и
сопровождается уменьшением свободной энергии Гиббса ∆G, которое складывается из
энтальпийного и энтропийного членов:
∆G=∆H - T∆S
Знак при ∆G будет определяться соотношением этих членов.
Экспериментально установлено, что энтальпия мицеллообразования ионногенных ПАВ невелика
(3-4 кДж/моль) и может принимать как положительные значения, так и в некоторых случаях
(например для алканоатов калия (с С10 – С14)) практически равна нулю. В случае неионных ПАВ
∆H больше и всегда положительно, т. е. мицеллообразование происходит с поглощением тепла.
Следовательно, решаюшую роль в протекании самопроизвольной ассоциации ПАВ в
мицеллы играет энтропийный вклад в изменение энергии Гиббса.
При объединении молекул ПАВ в мицеллу энтропия мицелообразования уменьшается,
т.к. число степеней свободы ПАВ уменьшается. Для того, чтобы понять причину положительного
энтропийного эффекта при мицеллообразовании, необходимо рассмотреть изменение энтропии
всей системы, обоих ее компонентов: ПАВ и воды
∆Sсист. = ∆Sмиц. + ∆Sводы
Движущей силой мицеллобразования является увеличение
энтропии системы в целом за счет льдоподобных «айсберговых» структур воды. Когда
молекулы ПАВ образуют мицеллу, водородные связи в воде разрушаются, молекулы воды
приобретают больше степеней свободы, и энтропия воды, а значит, и всей системы
увеличивается.
33
34.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхРасчет термодинамических функций
мицеллообразования
Термодинамические функции процесса мицелообразования могут быть получены
расчётным путём на основе псевдофазной модели мицелл.
Для расчёта энтальпии мицеллообразования воспользуемся уравнением ГиббсаГельмгольца в форме:
(1)
2
[∂/∂T*(∆G/T)]p = - ∆H/T
Величина энергии Гиббса мицеллобразования свяана с ККМ выражением:
∆G0m = RT ln KKM
Подставляя ∆G0m в уравнение (1) получим:
[∂/∂T*(∆G0m/T)]p = R*(∂ ln KKM/∂T)p = - ∆H0m/T2
Откуда
∆H0m = -RT2 (∂ ln KKM/∂T)p
(2)
Где ∆Н0m – изменение стандартной энтальпии при переходе 1 моля ПАВ из мономеров
в мицеллярное состояние.
34
35.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхИспользуя выражение для второго закона термодинамики ∆G = ∆Н - Т∆S, легко
рассчитать изменение энтропии при мицеллообразовании (∆S 0m ):
∆S0m = (∆Н0m - ∆G0m )/ T
(3)
Величина ∆Н0m может быть рассчитана по температурной зависимости ККМ с
помощью уравнения 1. Это уравнение удобно использовать в интегральной
форме. Разделяя переменные и интегрируя, получим:
ln KKM = const + ∆Н0m / R * 1/T
(4)
Уравнение 2 описывает прямую, выражающую зависимость ln KKM от 1/Т.
Тангенс угла наклона этой прямой равен ∆Н0m / R, откуда легко найти ∆Н0m
Определяют величину ККМ неионогенного
ПАВ при различных температурах.
Рассчитывают ∆Н0m. Для этого строят график
зависимости ln KKM = f(1/T).
Рис. 12. График для определения ∆Н0m
неионогенного ПАВ
35
36.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхЕсли экспериментальные точки плохо ложатся на прямую, график строят по методу
наименьших квадратов. На полученной прямой выбирают произвольно две точки и
проводят через них прямые, параллельные осям координат. Согласно уравнению (2) и
рис.
tg α = ∆H0m/2,3R = ∆lg KKM/∆(1/T)
Отсюда находят энтальпию мицеллообразования (кДж/моль):
∆H0m = 2,3R (∆lg KKM/∆(1/T))
Рассчитывают стандартную энергию Гиббсу мицеллообразования по уравнению
∆G0m = RT kn KKM при изученных температурах. При этом необходимо величины ККМ
выразить в мольных долях (х пав ): х пав = n пав / n пав + n н2о
Где n пав и n н2о – соответственно количество молей ПАВ и воды в 1 м3 раствора.
Поскольку используются сильно разбавленные растворы, то n пав << n н2о и величину n
3
н2о можно принять, равной числу молей воды в 1 м чистого растворителя (55,56
кмоль/м3)
Используя найденные значения ∆G0m и ∆Н0m , рассчитывают величину энтропии
мицеллообразования по формуле (3).
36
37.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхТаблица 3. Термодинамические функции
мицеллообразования
№
п/п
ПАВ
Т, К
∆G,
∆Н,
∆S,
кДж/моль кДж/моль кДж/моль
1
Додецилсульфат натрия
298
-21,7
2,2
80,2
2
Олеат натрия
298
-26,9
14,5
41.6
3
Додецилтриметиламмоний
бромид
298
20,5
-1,3
64,8
4
Оксиэтилированный
моноалкилфенол
298
-21,4
7,6
103
303
-23,6
7,6
103
37
38.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхГидрофобные взаимодействия обуславливают самопроизвольное
протекание различных процессов:
мицеллообразования;
солюбилизации (перехода молекул углеводородов из воды в
мицеллы ПАВ);
глобулизации белковых молекул вследствие взаимодействия их
гидрофобных углеводородных фрагментов;
агломерирования частиц в водных суспензиях неполярных веществ;
адсорбции дифильных молекул из водной среды на границе с
неполярными средами;
образования монослоев водорастворимых ПАВ на поверхности
воды.
38
39.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхМицеллообразованияе в неводных средах
В растворах ПАВ в неполярных средах образуются мицеллы с противоположной
ориентацией молекул. При формировании таких обратных мицелл полярные
группы объединяются в гидрофильное ядро, а углеводородные радикалы,
обращенные в сторону родственной им неполярной среды, образуют
олеофильную оболочку, экранирующую внутреннюю гидрофильную часть
мицеллы от контакта с углеводородной средой.
Числа агрегации оставляют 3 – 40.
Рис.13. Схематическое изображение
мицеллы ПАВ в неполярной среде
39
40.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхПри образовании мицелл в водных и неполярных
средах есть как общность, так и существенные
различия.
Общность состоит преимущественно в том,
что в любой среде процесс мицеллообразования
происходит самопроизвольно, то есть с
уменьшением свободной энергии системы.
В водной среде процесс
мицеллообразования носит энтропийный
характер, в то время как в неполярных средах
энтропия обычно уменьшается, что является
существенным различием.
40
41.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхПрирода мицеллообразования в
неполярных средах
Структура растворителя в присутствии ПАВ существенно не нарушается.
Мицеллообразование в неполярных средах имеет неэнтропийную, а
энергетическую природу. Она заключается в выгодности замены связи
полярная группа – углеводород при молекулярном растворении на связь
между полярными группами при их объединении в ядро мицеллы.
Энергетический выигрыш системы при объединении полярных групп
настолько велик, что при самых малых концентрациях истинных
растворов ПАВ находится не в виде отдельных молекул, а в виде
предмицеллярных ассоциатов.
Рис.14. Зависимость ККА (1) и ККМ (2)
карбоновых кислот в CCI4 от числа атомов
углерода в молекуле.
41
42.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхОпределение ККМ в неводных растворах
Методы изучения процесса агрегации ПАВ в неполярных средах можно
разделить по определяемым данными способами параметрам на:
традиционные, позволяющие определить ККМ
(кондуктометрия,тензиометрия, рефрактометрия и другие методы,
используемые часто для определения ККМ и водных растворах
ПАВ);
классические методы, позволяющие определить числа агрегации по
среднечисловой, средневискозиметрической и среднемассовой
мицелярной массе;
специальные методы, позволяющие исследовать кинетические
параметры и некоторые другие закономерности процесса агрегации
(ИК-, ЯМР-и ПМР- спектроскопия).
В связи с тем что в неполярных средах область перехода от молекулярных растворов к мицеллам
оказывается размытой, различные методы дают большой разброс значений ККМ.
На величину ККМ и числа агрегации мицелл большое влияние оказывает природа
растворителя, определяющая интенсивность взаимодействия его молекул полярной и
неполярной частью молекул ПАВ.
42
43.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхТаблица 5. ККМ различных ПАВ в трихлорэтилене (ТХЭ) и
тетрахлорэтилене (ПХЭ) при температуре 293 К
43
44.
Лекция 1: Агрегирование ПАВ в воде и неполярных растворителяхВлияние различных факторов на величину ККМ
в неводных средах
Природа растворителя. Она определяет интенсивность взаимодействия его молекул с
полярной и неполярной частями молекул ПАВ. Рост полярности растворителя и
повышение диэлектрической проницаемости приводит к росту ККМ.
(Значения ККМ в более полярном тетрахлорэтилене выше значений в перхлорэтилене).
Длина углеводородного радикала. При удлинении гидрофобных цепей наблюдается
увеличение ККМ, что согласуется с уравнением: RT ln KKM = А + Вn
Природа полярных групп. Числа агрегации увеличиваются в ряду Li +< Na+ <K+< Cs+
Cтепень оксиэтилирования неионных ПАВ. При увеличении степени
оксиэтилирования величина ККМ уменьшается. ( табл.5)
44







































 Химия
Химия








