Похожие презентации:
Сера и её соединения
1. СЕРА И ЕЁ СОЕДИНЕНИЯ
Учитель химии МБОУ СОШ №7Миронова Е.А.
Дубна, 2015
2. Валентные состояния атома серы S
Валентность II,ст. окисления -2
3s
3p
3d
↓
↑
Валентность IV,
Ст. окисления +4
Валентность VI,
Ст. окисления +6
SО2
Н2S
Н2SО4
3. Физические свойства серы
• Твёрдоекристаллическое
вещество желтого
цвета, без запаха
• Плохо проводит
теплоту и не проводит
электрический ток
• Сера в воде
практически не
растворяется
• Температура
плавления 1200С
4. Нахождение серы в природе
Сера является на 16-м местепо распространённости
в земной коре. Встречается
в свободном (самородном)
состоянии и связанном
виде.
5.
Аллотропныемодификации
серы
Ромбическая
Моноклинная
Пластическая
6. Ромбическая сера
Ромбическая(α-сера) – S8, желтого
цвета,
t°пл.=113°C; Наиболее
устойчивая
модификация
7. Моноклинная сера
Моноклинная(β –сера)- S8, темножелтые иглы,
t°пл. = 119°C;
устойчивая при
температуре более
96°С; при обычных
условиях
превращается в
ромбическую
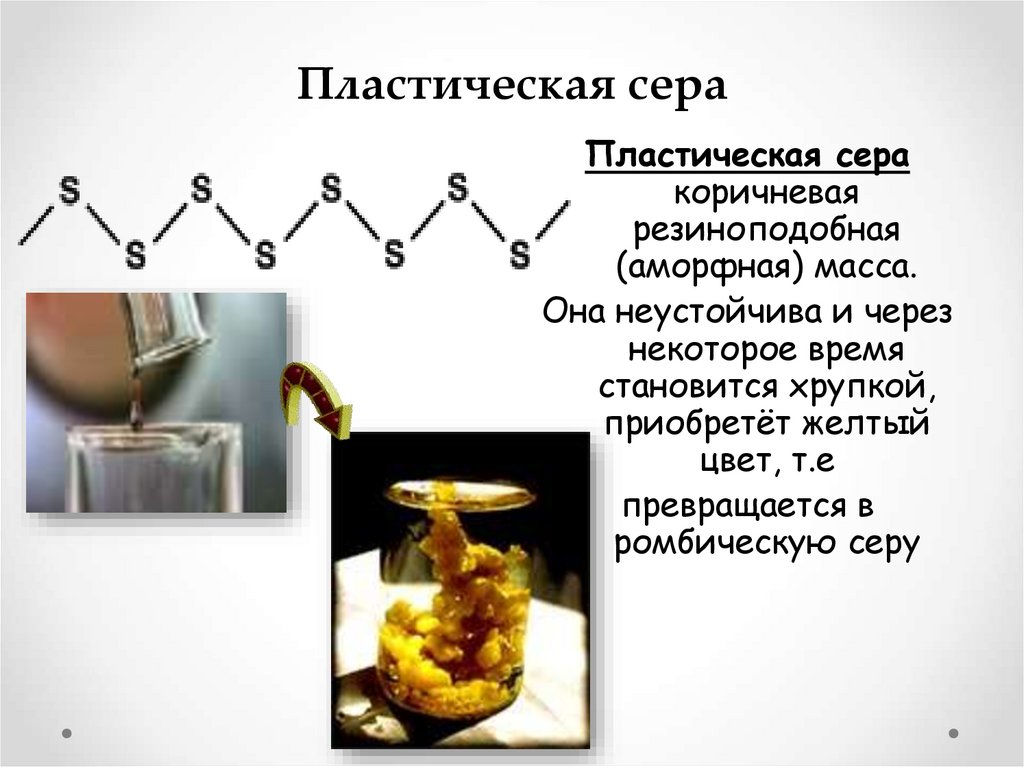
8. Пластическая сера
Пластическая серакоричневая
резиноподобная
(аморфная) масса.
Она неустойчива и через
некоторое время
становится хрупкой,
приобретёт желтый
цвет, т.е
превращается в
ромбическую серу
9. Химические свойства серы (восстановительные)
Сера проявляет в реакциях с сильнымиокислителями:
S - 2ē S+2; S - 4ē S+4; S - 6ē S+6
1) С кислородом
S + O2 t S+4O2
2S + 3O2 t ;Рt 2S+6O3
2) С галогенами (кроме йода)
S + Cl2 S+2Cl2
3) С кислотами - окислителями:
S + 2H2SO4(конц) 3S+4O2 + 2H2O
S + 6HNO3(конц) H2S+6O4 + 6NO2 + 2H2O
10. Химические свойства серы (окислительные)
S0 + 2ē S-24) Сера реагирует со щелочными
металлами без нагревания,c остальными
металлами (кроме Au, Pt) – при
повышенной t :
2Al + 3S –t Al2S3
5) С некоторыми неметаллами сера
образует бинарные соединения:
H2 + S H2S
2P + 3S P2S3
C + 2S CS2
11. Сероводород
FeS + 2HCl= FeCl 2 + H 2S• Газ
• бесцветный
• запах тухлых яиц
• ядовит
• хорошо растворим в воде
(сероводородная кислота)
12.
1) Горение сероводорода.Полное сгорание (при избытке O2)
2H2S-2 + 3O2 → 2S+4O2 + 2H2O
Неполное сгорание (недостаток O2)
2H2S-2 + O2 → 2S0 + 2H2O
13.
2)Восстановительные
галогенами,
солями,
кислотами).
H2S-2 + Br2 → S0 + 2HBr
H2S-2 + 2FeCl3 → 2FeCl2 + S0 + 2HCl
свойства
(с
кислородом,
14.
3) Кислотные свойства.Взаимодействует с основаниями:
H2S + 2NaOH изб. → Na2S + 2H2O
сульфид натрия
H2S изб. + NaOH → NaHS + H2O
гидросульфид натрия
15.
4) Качественная реакция насероводородную кислоту и сульфиды.
Н2S + Pb(NO3)2 → PbS↓ + 2HNO3
Pb2+ + S2- → PbS↓
черный
H2S + Cu(NO3)2 → CuS↓ + 2HNO3
Сu2+ + S2- → CuS↓
черный
16. Диоксид серы
4 Fe S2 + 11 O2 = 2 Fe2 O3 + 8 S O2• газ
• бесцветный
• запах резкий,
удушающий
• tкип = -10С
17. Триоксид серы.
2SO2 + O2 → 2SO3 + Q.• жидкость
• бесцветная
• сильно дымит на
воздухе

















 Химия
Химия








