Похожие презентации:
Решение задач по схемам
1.
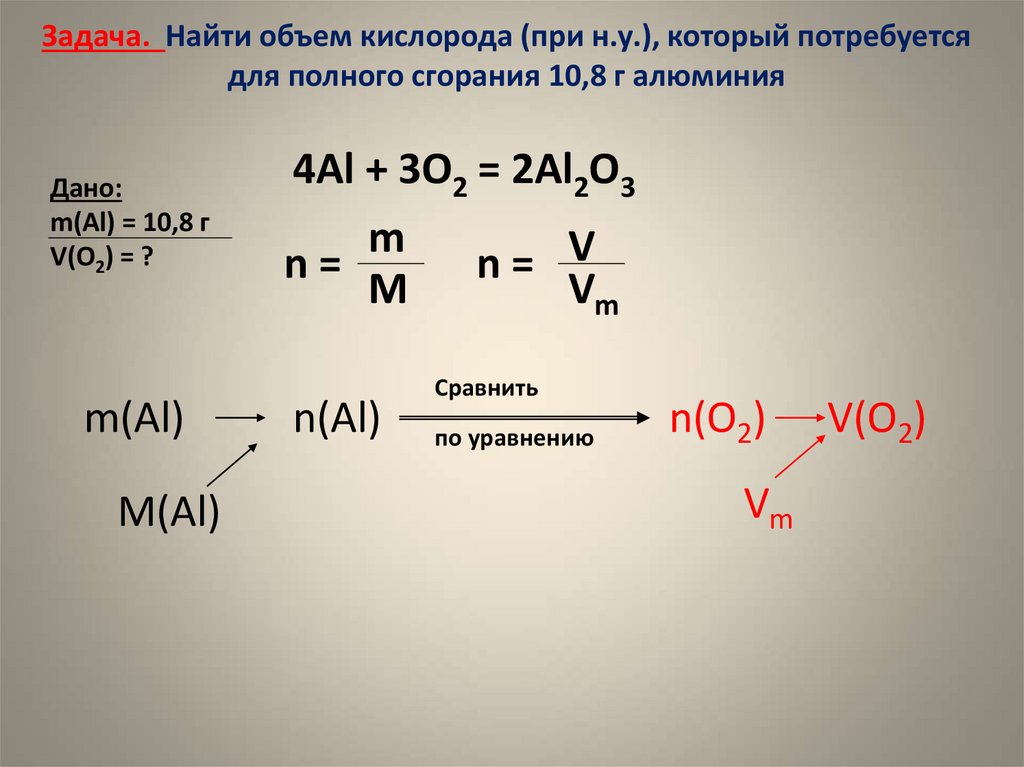
2. Задача. Найти объем кислорода (при н.у.), который потребуется для полного сгорания 10,8 г алюминия
Дано:m(Al) = 10,8 г
V(O2) = ?
m(Al)
M(Al)
4Al + 3O2 = 2Al2O3
m
n=
n= V
M
Vm
n(Al)
Сравнить
по уравнению
n(O2)
Vm
V(O2)
3. Решение
4Al + 3O2 = 2Al2O3m(Al)
n(Al)
M(Al)=27 г/моль
m(Al)
n(Al) =
M(Al)
n(O2) =
3
n(Al)
4
V(O2) =n(O2) Vm
n(O2)
V(O2)
Vm = 22,4 л/моль
10,8 г
= 0,4 моль
n(Al) =
27 г/моль
n(O2) = 3 0,4 моль = 0,3 моль
4
V(O2) = 0,3 моль х 22,4 л/моль = 6,72 л
Ответ: V(O2) = 6,72 л
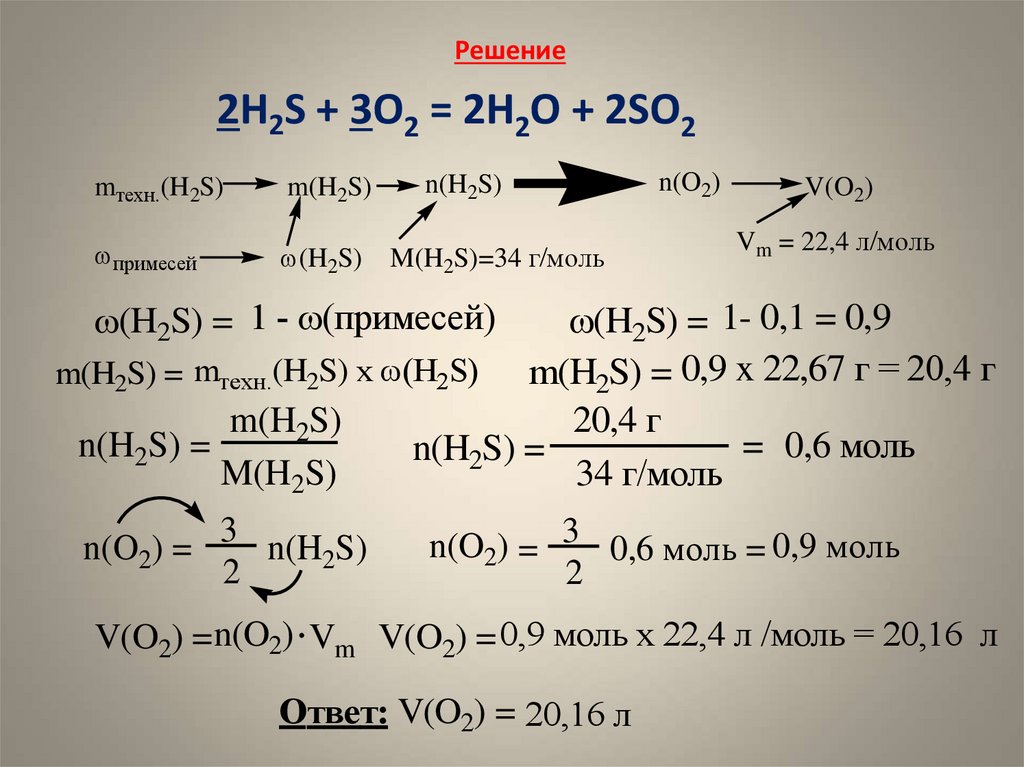
4. Задача на примеси Найти объем кислорода (при н.у.), который потребуется для полного сгорания 10,2 г сероводорода, содержащего
10%негорючих примесей
2H2S + 3O2 = 2H2O + 2SO2
m(B)
m
n= V
w(B) = m(см.) n =
M
Vm
Сравнить
m(H2S) n(H2S) по уравнению
n(O2)
Дано:
mтехн.(H2S) = 26,67 г
w(примесей) = 10%
V(O2) = ?
mтехн.(H2S)
w(примесей)
w(H2S)
M(H2S)
V(O2)
Vm
5. Решение
2H2S + 3O2 = 2H2O + 2SO2mтехн.(H2S)
m(H2S)
wпримесей
w(H2S)
n(H2S)
M(H2S)=34 г/моль
n(O2)
V(O2)
Vm = 22,4 л/моль
w(H2S) = 1 - w(примесей)
w(H2S) = 1- 0,1 = 0,9
m(H2S) = 0,9 x 22,67 г = 20,4 г
m(H2S) = mтехн.(H2S) x w(H2S)
20,4 г
m(H2S)
n(H2S) =
= 0,6 моль
n(H2S) =
M(H2S)
34 г/моль
3
n(O2) = 3 0,6 моль = 0,9 моль
n(O2) =
n(H2S)
2
2
V(O2) =n(O2) Vm V(O2) = 0,9 моль х 22,4 л /моль = 20,16 л
Ответ: V(O2) = 20,16 л
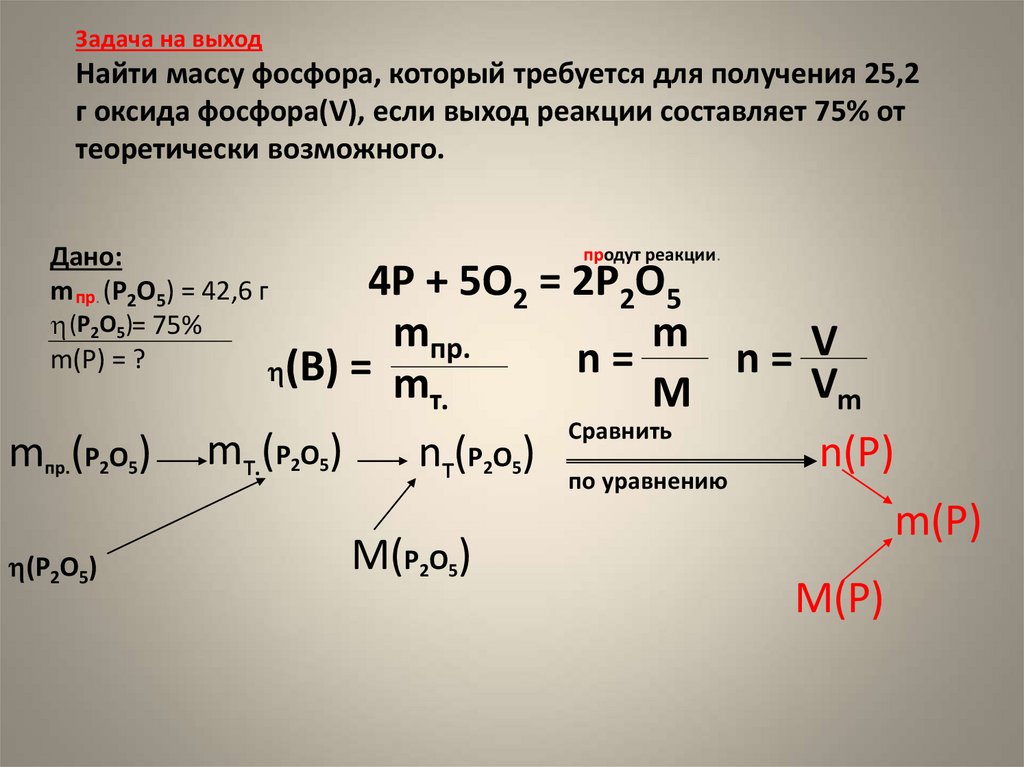
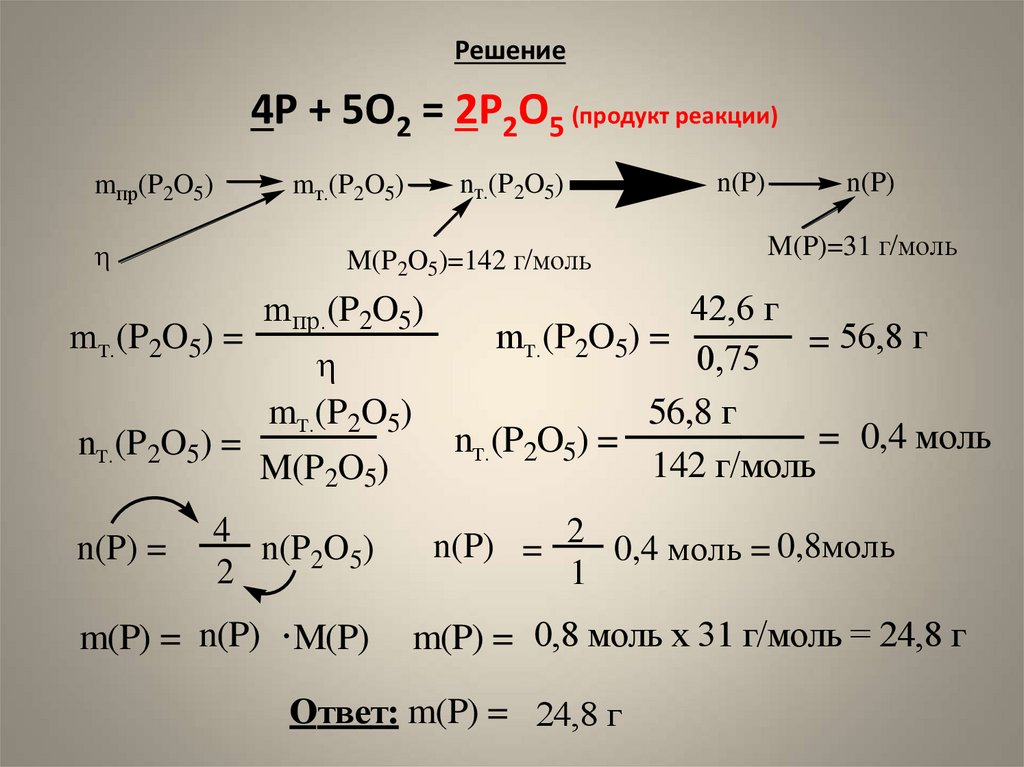
6. Задача на выход Найти массу фосфора, который требуется для получения 25,2 г оксида фосфора(V), если выход реакции составляет
75% оттеоретически возможного.
Дано:
m пр. (P2O5) = 42,6 г
(P2O5)= 75%
m(P) = ?
(B)
mпр.(P2O5)
(P2O5)
продут реакции.
4P + 5O2 = 2P2O5
mпр.
m
V
n
=
n
=
= m
Vm
M
т.
Сравнить
mт.(P2O5)
nт(P2O5) по уравнению
n(P)
m(P)
M(P2O5)
M(P)
7. Решение
4P + 5O2 = 2P2O5 (продукт реакции)mпр(P2O5)
M(P2O5)=142 г/моль
mт.(P2O5) =
nт.(P2O5) =
n(P) =
nт.(P2O5)
mт.(P2O5)
mпр.(P2O5)
mт.(P2O5)
M(P2O5)
4
n(P2O5)
2
m(P) = n(P) M(P)
n(P)
n(P)
M(P)=31 г/моль
42,6 г
mт.(P2O5) =
= 56,8 г
56,8 г
= 0,4 моль
nт.(P2O5) =
142 г/моль
n(P) = 2 0,4 моль = 0,8моль
1
m(P) = 0,8 моль х 31 г/моль = 24,8 г
Ответ: m(P) = 24,8 г
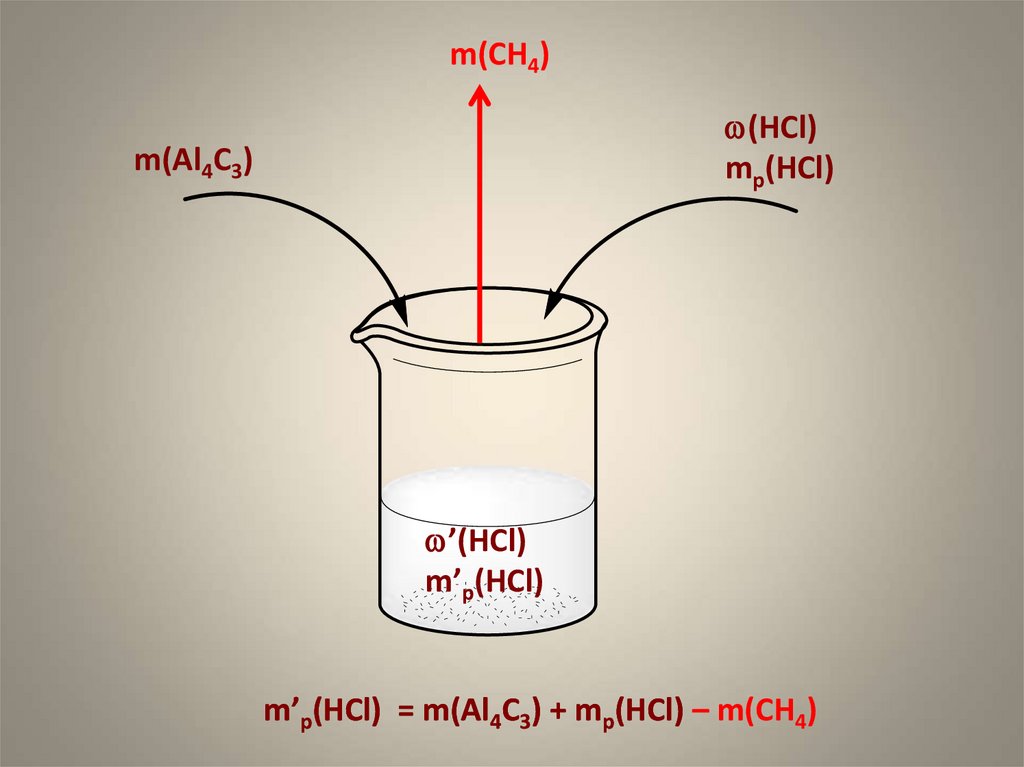
8. Задание С4
1. При обработке карбида алюминияраствором соляной кислоты, масса
которого 320 г и массовая доля HCl 22 %,
выделилось 6,72 л (н.у.) метана.
Рассчитайте массовую долю соляной
кислоты в полученном растворе.
9.
m(CH4)w(HCl)
mр(HCl)
m(Al4C3)
w’(HCl)
m’р(HCl)
m’р(HCl) = m(Al4C3) + mр(HCl) – m(CH4)
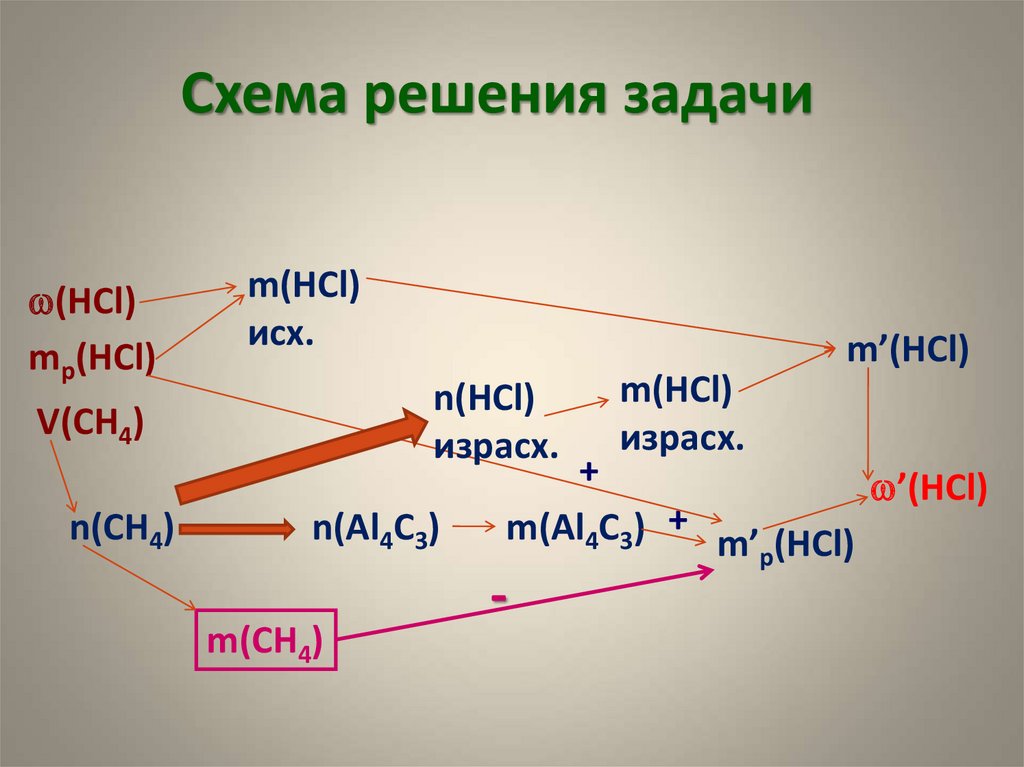
10. Схема решения задачи
w(HCl)mр(HCl)
m(HCl)
исх.
n(HCl)
израсх.
V(CH4)
n(CH4)
m’(HCl)
n(Al4C3)
m(CH4)
m(HCl)
израсх.
+
w’(HCl)
m(Al4C3) + m’ (HCl)
р
-
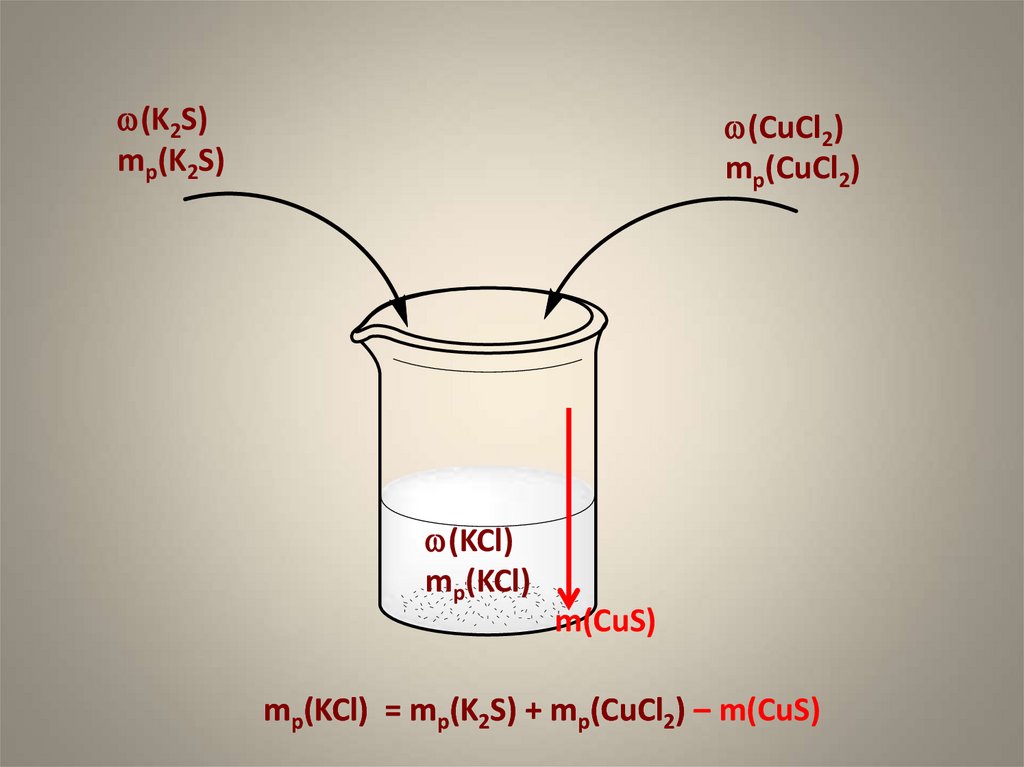
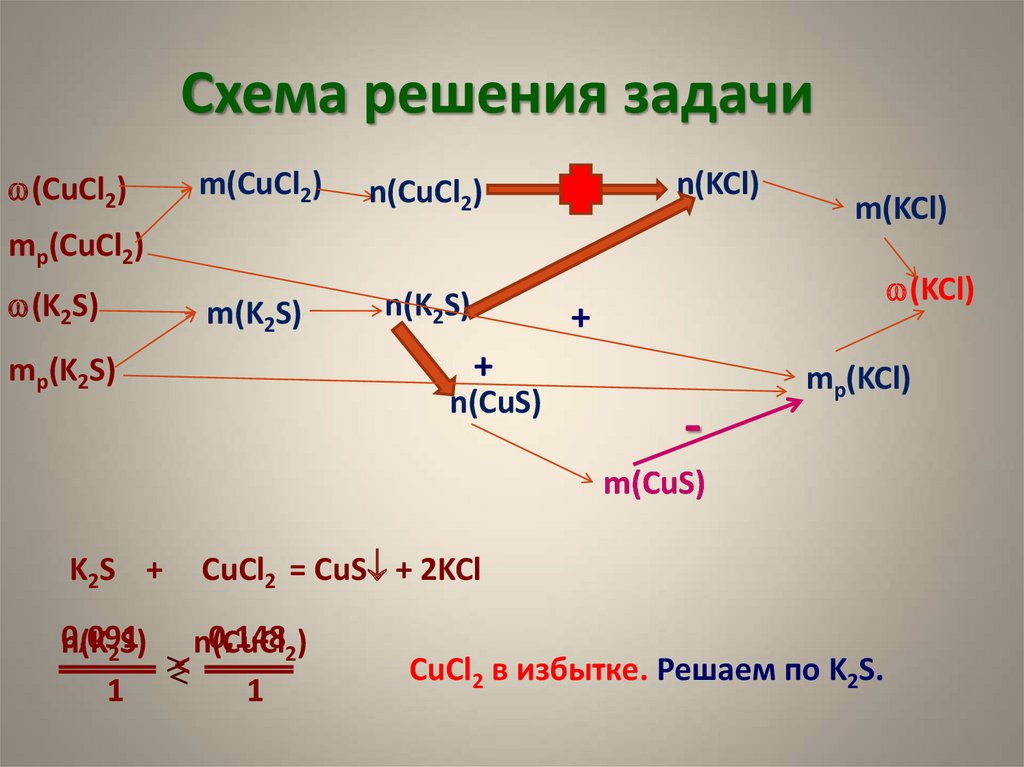
11. Задание С4
1. Смешали 200 г 10%-ного раствора хлоридамеди(II) и 200 г 5%-ного раствора сульфида
калия. Определите массовую долю
хлорида калия в растворе.
12.
w(K2S)mр(K2S)
w(CuCl2)
mр(CuCl2)
w(KCl)
mр(KCl)
m(CuS)
mр(KCl) = mр(K2S) + mр(CuCl2) – m(CuS)
13. Схема решения задачи
w(CuCl2)m(CuCl2)
n(CuCl2)
m(K2S)
n(K2S)
n(KCl)
m(KCl)
mр(CuCl2)
w(K2S)
w(KCl)
+
+
mр(K2S)
n(CuS)
-
mр(KCl)
m(CuS)
K2S +
CuCl2 = CuS + 2KCl
0,091
0,1482)
n(K2S) n(CuCl
<
1
1
CuCl2 в избытке. Решаем по K2S.





 Химия
Химия