Похожие презентации:
Алкины. Ацетилен
1. Алкины. Ацетилен.
2. Цели:
Ознакомиться с гомологическим рядом,изомерией, номенклатурой алкинов.
Рассмотреть способы получения ацетилена,
изучить физические и
химические свойства,
применение ацетилена.
10.12.2021
Алексеева Л.А.
3.
Решите задачу:•Массовая доля углерода в УВ равна
92,3%, массовая доля водорода –
7,7 %. Относительная плотность УВ по
водороду равна 13. Выведите
молекулярную формулу простейшего
представителя алкинов.
•Запишите его название и составьте
структурную формулу.
10.12.2021
Алексеева Л.А.
4.
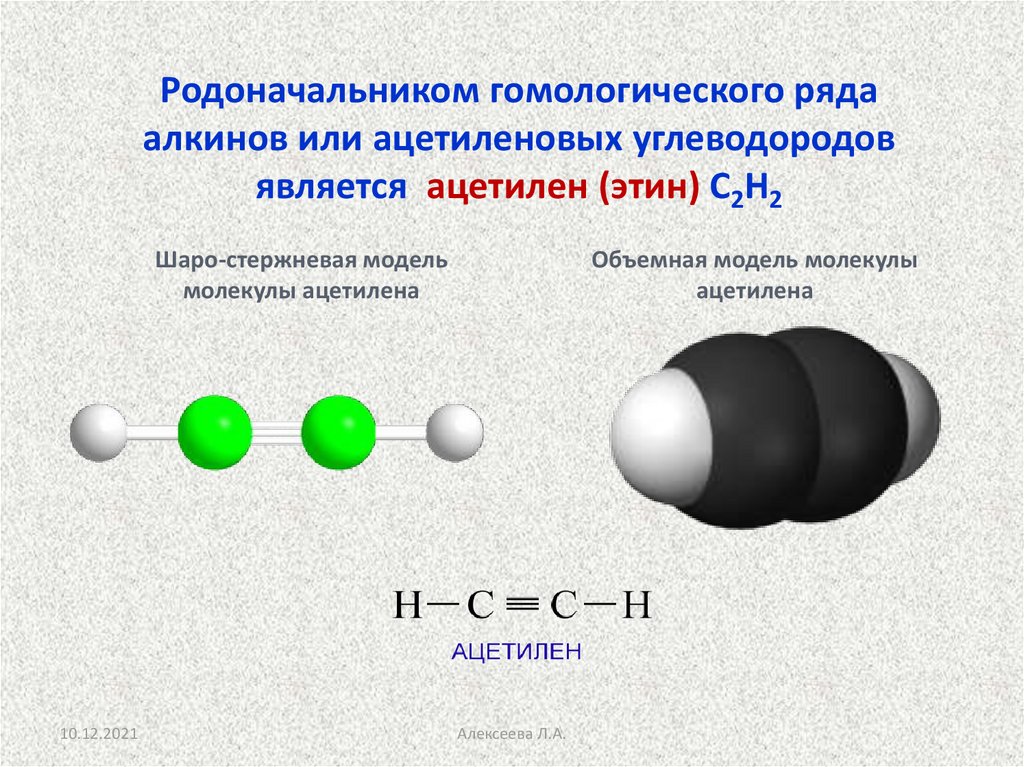
Родоначальником гомологического рядаалкинов или ацетиленовых углеводородов
является ацетилен (этин) С2Н2
Шаро-стержневая модель
молекулы ацетилена
10.12.2021
Объемная модель молекулы
ацетилена
Алексеева Л.А.
5. Схема образования sp -гибридных орбиталей
6. Строение алкинов(характеристика тройной связи)
• Вид гибридизации атома С–sp –
III валентное состояние атома углерода
• Валентный угол –
180 градусов
• Вид связи –
1 тройная связь
• По типу перекрывания – δ и 2 π
Длина связи С С –
0,120 нм
• Строение ─
линейное
7.
Гомологический рядацетиленовых углеводородов
(алкинов)
СН Ξ СН
С2Н2 этин, ацетилен
СН Ξ С – СН3
С3Н4 пропин
СН Ξ С – СН2 – СН3
С4Н6 бутин-1
СН Ξ С – СН2 – СН2 – СН3
С5Н10 пентин-1
Общая формула алкинов: СnH2n-2, где n ≥ 2
Запишите определение алкинов (стр.99)
10.12.2021
Алексеева Л.А.
8.
Особенности составления названийалкинов по международной
номенклатуре
• Главная цепь углеродных атомов должна включать
в себя тройную углерод - углеродную связь.
• Нумерация цепочки начинается с того конца цепи,
к которому ближе тройная связь.
• Основа названия ацетиленовых углеводородов
ин
оканчивается суффиксом , указывающим на
наличие в молекуле тройной связи.
• Положение тройной связи в названии указывается
цифрой после суффикса -ин.
10.12.2021
Алексеева Л.А.
9.
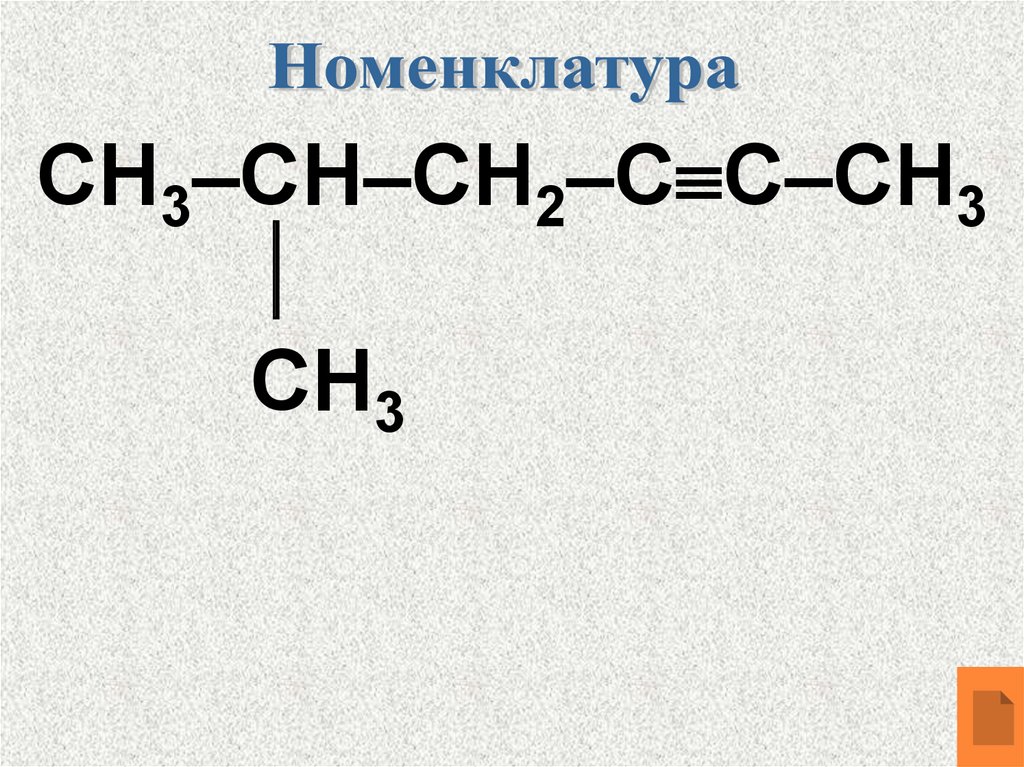
СН3–СН–СН2–С С–СН3СН3
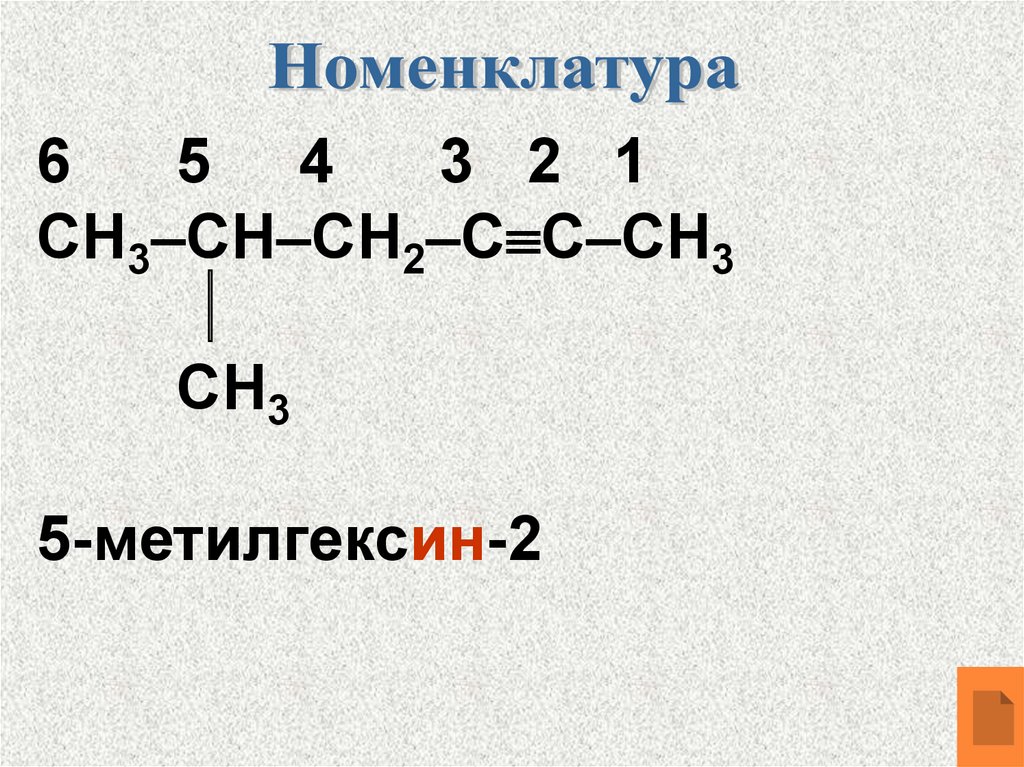
10.
65 4
3 2 1
СН3–СН–СН2–С С–СН3
СН3
5-метилгексин-2
11. Выполните упражнение:
• Постройте формулувещества:
• 3,3–диметилгексин-1
• 4-метилпентин-2
12. Изомерия и номенклатура алкинов:
Для ацетиленовых углеводородовхарактерна структурная изомерия:
изомерия углеродной цепи
изомерия положения кратной связи
межклассовая изомерия
(с диеновыми углеводородами и
циклоалкенами)
10.12.2021
Алексеева Л.А.
13.
Структурная изомерия1. Изомерия положения тройной связи (начиная с С4Н6):
СН С СН2 СН3
СН3 С С СН3
бутин-1
бутин-2
2. Изомерия углеродного скелета (начиная с С5Н8):
СН С СН2 СН2 СН3
СН С СН СН3
СН3
пентин-1
3-метилбутин-1
3. Межклассовая изомерия с алкадиенами и циклоалкенами,
(начиная с С4Н8):
СН = СН
СН С–СН2–СН3
СН2=СН–СН=СН2
СН2 –СН2
бутин-1
бутадиен-1,3
циклобутен
14.
Выполните задание:• 1.Для вещества 3-метилпентин-1
постройте формулы: а) двух
гомологов, б) по одному изомеру
каждого вида. Назовите все вещества.
•П.13 стр.99-101, конспект
10.12.2021
АлексеевУУЛ.А.
15.
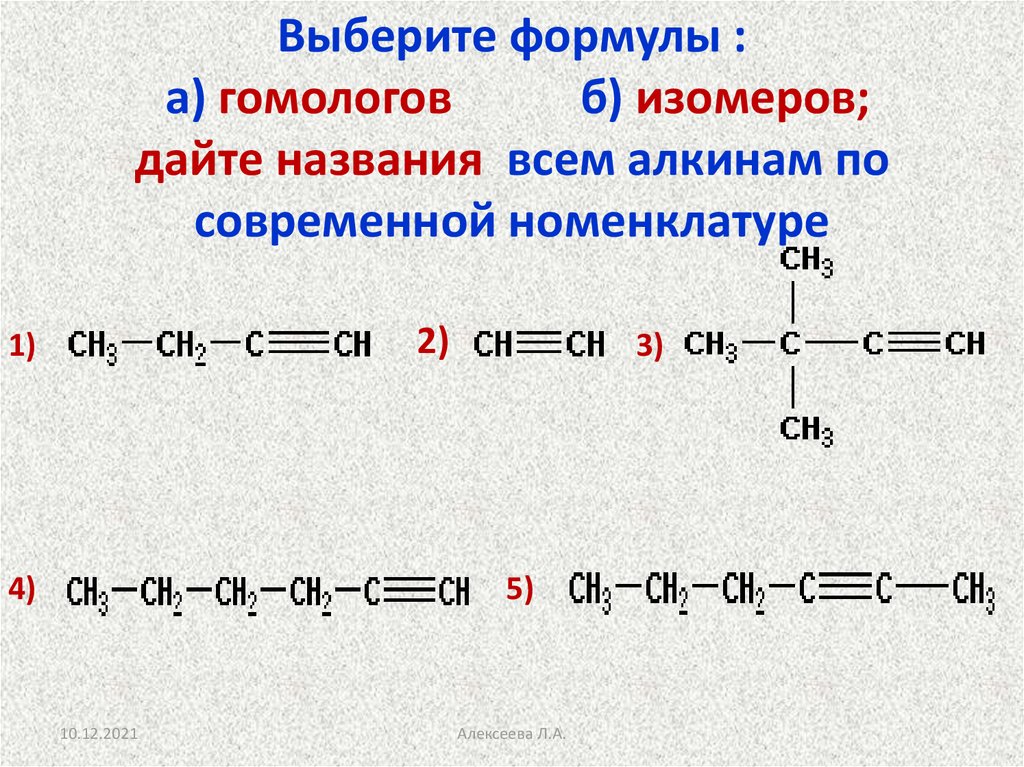
Выберите формулы :а) гомологов
б) изомеров;
дайте названия всем алкинам по
современной номенклатуре
2)
1)
4)
3)
5)
10.12.2021
Алексеева Л.А.
16.
При обычных условиях алкины С2Н2 - С4Н6 – газы, С5Н8 С16Н30 – жидкости, с С17Н32 – твердые вещества. Алкиныимеют специфический запах.
Алкины плохо растворимы в воде, но лучше чем алканы и
алкены. Растворимы в органических растворителях.
Температуры кипения и плавления алкинов выше, чем у
соответствующих алкенов. Температуры кипения и
плавления ацетиленовых
углеводородов увеличиваются с ростом их молекулярной
массы.
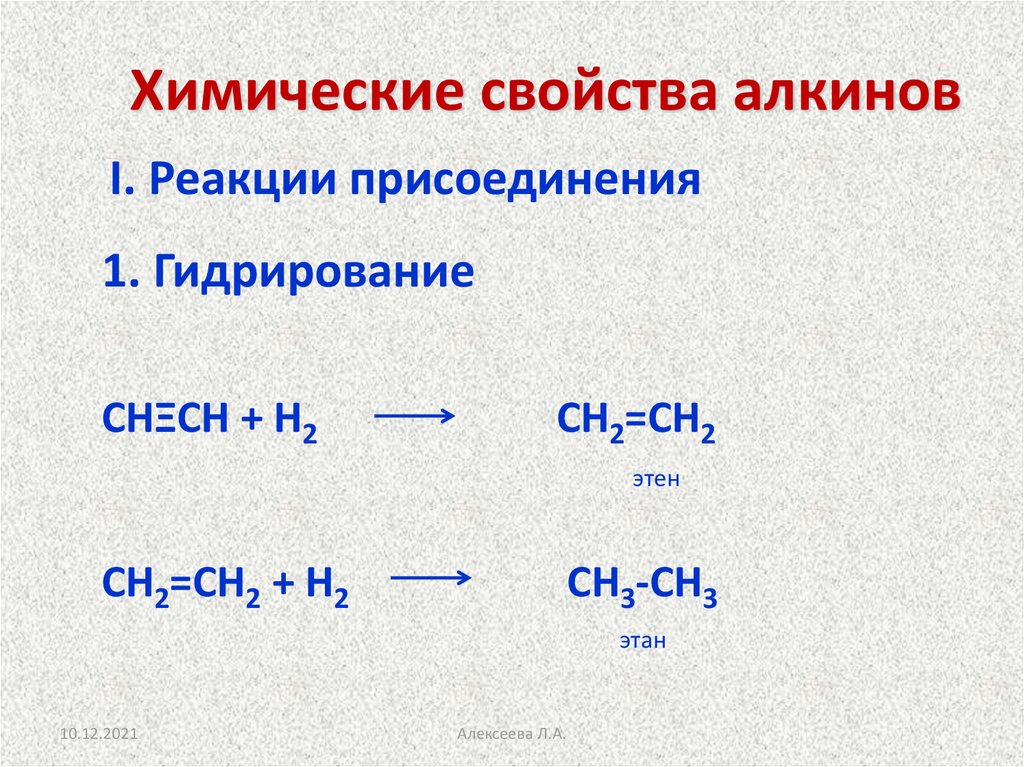
17. Химические свойства алкинов
I. Реакции присоединения1. Гидрирование
СНΞСН + Н2
СН2=СН2
этен
СН2=СН2 + Н2
СН3-СН3
этан
10.12.2021
Алексеева Л.А.
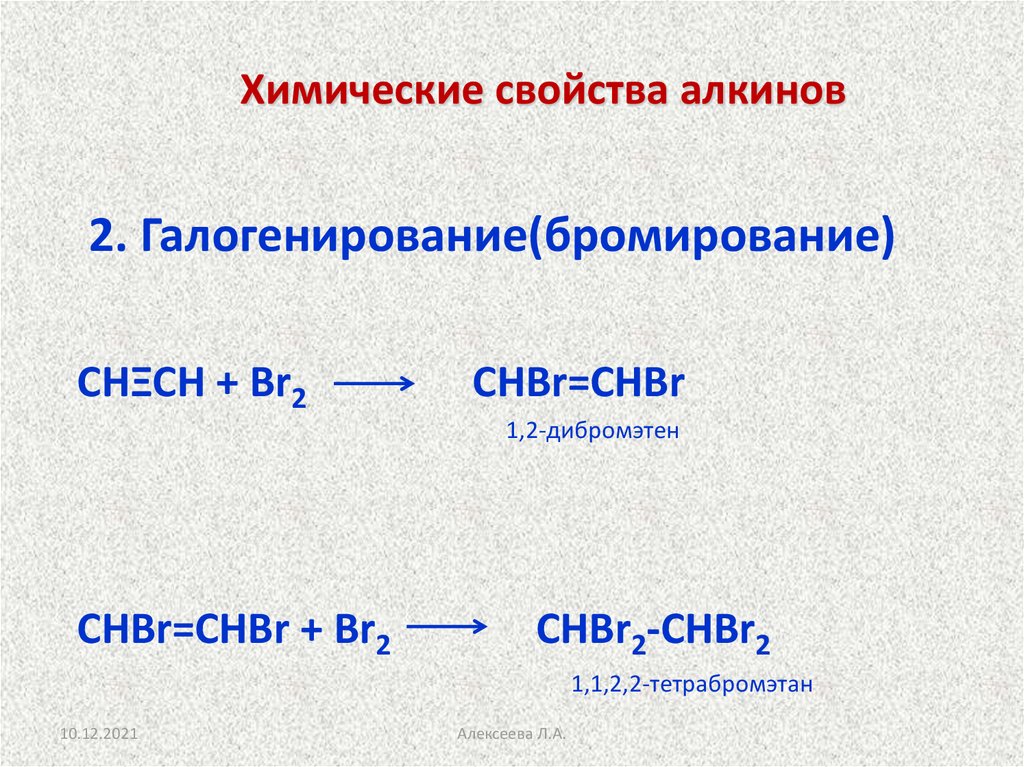
18. Химические свойства алкинов
2. Галогенирование(бромирование)СНΞСН + Br2
СНBr=СНBr
1,2-дибромэтен
СНBr=СНBr + Br2
СНBr2-СНBr2
1,1,2,2-тетрабромэтан
10.12.2021
Алексеева Л.А.
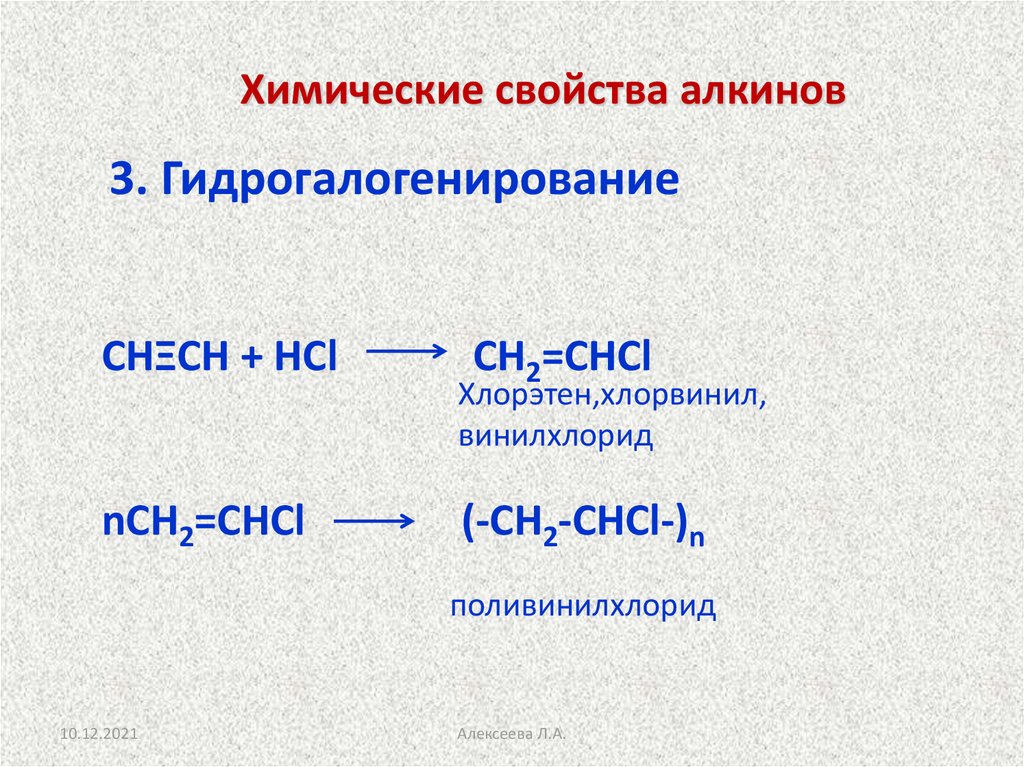
19. Химические свойства алкинов
3. ГидрогалогенированиеСНΞСН + НCl
nСН2=СНCl
СН2=СНCl
Хлорэтен,хлорвинил,
винилхлорид
(-СН2-СНCl-)n
поливинилхлорид
10.12.2021
Алексеева Л.А.
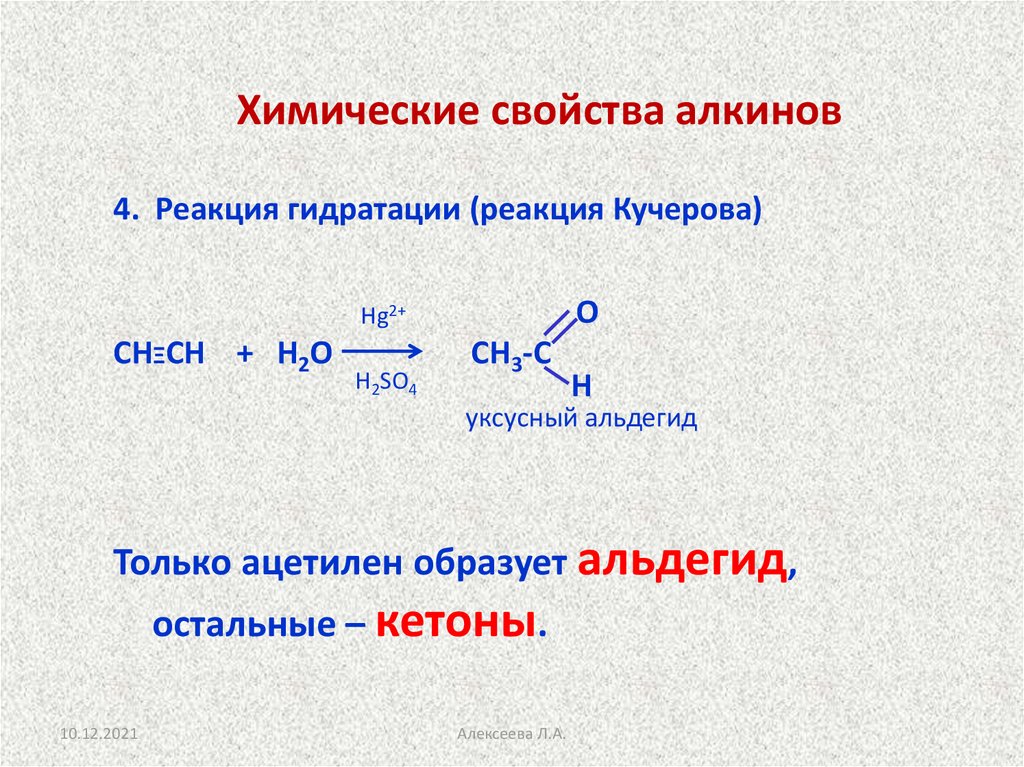
20.
Химические свойства алкинов4. Реакция гидратации (реакция Кучерова)
О
Hg2+
СНΞСН + Н2О
H2SO4
СН3-С
Н
уксусный альдегид
Только ацетилен образует альдегид,
остальные – кетоны.
10.12.2021
Алексеева Л.А.
21.
4. Гидратация (реакция Кучерова)HgSO4
CH3 C CH + HOН [CH3 C=CH2 ] CH3 C CH3
OH
O
Ацетон, пропанон
(кетон)
22. 5.Реакция полимеризации
1. Димеризацияпод действием водного
раствора CuCl и NH4Cl:
НC CH + НC CH Н2C=CH C CH
(винилацетилен)
2. Тримеризация ацетилена над
активированным углем приводит к
образованию бензола (реакция Зелинского):
Сакт., 400 С
3НC CH С6H6 (бензол)
23.
Химические свойства алкиновII. Реакции окисления
1. Горение
2 С2Н2 + 5 О2
4 СО2 + 2 Н2О + 2600кДж
Температура пламени горения ацетилена в
чистом кислороде достигает 3200оС .
Таким пламенем можно резать и
сваривать металлы
10.12.2021
Алексеева Л.А.
24.
Химические свойства алкинов2. Ацетилен обесцвечивает
водный раствор перманганата
калия
(качественная реакция на
непредельные углеводороды)
10.12.2021
Алексеева Л.А.
25. Окисление
Ацетилен и его гомологи окисляются перманганатомкалия с
расщеплением тройной связи и образованием
карбоновых кислот:
Н C C Н + [O]
(или СО2)
KMnO4
HOOC COOH (в кислой среде
KMnO4
Н C C Н + [O]
среде)
КOOC COOК (в нейтральной
Алкины обесцвечивают раствор KMnO4,
что используется
для их качественного определения.
26. III. Реакции замещения
При взаимодействии ацетилена (или R C C H) саммиачными
растворами оксида серебра выпадают осадки
нерастворимых ацетиленидов:
HC CH + 2[Ag(NH3)2]OH
AgC CAg + 4NH3 + 2H2O
Качественная реакция
на
концевую тройную
связь
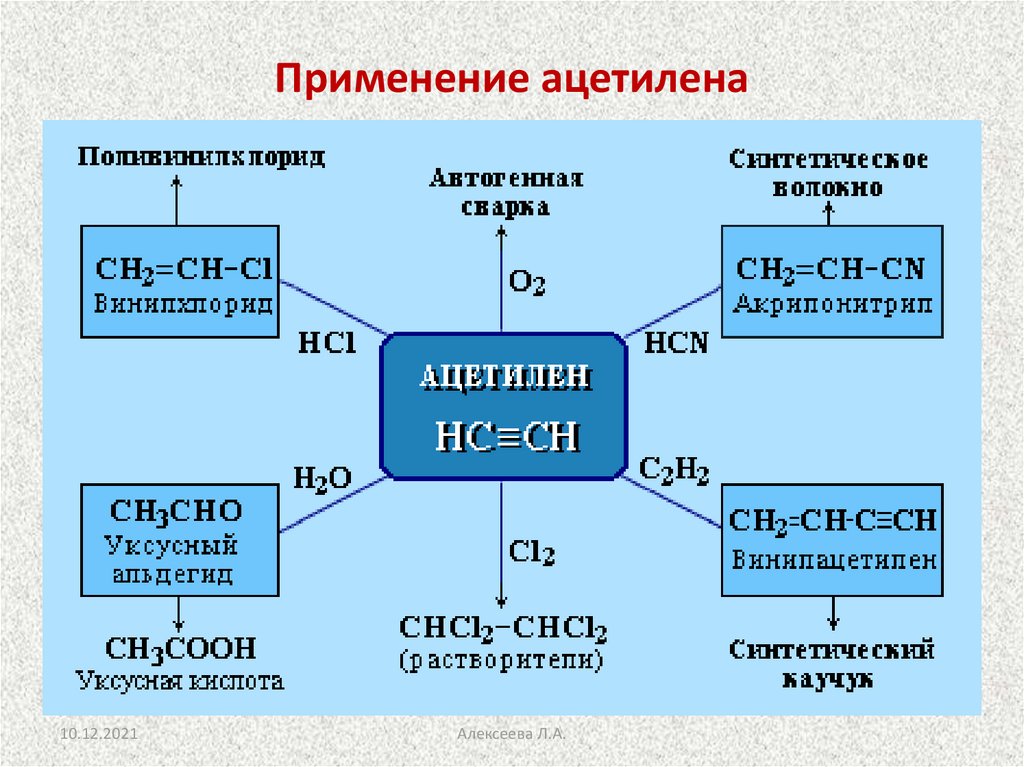
27. Применение ацетилена
10.12.2021Алексеева Л.А.
28. Способы получения ацетилена Промышленные способы
1. Пиролиз метана (природного газа)2 СН4
1500oС
С2Н2 + 3 Н2
ацетилен
2. Гидролиз карбида кальция
СаС2 + 2 Н2О
С2Н2 + Са(ОН)2
ацетилен
Лабораторные способы
1. Дегидрогалогенирование (уравнения см.
учебник стр.102)
10.12.2021
Алексеева Л.А.
29.
Дом. заданиеп.13, конспект в тетради, выучить
хим. свойства алкинов, №4 стр.108
10.12.2021
Алексеева Л.А.




















 Химия
Химия








