Похожие презентации:
Химия
1. ХИМИЯ
Кандидат химических наук,доцент
Осипова Алла Вячеславовна
2. ЛИТЕРАТУРА
• Слесарев В.И. Химия: Основы химииживого.
• Саргаев П.М. Неорганическая химия
• Цитович И.К. Основы аналитической
химии
3.
Учебные вопросы лекции:1. Основные понятия науки «Химия».
Химические реакции, их классификация.
2. Основные законы химии.
3. Эквивалент. Закон эквивалентов.
4. Первый учебный вопрос.
Основные понятия науки «Химия».Химические реакции, их
классификация.
5. Химия – наука о веществах, их строении, свойствах и превращениях. Все тела в природе состоят из веществ. Каждое вещество имеет
определенные физические и химическиесвойства.
• Физические свойства вещества – агрегатное
состояние, плотность, растворимость, температура
плавления, температура кипения, цвет, вкус, запах и
т.д.
Химические свойства вещества – это способность
данного вещества превращаться в другие вещества.
6.
7.
• Физические явления – это изменения формы илиагрегатного состояния веществ, в результате которых не
образуются новые вещества.
Жидкая вода при 100 º С (температура кипения)
превращается в пар (газообразное состояние), а при 0 º С
(температура плавления) превращается в лед (твердое
состояние).
• Превращения одних веществ в другие называются
химическими реакциями, или химическими
явлениями.
Сгорание топлива:
CH4 + 2O2 = CO2 + 2H2O + Q
Ржавление железа:
4Fe +3O2 + 6H2O = 4Fe(OH)3
8. Основные понятия атомно-молекулярного учения
В центре любого атома находится ядро, котороесостоит из протонов и нейтронов, имеющих общее
название – нуклоны (от англ. nucleus – ядро).
• Протон – это частица, которая имеет
положительный заряд. Заряд протона в условных
единицах равен +1. Символ протона – 1р.
• Нейтрон – нейтральная частица, заряд нейтрона
равен 0. Символ нейтрона – 0n.
Ядра атомов имеют положительный заряд, так как
состоят из протонов с положительным зарядом и
нейтральных нейтронов.
• Вокруг ядра движутся электроны, которые имеют
отрицательный заряд. Заряд электрона в условных
единицах равен -1. Символ электрона ē.
Протоны, нейтроны и электроны называются элементарными
частицами.
9.
Любой атом содержит равное число протонов иэлектронов, поэтому сумма положительных
зарядов в атоме равна сумме отрицательных
зарядов. Следовательно, атомы являются
электронейтральными частицами.
Ядра различных атомов содержат разное число
протонов и нейтронов.
Число протонов в ядре обозначают буквой Z,
число нейтронов – N. Число нуклонов (сумма
Z и N) называется массовым числом атома
и обозначается буквой A.
A =Z+N
10.
Вид атомов с одинаковым зарядом ядерназывается химическим элементом.
Для каждого элемента известны
разновидности атомов, отличающиеся
по массе (по числу нейтронов в ядрах).
Эти разновидности атомов называются
изотопами. Например, элемент
водород имеет три изотопа: протий,
дейтерий, тритий, с массовыми числами
соответственно 1, 2 и 3.
11.
• Атомы – мельчайшие химически неделимыечастицы вещества, они распадаются лишь
при ядерных реакциях. Атомы, соединяясь
друг с другом, образуют молекулы.
Молекулой называют наименьшую частицу
вещества, обладающую его химическими
свойствами. Молекулы при химических
реакциях распадаются, т.е. они являются
химически делимыми частицами.
Состав любой молекулы можно выразить
химической формулой.
12. Химические формулы
3СuCl25Al2O3
4FeCl3
• СН – эмпирическая (простейшая);
• С6Н6 – истинная;
– структурная.
13.
14.
15.
16.
Абсолютные атомные массы• Масса атома водорода: 1,67·10-27 кг = 1,67·1024 г; масса атома кислорода: 26,67·10-27 кг.
Относительные атомные массы
За единицу атомных масс принимается 1/12
часть абсолютной массы атома углерода С.
• Атомная единица массы (а.е.м.) – это 1/12
часть абсолютной массы атома углерода.
• Относительной атомной массой (Аr)
химического элемента называется величина,
равная отношению средней массы атома
элемента к 1/12 массы атома углерода
(безразмерная величина).
17.
• Относительной молекулярной массой(Mr) вещества называется величина, равная
отношению средней массы молекулы
вещества к 1/12 массы атома углерода
(безразмерная величина).
Mr (H2O) = Аr (H) + Аr (H) + Аr (O) =
1+1+16=18
Масса вещества выражается в кг, г или
других единицах массы.
Единицей количества вещества является
моль.
Моль – это единица количества вещества,
содержащая столько же структурных
элементов (атомов, молекул), сколько
содержится атомов в 12 г углерода 12С.
18.
• Количество вещества (n, числомолей вещества) вычисляется по
формуле:
m
n
M
где m – масса вещества, г;
M – молярная масса вещества, равная
отношению массы вещества к
количеству вещества (M = m/ n),
г/моль.
• Молярная масса вещества (М) – это
масса одного моля (г/моль).
19.
• Из определения понятия «моль» следует, чтоэто число равно числу молекул (атомов) в
одном моле любого вещества. Оно
называется числом Авогадро и
обозначается символом NA.
NA = 6,02 ·1023 молекул (атомов)/моль =
6,02 ·1023 моль -1
Следовательно, 1 моль любого вещества
содержит 6,02 ·1023 молекул или атомов.
Количество вещества n равно отношению
данного числа молекул (атомов) N к числу
молекул (атомов) в 1 моле NA:
N
n
NA
20. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Химическая реакция – превращениевеществ с образованием новых соединений с
новыми свойствами.
I. По признаку изменения степеней окисления
элементов в молекулах реагирующих
веществ:
а) окислительно-восстановительные
реакции (реакции с переносом электронов);
Zn + 2 HCl
ZnCl2 + H2
б) реакции без изменения степеней окисления.
21.
II. По знаку теплового эффекта:а) экзотермические (происходит выделение теплоты);
б) эндотермические (происходит поглощение теплоты).
III. По признаку однородности реакционной системы:
а) гомогенные (протекают в однородной системе);
б) гетерогенные (протекают в неоднородной системе).
IV. В зависимости от наличия катализатора:
а) каталитические (протекают в присутствии катализатора);
б) некаталитические (протекают без катализатора).
V. По признаку обратимости:
а) необратимые (протекают только в одном направлении);
б) обратимые (протекают одновременно в прямом и в
обратном направлении).
22.
VI. По числу и составу исходных веществ(реагентов) и продуктов реакции:
а) Реакции соединения – это реакции, в ходе
которых из двух или нескольких веществ
образуется одно вещество более сложного
состава:
4Li + О2 → 2Li2O
CaO + SiO2 → CaSiO3
б) Реакции разложения – это реакции, при
протекании которых из одного сложного
вещества образуются два или несколько
более простых веществ:
2HgO → 2Hg + O2
CaCO3 → CaO + CO2
23.
в) Реакции замещения – это реакции междупростыми и сложными веществами, при
протекании которых атомы простого вещества
замещают атомы одного из элементов в молекуле
сложного вещества:
Zn + FeSO4 → ZnSO4 + Fe
Al + Fe2O3 → 2Fe + Al2O3
г) Реакции обмена – это реакции между двумя
сложными веществами, молекулы которых
обмениваются своими составными частями:
NaOH + HCl → NaCl + H2O
CuSO4 + 2 NaOH → Cu(OH)2↓ + Na2SO4
В результате реакций обмена обычно образуются
осадок (↓), или газообразное вещество (↑), или
слабый электролит (например, вода).
24. Второй учебный вопрос.
Основные законы химии.25. ЗАКОН АВОГАДРО И СЛЕДСТВИЯ ИЗ НЕГО
В равных объемах (V) различных газовпри одинаковых внешних условиях
(температуре Т и давлении Р)
содержится одинаковое число
молекул (N).
Если V1 = V2
T1 = T2
, то N1= N2
P1 = P2
Первое следствие. Одинаковое число молекул различных газов
при одинаковых условиях занимает одинаковый объем:
Если N1= N2
T 1 = T2
, то V1 = V2
P1 = P2
26.
Следовательно, объем одного моля любого газа (т.е.6,02 ·1023 молекул) при определенных внешних
условиях есть величина постоянная.
Объем одного моля газа называется его молярным
объемом и обозначается VM. Молярный объем газа
зависит от температуры и давления. В химии обычно
используют молярный объем газа при нормальных
условиях.
Нормальные условия (н.у.)
Нормальная температура
0 °С или 273 К
Нормальное давление
101325 Па (101,3 кПа)
27.
Молярный объем любого газа при н.у.равен 22,4 л/моль.
VM (газа) н.у. = 22,4 л/моль.
Молярный объём газа – это отношение объёма
вещества (газа) к количеству этого вещества:
V
Vm
n
Второе следствие. Используется для расчета
относительных плотностей газов.
28.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВВ 1748 г. М.В.Ломоносов и в 1789 г. А.Лавуазье
независимо друг от друга
открыли закон сохранения
массы веществ в химических реакциях:
Общая масса веществ,
которые вступают в химическую реакцию,
равна общей массе продуктов реакции.
аА + вВ
АаВв
m(A) + m(B) = m(АаВв)
29. ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА (Ж.Пруст, 1808)
Каждое чистое веществонезависимо от способа его
получения всегда имеет постоянный
качественный и количественный состав.
ЗАКОН КРАТНЫХ ОТНОШЕНИЙ
(Д.ДАЛЬТОН, 1803)
Если химические элементы А и В
могут соединяться между собой,
образуя несколько
разных соединений,
то массы элемента А,
который связывается
с постоянным количеством элемента В,
относятся между собой
как небольшие целые числа.
30.
Закон эквивалентов – основа количественныхрасчетов в химической реакции. Сформулировал в
1793 году немецкий химик Иеремия Рихтер.
31.
Соединения постоянного состава (дальтониды),или стехиометрические соединения – химические
соединения, состав которых постоянен и не зависит
от способа получения:
H2O, CO2, NH3, NO2, SO3
Соединения переменного состава (бертоллиды,
открыты в начале 20 века
советским физико-химиком Курнаковым Н.С.),
или нестехиометрические соединения –
химические соединения, состав которых
зависит от способа их получения.
Количество атомов одного элемента,
приходящееся на один атом другого
элемента, в таких соединениях
выражается дробным числом, например, сульфиды:
Fe1,1S
и
FeS1,1
отличаются содержанием железа и серы.
32. ЗАКОН ОБЪЁМНЫХ ОТНОШЕНИЙ (Ж.Л.ГЕЙ-ЛЮССАК, 1802 г)
Объёмы вступающих в реакцию газовпри одинаковых условиях (температуре
и давлении) относятся между собой как
соответствующие стехиометрические
коэффициенты:
аА + вВ
→
АаВв
Пример:
№
опыта
V(H2)
1.
200 мл
2.
10 л
3.
3,2 л
V ( A) a
V ( B) b
2Н2(г) + О2(г)
V(O2)
100 мл
5 л
1,6 л
→ 2Н О(г)
2
V(H2O)
200 мл
10 л
3,2 л
V(H2):V(O2):V(H2O)
2 : 1 : 2
2 : 1 : 2
2 : 1 : 2
33.
Химический эквивалент элемента –это такое количество его атомов,
которое соединяется полностью с 1
молем атомов водорода или замещает
такое же количество атомов водорода в
его соединениях.













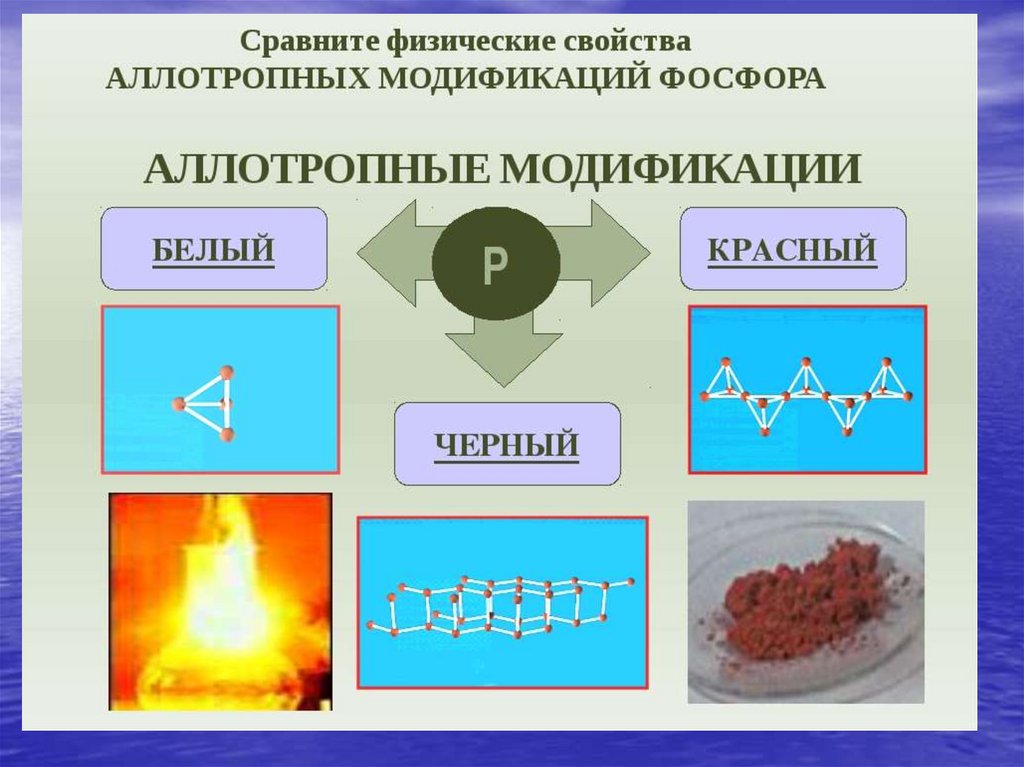
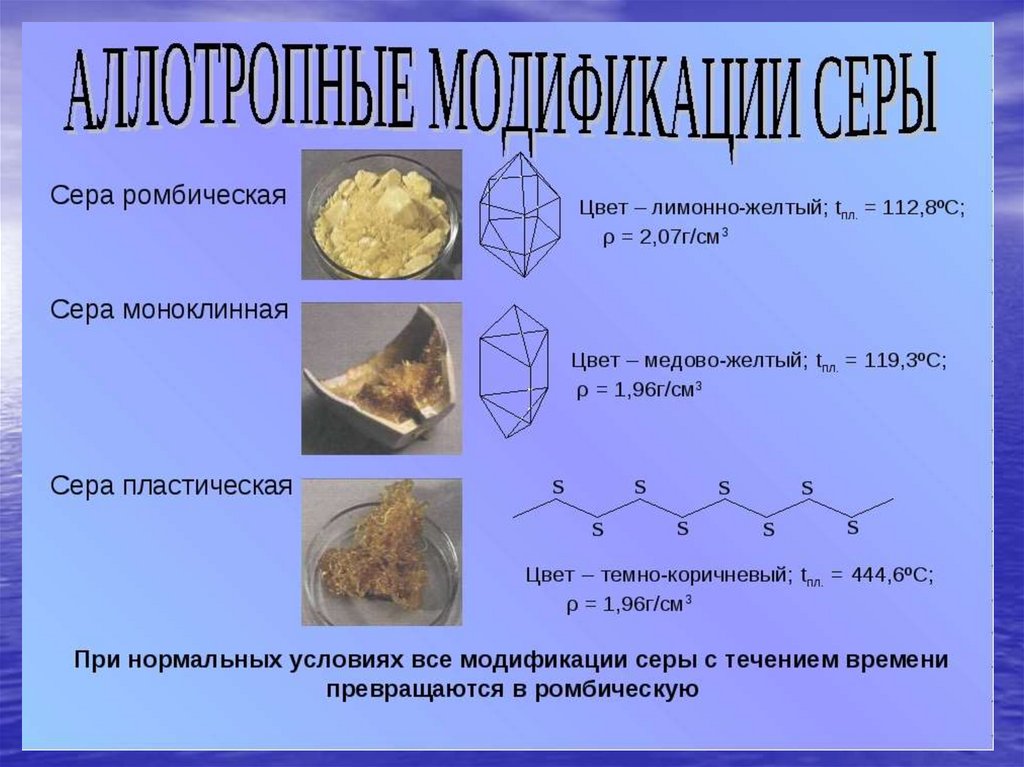



















 Химия
Химия








