Похожие презентации:
Тест для подготовки к ЕГЭ по химии 2017
1.
ТЕСТ ДЛЯ ПОДГОТОВКИК ЕГЭ ПО ХИМИИ 2017
Карташова Людмила
Александровна,
учитель химии
МАОУ СОШ №27
2.
1) знакомство с материалом экзаменационнойработы по химии;
2) отработка умения решения заданий типа
ЕГЭ.
3) проверка учеником своей подготовленности
к экзамену;
4) набор опыта выполнения тестовых заданий
по химии
3.
ИНСТРУКЦИИК ВЫПОЛНЕНИЮ ТЕСТА
Экзаменационная работа состоит из двух частей,
включающих в себя 34 задания. Часть 1 содержит
29 заданий с кратким ответом, часть 2 содержит 5
заданий с развёрнутым ответом. На выполнение
экзаменационной работы по химии отводится 3,5
часа (210 минут).
Чтобы проверить правильность суждения,
наведите курсор на квадраты, находящиеся в
нижнем поле слайда и кликнете на левую кнопку
мыши – откроются правильные ответы.
Для перехода к другому вопросу щелкните левой
кнопкой мыши на поле слайда или используйте
кнопки переключения слайдов в левом нижнем
углу.
4.
Часть 1 содержит 29 заданий с кратким ответом.Ответом к заданиям 1–26 является последовательность
цифр.
В заданиях несколько правильных ответов.
Цифры в ответах на задания 5, 10–12, 18, 19, 22–26
могут повторяться
ТМ
ТР
ссылка на таблицу Менделеева
ссылка на таблицу растворимости
5.
Для выполнения заданий 1–3 используйте следующийряд химических элементов. Ответом в заданиях 1–3
является последовательность цифр, под которыми
указаны химические элементы в данном ряду.
1) B
2) K
3) Al
4) Cs
5) Rb
1. Атомы каких из предложенных элементов имеют
электронную конфигурацию внешнего энергетического
уровня ns2np1
Ответ
1
3
ТМ
ТР
6.
Для выполнения заданий 1–3 используйте следующий рядхимических элементов. Ответом в заданиях 1–3 является
последовательность цифр, под которыми указаны
химические элементы в данном ряду.
1) B
2) K
3) Al
4) Cs
5) Rb
2. Выберите три химических элемента, принадлежащих
к одной главной подгруппе Периодической системы, и
расположите их в порядке убывания атомного радиуса
Ответ
4
5
2
ТМ
ТР
7.
Для выполнения заданий 1–3 используйте следующийряд химических элементов. Ответом в заданиях 1–3
является последовательность цифр, под которыми
указаны химические элементы в данном ряду.
1) B
2) K
3) Al
4) Cs
5) Rb
3. Из числа предложенных элементов выберите те,
которые проявляют степень окисления +3
Ответ
1
3
ТМ
ТР
8.
4. Из предложенного перечня выберите два соединения,в которых присутствует ионная химическая связь.
1) H2SO4
2) Na2SO3
3) Cl2O3
4) Mg(ClO4)2
5) HClO4
Ответ
2
4
ТМ
ТР
9.
5. Установите соответствие между формулой веществаи классом/группой, к которому(-ой) это вещество
принадлежит: к каждой позиции, обозначенной буквой,
подберите соответствующую позицию из второго
столбца, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
КЛАСС/ГРУППА
1) (NH4)Cr2O4
1)
амфотерный оксид
2) (CuOH)2SO4
2)
средняя соль
3) Cr2O3
3)
основный оксид
4)
основная соль
Ответ
А
2
Б
4
В
1
ТМ
ТР
10.
6. Медь реагирует с каждым из набора веществ1) азот и хлорид меди
2) кислород и азотная кислота
3) водород и гидроксид натрия
4) аргон и разбавленная серная кислота
5) хлор и нитрат серебра
Ответ
2
5
ТМ
ТР
11.
7. Какие из перечисленных оксидов не реагируют сощелочами
1) SiO2
2) SO2
3) NO
4) ZnO
5) FeO
Ответ
3
5
ТМ
ТР
12.
8. При постепенном прибавлении избытка растворагидроксида калия к раствору хлорида алюминия
наблюдается
1) выпадение осадка
2) изменение окраски раствора
3) выделение бесцветного газа
4) растворение первоначально выпавшего осадка
5) отсутствие изменений
Ответ
1
4
ТМ
ТР
13.
9. Задана следующая схема превращений веществ:NaOH
H2SO4 (конц), t
FeCl2
X
Y
Определите, какие из указанных веществ являются
веществами X и Y.
1) сульфат железа(III)
2) сульфат железа(II)
3) гидроксид железа(II)
4) сульфид железа(III)
5) гидроксид железа(III)
Ответ
3
1
ТМ
ТР
14.
10. Установите соответствие между уравнениемреакции и свойством элемента азота, которое он
проявляет в этой реакции: к каждой позиции,
обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
СВОЙСТВА ХЛОРА
А) KClO3 → KCl + O2
Б) AgNO3 + NaCl → NaNO3+AgCl
1)
окислитель
2)
восстановитель
и окислитель, и
восстановитель
4) ни окислитель,
ни восстановитель
В) HCl + MnCl2 → MnCl2 + Cl2 + H2O 3)
Г) NaCl + H2O → H2 + NaOH + Cl2
Ответ
А
1
Б
4
В
2
Г
2
ТМ
ТР
15.
11. Установите соответствие между формулой веществаи реагентами, с каждым из которых это вещество
может взаимодействовать: к каждой позиции,
обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
1)
РЕАГЕНТЫ
Zn, NaCl, CO2
2)
AgNO3, Cl2, KOH
В) Al(OH)3
3)
HCl, H2SO4, KOH
Г) CuO
4)
Cu, NaOH, MgO
5)
H2SO4, H2, CO
В
3
Г
5
А) FeBr2
Б) HNO3
Ответ
А
2
Б
4
ТМ
ТР
16.
12. Установите соответствие между формулой веществаи классом/группой, к которому(-ой) это вещество
принадлежит: к каждой позиции, обозначенной буквой,
подберите соответствующую позицию из второго
столбца, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
КЛАСС/ГРУППА
А) бутадиен-1,3
1)
простые эфиры
Б) 2-метилпропанол-1
2)
сложные эфиры
В) этилформиат
3)
спирты
4)
углеводороды
Ответ
А
4
Б
3
В
2
ТМ
ТР
17.
13. Из предложенного перечня выберите два вещества,которые не являются гомологами
1) циклопентан и метилциклопентан
2) бутен и пентен
3) циклопропан и пропан
4) этан и гексан
5) бутадиен-1,2 и пропен
Ответ
3
5
ТМ
ТР
18.
14. Из предложенного перечня выберите два вещества,с которыми взаимодействует 2-хлорпропан
1) натрий
2) раствор серной кислоты
3) вода
4) азот
5) бромоводород
Ответ
1
3
ТМ
ТР
19.
15. Из предложенного перечня выберите два вещества,с которыми взаимодействует фенол
1) соляная кислота
2) сульфат натрия
3) гидроксид натрия
4) метан
5) бром
Ответ
3
5
ТМ
ТР
20.
16. Метиламин может быть получен привзаимодействии
1) CH4 и HNO3
2) CH3OH и N2
3) CH3NO2 и H2
4) [CH3NH3]Cl и KOH
5) CH3−CH3 и NH3
Ответ
3
4
ТМ
ТР
21.
17. Задана следующая схема превращений веществ:H2O
H2O (Hg2+)
СaC2
X
Y
Определите, какие из указанных веществ являются
веществами X и Y.
1) этандиол-1,2
2) этаналь
3) этин
4) метаналь
5) этанол
Ответ
3
2
ТМ
ТР
22.
18. Установите соответствие между исходнымивеществами и механизмом реакции
ИСХОДНЫЕ ВЕЩЕСТВА
МЕХАНИЗМ РЕАКЦИИ
1) радикальное замещение
А) C3H8 + Br2 →
2) радикальное присоединение
Б) CH3−CH=CH2 + Br2(р-р) →
3) электрофильное замещение
В) CH3−CH=CH2 + HBr →
Г)
4) электрофильное присоединение
+ HBr →
5) нуклеофильное присоединение
6) нуклеофильное замещение
Ответ
А
1
Б
4
В
4
Г
4
ТМ
ТР
23.
19. Установите соответствие между продуктом реакциии веществом, которое использовалось для его
получения
ПРОДУКТ РЕАКЦИИ
ИСХОДНОЕ ВЕЩЕСТВО
А) муравьиная кислота
Б) этанол
В) бензиловый спирт
Г) 2-метилпропанол-2
Ответ
А
4
Б
1
1)
ацетальдегид
2)
бутанол-2
3)
изобутилен
4)
хлороформ
5)
бензойная кислота
6)
фенилхлорметан
В
6
Г
3
ТМ
ТР
24.
20. Из предложенного перечня выберите два уравнениякаталитических реакций
1) CO + 2H2 = CH3OH
2) 4NH3 +3O2 = 2N2 + 6H2O
3) CH4 + 2O2 = CO2 + 2H2O
4) 4NH3 + 5O2 = 4NO + 6H2O
5) NaHCO3 + HBr = NaBr + CO2 + H2O
Ответ
1
4
ТМ
ТР
25.
21. Из предложенного перечня выберите два внешнихвоздействия, которые приведут к уменьшению
скорости реакции окисления оксида серы (IV)
1) добавление катализатора
2) понижение давления
3) увеличение концентрации кислорода
4) понижение температуры
5) увеличение концентрации оксида серы (IV)
Ответ
2
4
ТМ
ТР
26.
22. Установите соответствие между формулой соли ипродуктом, образующимся на катоде при электролизе
её водного раствора.
ФОРМУЛА СОЛИ
ПРОДУКТ НА КАТОДЕ
1)
водород
А) AgNO3
2)
кислород
Б) K2SO4
3)
серебро
В) Mg(NO3)2
4)
калий
5)
магний
6)
медь
Г) CuSO4
Ответ
А
3
Б
1
В
1
Г
6
ТМ
ТР
27.
23. Установите соответствие между названием соли и еёспособностью к гидролизу.
НАЗВАНИЕ СОЛИ
СПОСОБНОСТЬ К
ГИДРОЛИЗУ
А) хлорид аммония
1)
гидролиз по катиону
Б) сульфат калия
2)
гидролиз по аниону
В) карбонат натрия
3)
гидролиз не происходит
Г) сульфид алюминия
4)
необратимый гидролиз
Ответ
А
1
Б
3
В
2
Г
4
ТМ
ТР
28.
24. Установите соответствие между фактором,действующим на равновесную систему
2NO(г) + Cl2(г) → 2NOCl(г)
←
и направлением смещения равновесия в этой системе
ФАКТОР
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
А) добавление катализатора
Б) повышение концентрации
хлора
2)
В) понижение давления
3)
Г) повышение давления
Ответ
1)
А
3
Б
1
смещается в сторону
продуктов реакции
смещается в сторону
исходных веществ
не происходит смещение
равновесия
В
2
Г
1
ТМ
ТР
29.
25. Установите соответствие между названиями двухвеществ и реактивом, с помощью которого можно
различить эти вещества: к каждой позиции,
обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) пропанол-2 и глицерин
Б) пропанол-2 и бутанон
В) фенол и ацетон
Г) этилацетат и этанол
Ответ
А
3
Б
5
1)
РЕАКТИВ
K2SO4(р-р)
2)
[Ag(NH3)2]OH(р-р)
3)
Cu(OH)2(свежеосаждённый)
4)
KOH(р-р)
5)
K
В
5
Г
5
ТМ
ТР
30.
26. Установите соответствие между веществом иобластью его применения: к каждой позиции,
обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
ВЕЩЕСТВО
ОБЛАСТЬ ПРИМЕНЕНИЯ
1)
минеральные удобрения
2)
обеззараживание воды
В) пропанол-2
3)
Г) фенол
4)
сварка и резка металлов
компонент незамерзающих
жидкостей
производство пластмасс
А) ацетилен
Б) хлор
5)
Ответ
А
2
Б
4
В
3
Г
5
ТМ
ТР
31.
Ответом к заданиям 27–29 является число. Единицыизмерения физических величин писать не нужно.
Чтобы проверить, кликните на кнопку «ответ».
ТМ
ТР
ссылка на таблицу Менделеева
ссылка на таблицу растворимости
32.
Задания 30 – 34 выполните на отдельном листе, чтобыпроверить, кликните на кнопку «ответ»
ТМ
ТР
ссылка на таблицу Менделеева
ссылка на таблицу растворимости
33.
27. При растворении оксида меди(II) в избытке сернойкислоты образовалась соль массой 40 г. Вычислите
массу (в граммах) растворившегося оксида меди(II).
Ответ запишите число с точностью до десятых.
Ответ
2,7
ТМ
ТР
34.
28. Какой объём (н.у.) оксида серы(IV) (в литрах)теоретически может прореагировать с 39 л (н.у.)
кислорода?
Ответ запишите число с точностью до целых.
Ответ
78
ТМ
ТР
35.
29. При растворении оксида меди(II) в избытке сернойкислоты образовалась соль массой 40 г. Вычислите
массу (в граммах) растворившегося оксида меди(II).
Ответ запишите число с точностью до целых.
Ответ
20
ТМ
ТР
36.
Задания 30 – 34 выполните на отдельном листе, чтобыпроверить, кликните на кнопку «ответ»
ТМ
ТР
ссылка на таблицу Менделеева
ссылка на таблицу растворимости
37.
30. Используя метод электронного баланса, составьтеуравнение реакции
KNO2 + ... + H2SO4 → N2 + FeCl3 + ... + ... + H2O
Определите окислитель и восстановитель.
Ответ
ТМ
ТР
Содержание верного ответа и указания по оцениванию (допускаются иные
формулировки ответа, не искажающие его смысла)
Вариант ответа
Элементы ответа:
1) Составлен электронный баланс
1 2N+3 + 6ē → N20
6 Fe+2 – 1ē → Fe+3
2) Указано, что железо в степени окисления +2 (или хлорид железа(II))
является восстановителем, а азот в степени окисления +3 (или нитрит калия)
– окислителем
3) Определены недостающие вещества, и расставлены коэффициенты в
уравнении реакции:
2KNO2 + 6FeCl2 + 4H2SO4 = N2 + 4FeCl3 + Fe2(SO4)3 + K2SO4 + 4H2O
38.
31. Через раствор бромида алюминия пропустилиаммиак, при этом выпал осадок белого цвета.
Полученный осадок отделили и подействовали на него
раствором гидроксида калия, в результате чего осадок
полностью растворился. В полученный раствор по
каплям
добавляли
серную
кислоту.
Сначала
происходило выпадение белого осадка, а затем при
добавлении новой порции кислоты – его полное
растворение. Напишите уравнения четырёх описанных
реакций.
Ответ
Вариант ответа
Ответ включает в себя четыре уравнения возможных реакций,
соответствующих описанным превращениям:
1) AlBr3 + 3NH3 + 3H2O = Al(OH)3↓ + 3NH4Br
2) Al(OH)3 + KOH = K[Al(OH)4]
3) 2K[Al(OH)4] + H2SO4 = 2Al(OH)3↓ + K2SO4 + 2H2O
4) 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
39.
32. Напишите уравнения реакций, с помощью которыхможно осуществить следующие превращения:
H2O (Hg2+)
СH4→ HC ≡ CH
CH3−C−CH3
[Ag(NH3)2]OH, t
X1
X2
Ba(OH)2, t
t
X3
ǀǀ
O
При написании уравнений реакций используйте
структурные формулы органических веществ
Ответ
40.
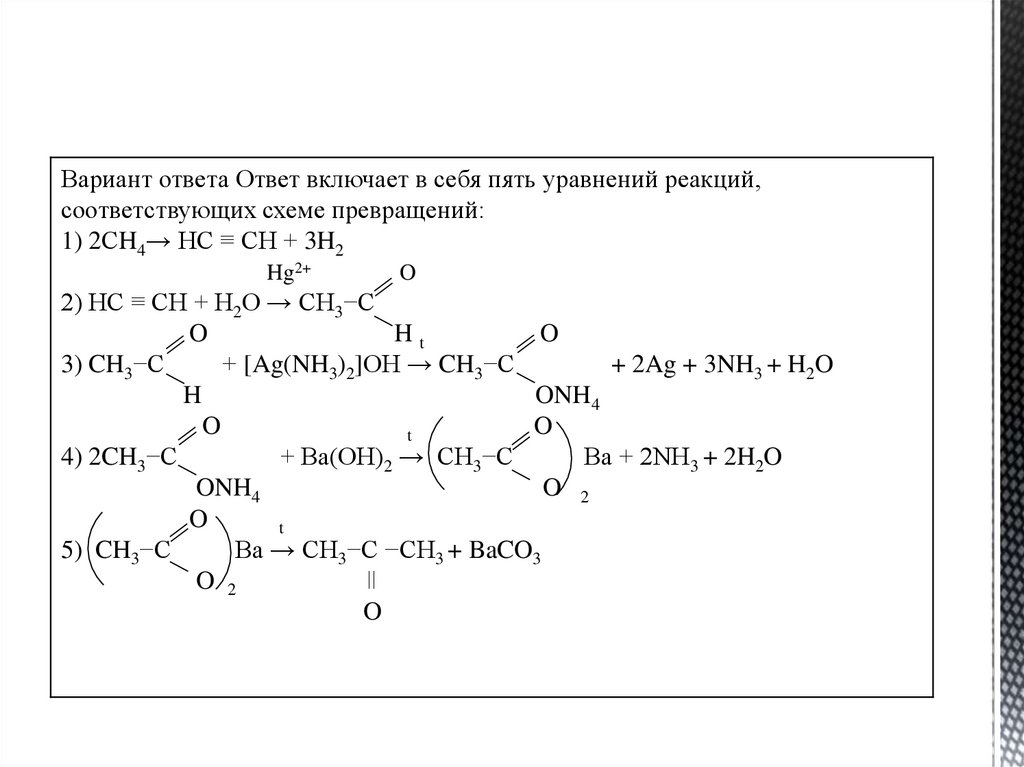
Вариант ответа Ответ включает в себя пять уравнений реакций,соответствующих схеме превращений:
1) 2СH4→ HC ≡ CH + 3H2
Hg2+
O
2) HC ≡ CH + H2O → CH3−C
O
Ht
O
3) CH3−C
+ [Ag(NH3)2]OH → CH3−C
+ 2Ag + 3NH3 + H2O
H
ONH4
O
O
t
4) 2CH3−C
+ Ba(OH)2 → CH3−C
Ba + 2NH3 + 2H2O
ONH4
O 2
O
t
5) CH3−C
Ba → CH3−C −CH3 + BaCO3
O 2
ǀǀ
O
41.
33. Оксид алюминия массой 10,2 г сплавили скарбонатом натрия массой 21,2 г. Весь плав растворили
в 250 мл хлороводородной кислоты (плотностью 1,10
г/мл) с массовой долей 20%. Рассчитайте массовую
долю хлороводорода в полученном растворе. В ответе
запишите уравнения реакций, которые указаны в
условии задачи, и приведите все необходимые
вычисления (указывайте единицы измерения искомых
физических величин).
Ответ
42.
Вариант ответаЭлементы ответа:
1) Записано уравнение реакции, и рассчитано количество вещества оксида
алюминия, карбоната натрия и алюмината натрия:
Al2O3 +Na2CO3 = 2NaAlO2 + CO2↑
n(Al2O3) = 10,2 / 102 = 0,1 моль; n(Na2CO3) = 21,2 / 106 = 0,2 моль
(в избытке, причём в избытке останется: 0,2 – 0,1 = 0,1 моль)
n(NaAlO2) = 0,2 моль; m(CO2) = 0,1 · 44 = 4,4 г
2) Записано уравнение реакции, и рассчитано количество вещества
хлороводорода, прореагировавшего с избытком Na2CO3:
Na2CO3 + 2HCl = 2NaCl + СO2↑ + H2O
n(HCl) = 2n(Na2CO3) = 2 · 0,1 = 0,2 моль
3) Записано уравнение реакции, и рассчитано количество вещества
хлороводорода, вступившего в реакцию с NaAlO2:
NaAlO2 + 4HCl = AlCl3 + NaCl + 2H2O
n(HСl) = 4n(NaAlO2). = 0,2 · 4 = 0,8 моль
4) Вычислена массовая доля хлороводорода в полученном растворе:
n(HCl)прореаг. = 0,2 + 0,8 = 1 моль
m(HCl) = 1 · 36,5 = 36,5 г; m(HCl)ост. = 250 · 1,1 · 0,2 – 36,5 г = 18,5 г
m(CO2) = 0,1 · 44 = 4,4 г
ω(HCl) = m(HCl) /m(р-ра) = 18,5 /10,2 + 21,2 + 250 · 1,1 – 4,4 – 4,4 = 0,062, или
6,2%
43.
34. При сгорании 37,8 г нециклического органическоговещества получили 123,2 г углекислого газа и 37,8 г
воды. Известно, что в результате присоединения 1 моль
брома к 1 моль этого вещества преимущественно
образуется соединение, содержащее атомы брома,
связанные с первичными атомами углерода. На
основании данных условия задания: 1) произведите
вычисления,
необходимые
для
установления
молекулярной формулы органического вещества; 2)
запишите
молекулярную
формулу
исходного
органического вещества; 3) составьте структурную
формулу этого вещества, которая однозначно отражает
порядок связи атомов в его молекуле; 4) напишите
уравнение реакции 1 моль этого вещества с 1 моль
брома.
Ответ
44.
Вариант ответаЭлементы ответа:
Общая формула вещества – CxHyOz
1) Найдено количества вещества продуктов сгорания:
n(CO2) = 123,2 / 44 = 2,8 моль n(H2O) = 37,8 / 18 = 2,1 моль
2) Определена молекулярная формула вещества:
n(C) = n(CO2) = 2,8 моль
n(H) = 2n(H2O) = 4,2 моль
m(O) = m(CxHyOz) – m(C) – m(H) = 37,8 – 2,8 · 12 – 4,2 = 0 г
x : y = 2,8 : 4,2 = 2 : 3
Молекулярная формула – C4H6
3) Составлена структурная формула вещества:
СН2 = СH − CH = CH2
4) Составлено уравнение реакции 1 моль этого вещества с 1 моль брома:
СН2 = СH − CH = CH2 + Br2 → СН2 − СH − CH − CH2
ǀ
ǀ
Br
Br
45.
В.Н. Доронькин, А.Г. Бережная Тематический тренинг.Задания базового и повышенного уровня сложности
Решу ЕГЭ - 2017












































 Химия
Химия








