Похожие презентации:
Электронное строение атома. Лекция № 2
1.
Лекция № 2Электронное строение
атома
Коршунов А.В.
д.х.н., профессор
2.
Материалистические взглядыв философии Древнего мира
Философия Запада
Древнегреческий атомизм (V-IV вв. до н.э.): атомы – мельчайшие
неделимые, не возникающие и не исчезающие, качественно однородные,
непроницаемые (не содержащие в себе пустоты) сущности (частицы),
имеют определённую форму, беспорядочно движутся и сталкиваются.
Демокрит
Тит Лукреций Кар (Др. Рим, 99-55 гг. до н.э.),
поэма «О природе вещей»:
«… существуют такие тела, что и плотны и вечны
Это – вещей семена и начала в учении нашем,
То, из чего получился весь мир, существующий ныне».
Лукреций
Философия Востока
Вайшешика (Др. Индия, III-II вв. до н.э.): Четыре элемента – земля,
вода, огонь, воздух – состоят из атомов (ану) , которым присущ набор
качеств (гуны), отличный для каждого элемента (вишеша). Все атомы
подчиняются общему всемирному закону (дхарма).
Улука-Канада
3.
Атомистические представленияв эпоху Возрождения и Нового времени
Г. Галилей (1564-1642) возродил древнегреческий атомизм.
П. Гассенди, 1654 г.: тела состоят из множества мельчайших
компактных эластичных атомов, отделенных друг от друга пустым
пространством, не заключающих в себе пустоты и потому неделимых
физически, но измеримых. Сотворены Богом.
Р. Бойль, 1661 г.: «Свойства тел не носят абсолютного характера, они
зависят от взаимоотношений между материальными компонентами, или
химическими элементами, каковыми являются простейшие тела,
представляющие собой предел разложения на более простые части».
И. Ньютон, 1686 г.: «… частицы тел … или стремятся друг к другу и
сцепляются в правильные фигуры, или же взаимно отталкиваются и
удаляются друг от друга».
4.
Представления об атомах,основанные на химических экспериментах
М. В. Ломоносов,1741 г.: Элемент есть часть тела, не состоящая из
каких-либо других меньших и отличных между собой тел; корпускулы
есть собрание элементов в одну небольшую массу; корпускулы
однородны, если состоят из одинакового числа одних и тех же элементов,
соединенных одинаковым образом; корпускулы разнородны, когда
элементы их различны и соединены различным образом или в различном
числе; от этого зависит бесконечное разнообразие тел.
Дж. Дальтон, 1808 г.: «Атомы — химические элементы, которые нельзя
создать заново, разделить на более мелкие частицы, уничтожить путём
каких-либо химических превращений. Любая химическая реакция просто
изменяет порядок группировки атомов». Сформулировал основные
положения атомно-молекулярного учения. Ввёл понятие «атомной массы».
Й.Я. Берцелиус, 1818 г.: на основании экспериментов с электролизом
предложил электрохимическую теорию, согласно которой атомы
различных элементов отличаются наличием преобладающего
электрического заряда. Предложил символы химических элементов.
Определил атомные массы элементов относительно атомной массы
кислорода.
5.
Ранние гипотезы о строении атомаУ. Праут (1816 г.) предположил, что
атомы химических элементов имеют
сложную структуру и образованы из
простейших атомов водорода путём их
конденсации. Веса атомов всех
химических элементов должны быть
кратны весу атома водорода.
Г. Фехнер (1828 г.) полагал, что атом
по своему строению напоминает
солнечную систему и подчиняется
законам Ньютона.
Л. Колдинг (1854 г.) считал строение
атомов (молекул) подобным
вращающимся планетарным системам,
обладающим электрическими и
магнитными свойствами.
Ф. Редтенбахер (1857 г.) считал, что
материя построена из «динамид»,
состоящих из массивных атомных
частиц, окруженных оболочками из
частиц невесомого эфира. Между
массивными ядрами действовали силы
притяжения, между частицами эфира –
отталкивания.
В. Вебер (1871 г.) предположил, что
атомы химических элементов состоят
из эквивалентного числа положительно
и отрицательно заряженных частиц,
вращающихся относительно друг друга
и приводящих к возникновению
вибраций .
Дж. Стоуни (1874 г.) предложил
термин «электрон» для обозначения
элементарного отрицательного
электрического заряда, участвующего
в электрохимических процессах и
являющегося частью молекул.
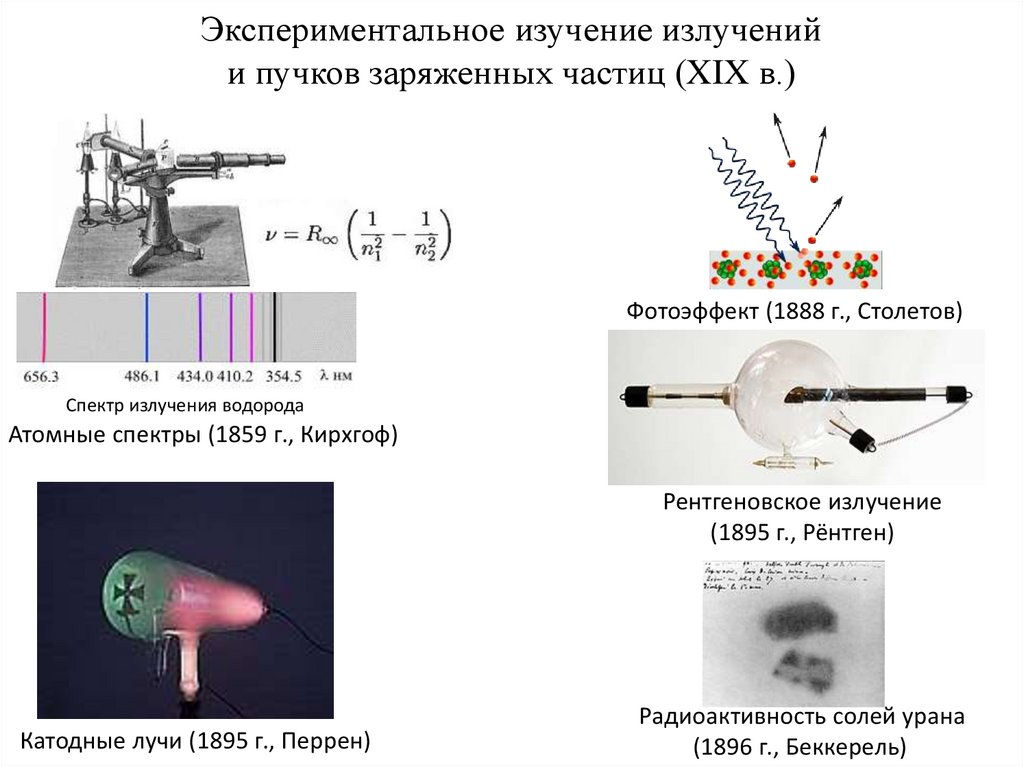
6.
Экспериментальное изучение излученийи пучков заряженных частиц (XIX в.)
Фотоэффект (1888 г., Столетов)
Спектр излучения водорода
Атомные спектры (1859 г., Кирхгоф)
Рентгеновское излучение
(1895 г., Рёнтген)
Катодные лучи (1895 г., Перрен)
Радиоактивность солей урана
(1896 г., Беккерель)
7.
Открытие электрона Дж. Томсоном (1897)Томсон показал, что характеристики катодных лучей не зависят от материала катода.
Он пришел к выводу, что катодный луч состоит из пучка отрицательно заряженных
частиц (электронов) и что электроны являются составляющими всей материи.
Томсон также смог рассчитать отношение массы электрона к его электрическому
заряду m/q.
В 1909 г. американский физик Р. Милликен рассчитал заряд электрона из
эксперимента с каплями масла в электрическом поле: qe = 1,602 1019 Кл.
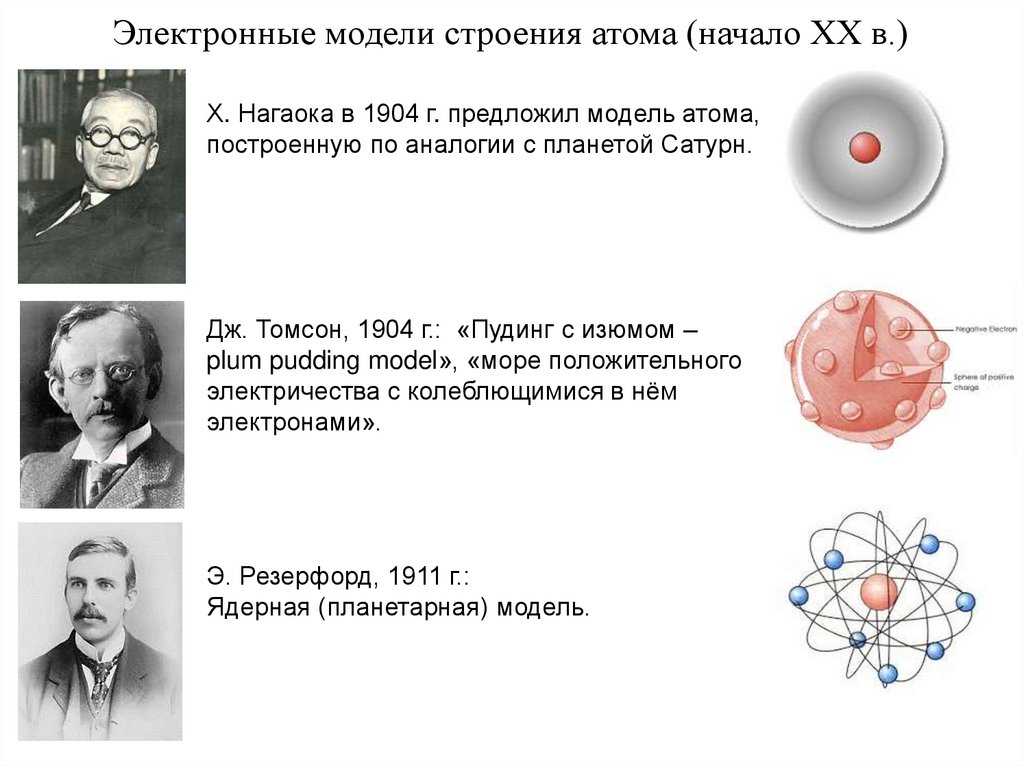
8.
Электронные модели строения атома (начало ХХ в.)Х. Нагаока в 1904 г. предложил модель атома,
построенную по аналогии с планетой Сатурн.
Дж. Томсон, 1904 г.: «Пудинг с изюмом –
plum pudding model», «море положительного
электричества с колеблющимися в нём
электронами».
Э. Резерфорд, 1911 г.:
Ядерная (планетарная) модель.
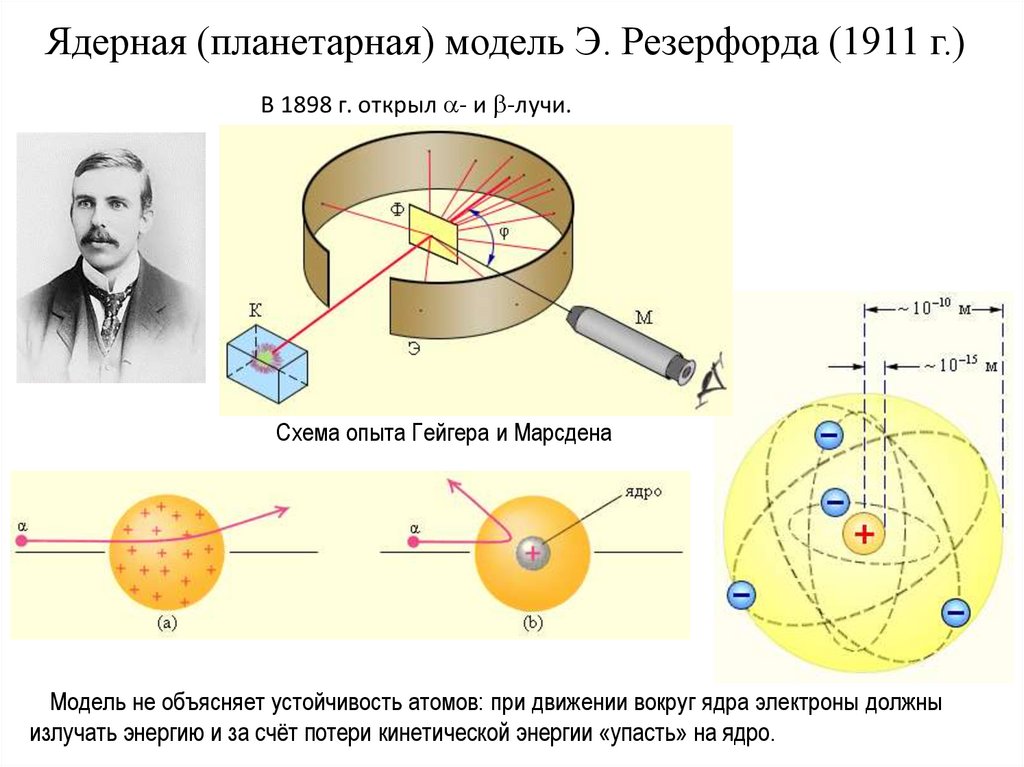
9.
Ядерная (планетарная) модель Э. Резерфорда (1911 г.)В 1898 г. открыл - и -лучи.
Схема опыта Гейгера и Марсдена
Модель не объясняет устойчивость атомов: при движении вокруг ядра электроны должны
излучать энергию и за счёт потери кинетической энергии «упасть» на ядро.
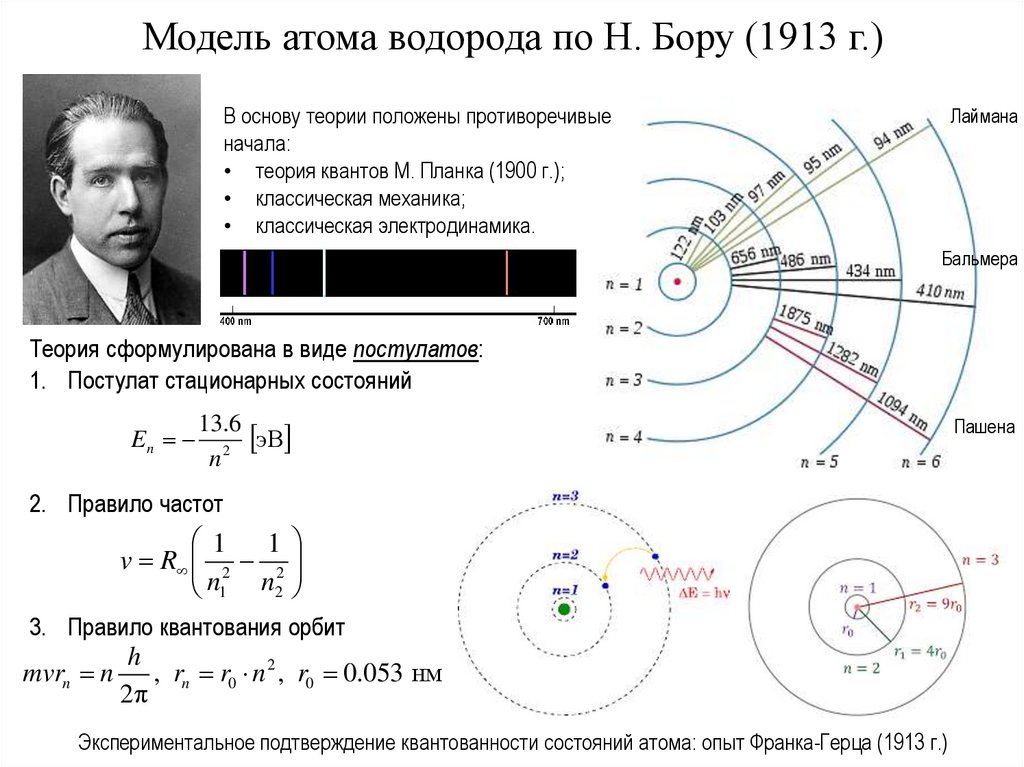
10.
Модель атома водорода по Н. Бору (1913 г.)В основу теории положены противоречивые
начала:
• теория квантов М. Планка (1900 г.);
• классическая механика;
• классическая электродинамика.
Лаймана
Бальмера
Теория сформулирована в виде постулатов:
1. Постулат стационарных состояний
En
13.6
эВ
n2
2. Правило частот
1
1
v R 2 2
n1 n2
3. Правило квантования орбит
h
mvrn n , rn r0 n 2 , r0 0.053 нм
2π
Экспериментальное подтверждение квантованности состояний атома: опыт Франка-Герца (1913 г.)
Пашена
11.
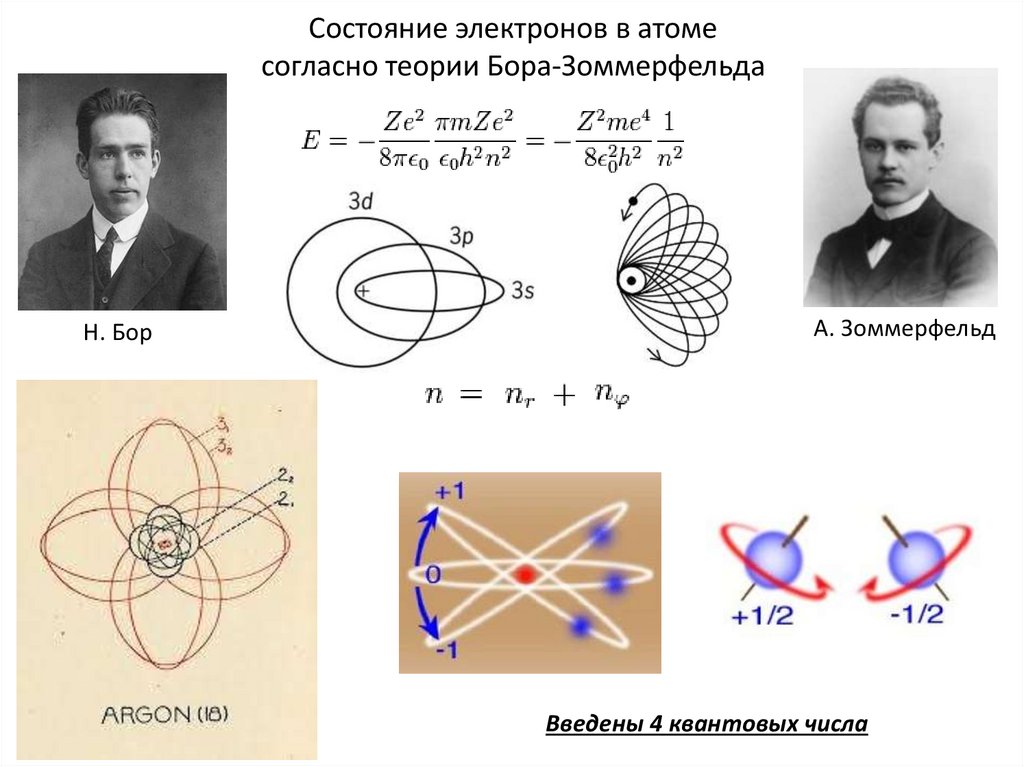
Состояние электронов в атомесогласно теории Бора-Зоммерфельда
Н. Бор
А. Зоммерфельд
Введены 4 квантовых числа
12.
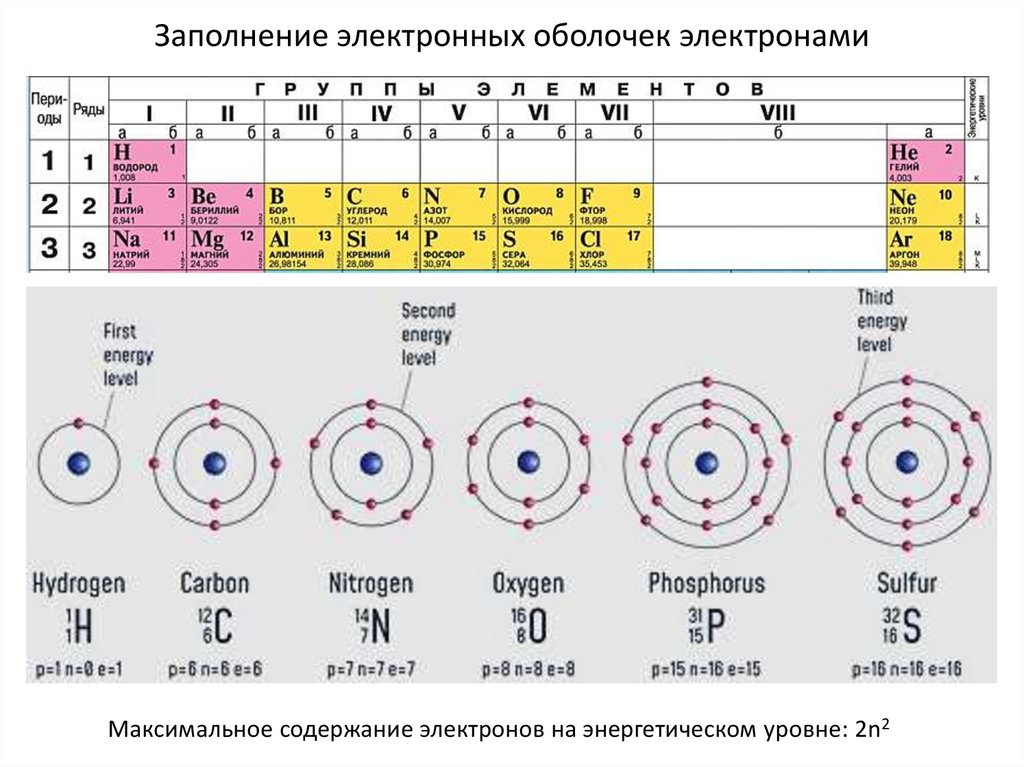
Заполнение электронных оболочек электронамиМаксимальное содержание электронов на энергетическом уровне: 2n2
13.
Порядок заполнения электронных оболочек(Зоммерфельд, 1925 г.)
2(2ℓ+1) – число электронов на подуровне
2n2 – число электронов на уровне
14.
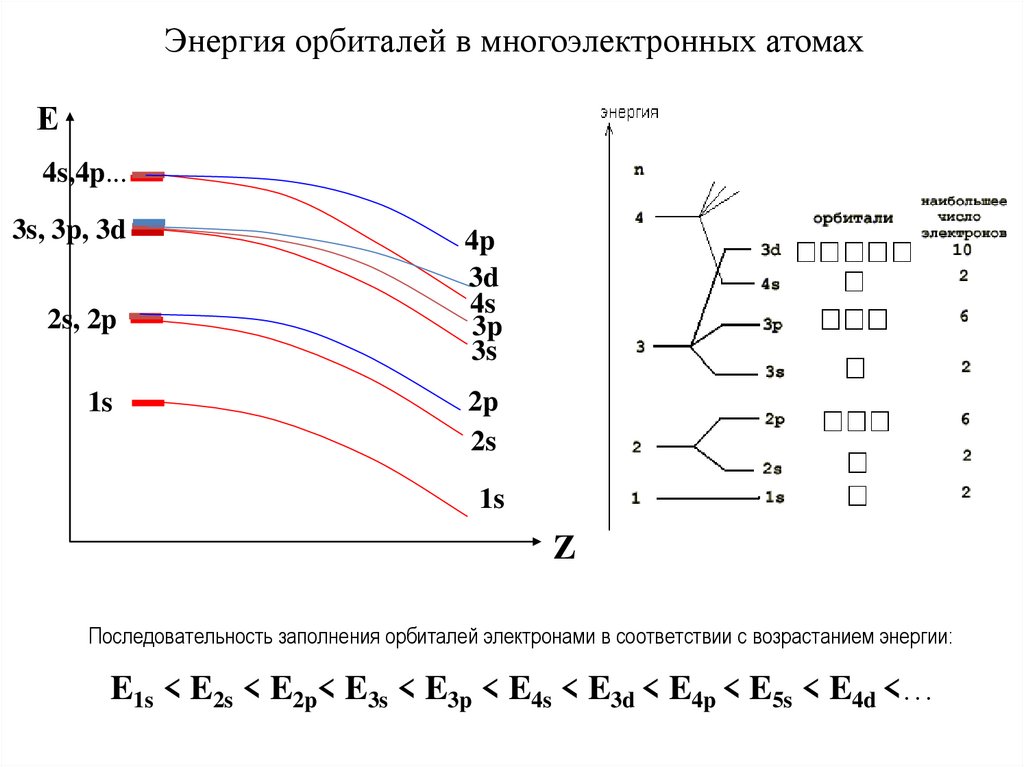
Энергия орбиталей в многоэлектронных атомахЕ
4s,4p...
3s, 3p, 3d
2s, 2p
1s
4p
3d
4s
3p
3s
2p
2s
1s
Z
Последовательность заполнения орбиталей электронами в соответствии с возрастанием энергии:
E1s < E2s < E2p< E3s < E3p < E4s < E3d < E4p < E5s < E4d <…
15.
Распределение электронов в многоэлектронных атомахПринцип наименьшей энергии: электроны заполняют подуровни а порядке
увеличения их энергии
E1s < E2s < E2p< E3s < E3p < E4s < E3d < E4p < E5s < E4d <…
Принцип Паули: в атоме не может быть двух электронов с одинаковыми
квантовыми числами
Правило Хунда: на одном подуровне электроны располагаются так, чтобы
суммарный спин атома был максимальным
Правила Клечковского:
• электроны заполняют орбитали в порядке увеличения суммы n+l;
• если сумма n+l для различных отбиталей одинакова, то сначала
заполняется орбиталь с меньшим значением n.
16.
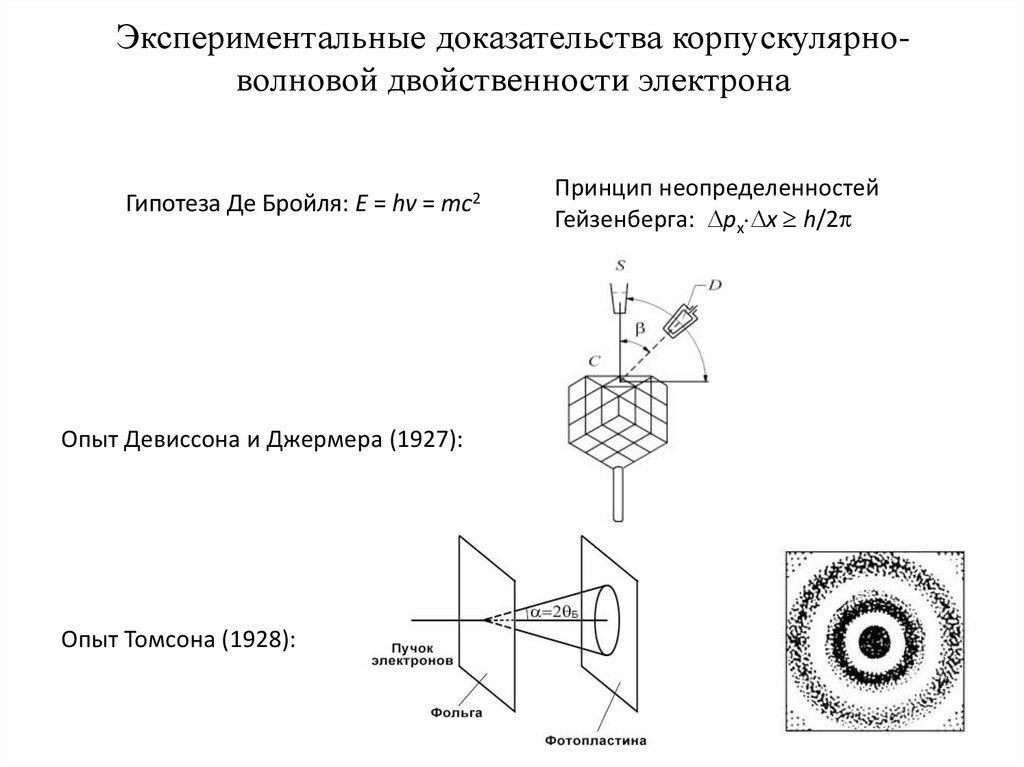
Экспериментальные доказательства корпускулярноволновой двойственности электронаГипотеза Де Бройля: Е = hv = mc2
Опыт Девиссона и Джермера (1927):
Опыт Томсона (1928):
Принцип неопределенностей
Гейзенберга: px x h/2
17.
Волновое уравнение Э. Шрёдингера (1926 г.)Волновое уравнение микрочастицы (электрона) в потенциальном поле (атоме):
2
8
m
2
(x, y, z) 2 (E V) (x, y, z) 0
h
2(x,y,z) - квадрат волновой функции пропорционален вероятности (dP) нахождения
частицы в элементарном объеме (dV)
dP = 2(x,y,z) dV
Решение в явном виде - набор волн. функций Ψ(х), где a - параметр потенциального
ящика, n = 1,2,3… - квантовое число:
2
n
(x)
sin
x
a
a
Выводы:
1. Энергия электрона квантована.
2. Энергетическое состояние определяется набором целочисленных параметров - трёх
квантовых чисел nx, ny, nz.
18.
Квантовые числаn, l, m – целочисленные параметры волновых -функций в явном виде,
названные квантовыми числами
главное n = 1, 2, 3, 4… ; определяет разрешенные (квантованные,
дискретные) значения полной
энергии электрона, размер орбитали
(расстояния е до ядра).
орбитальное l = 0, 1, 2, 3 ... (n -1); определяет возможные квантовые
значения орбитального момента количества движения электрона.
магнитное ml =
l … -l; определяет разрешенные направления в
пространстве вектора орб. момента колич. движения - число орбиталей
спиновое – ms = ±1/2 (1933 г., Поль Дирак, модель Уленбека и Гоудсмита);
определяет собственный механический момент колич. движения.
19.
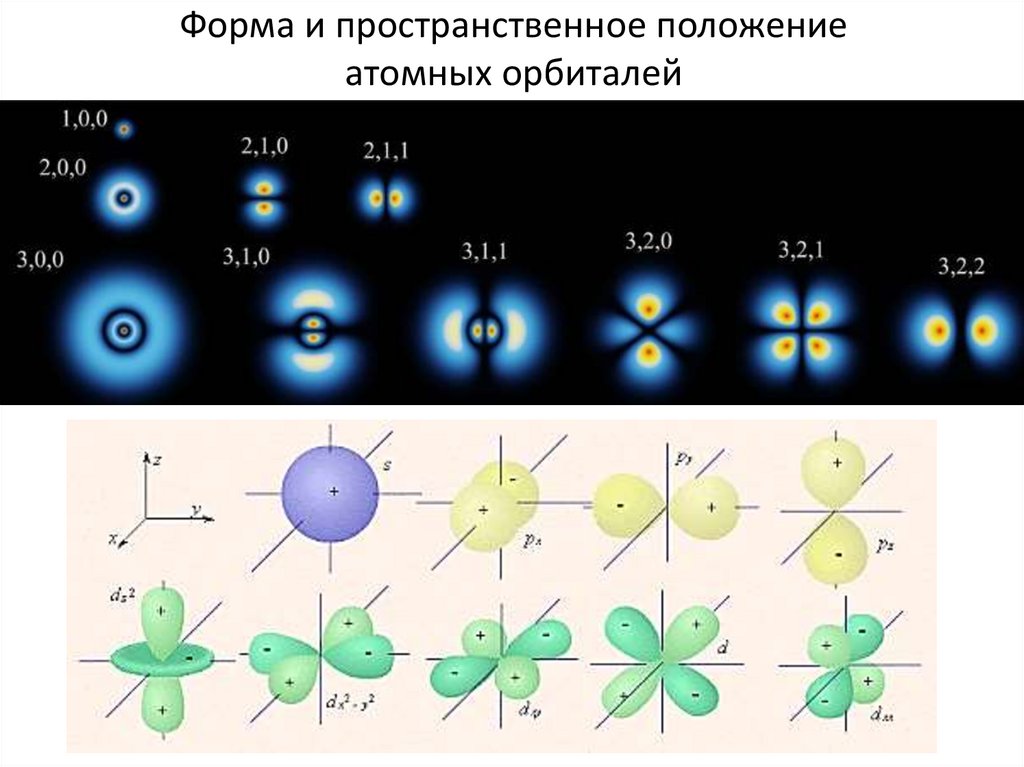
Форма и пространственное положениеатомных орбиталей
20.
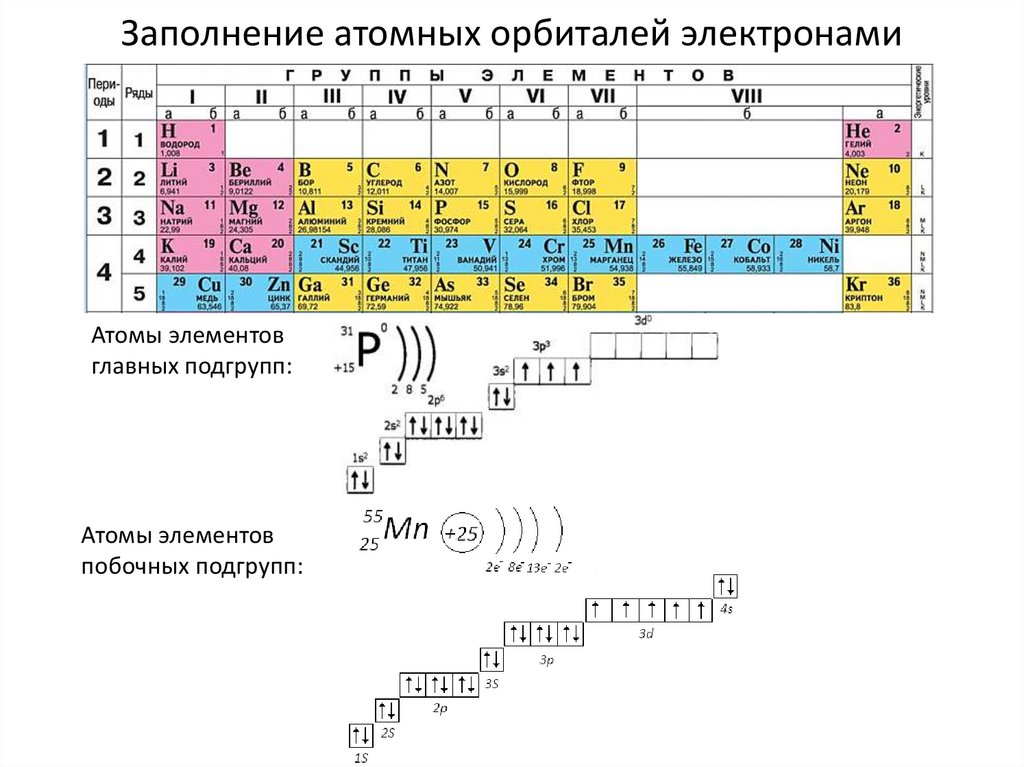
Заполнение атомных орбиталей электронамиАтомы элементов
главных подгрупп:
Атомы элементов
побочных подгрупп:
21.
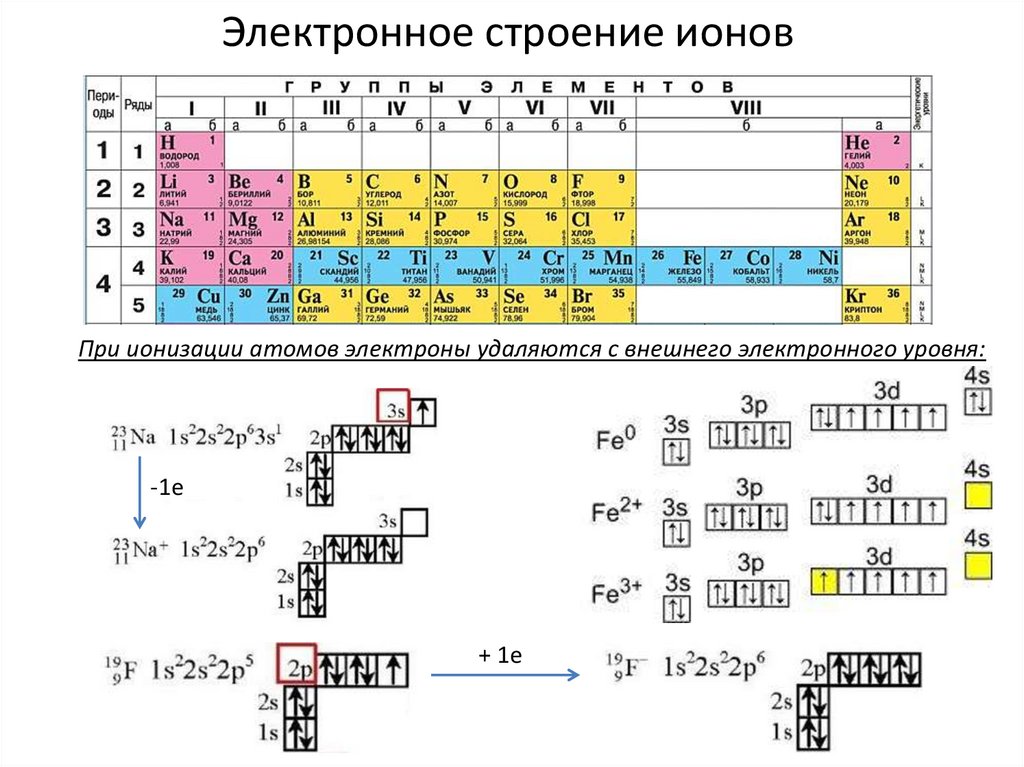
Электронное строение ионовПри ионизации атомов электроны удаляются с внешнего электронного уровня:
-1е
+ 1е
22.
Домашнее заданиеЗаконспектировать определения из учебника Глинки, Гл. 2.











 Химия
Химия








