Похожие презентации:
Фолдинг белка. Физикохимические свойства белков
1.
Фолдинг белка. Физикохимические свойства белков2.
Шапероны• Конститутивные – участвуют в фолдинге белка
• Индуцибельные – их синтез связан с ответом на
стрессовые реакции (гипертермия, гипербария и т.д)
Белки теплового шока (БТШ), heat shock proteins (Hsp)
3.
ШапероныСемейства:
• Hsp 100
• Hsp 90
• Hsp 70
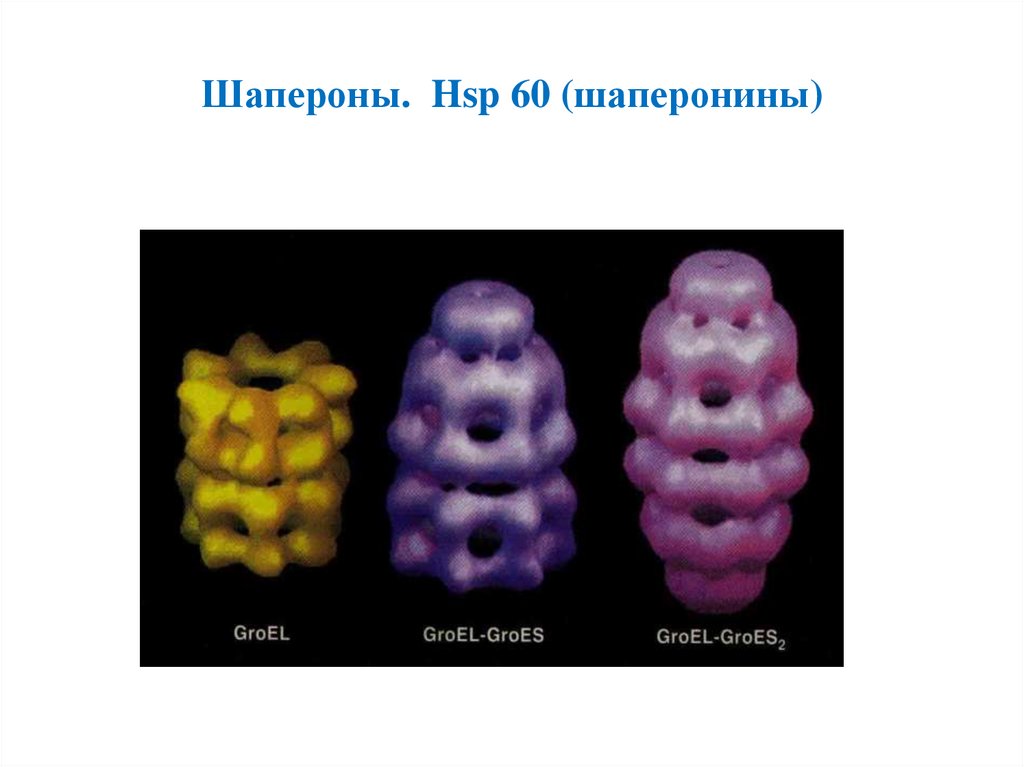
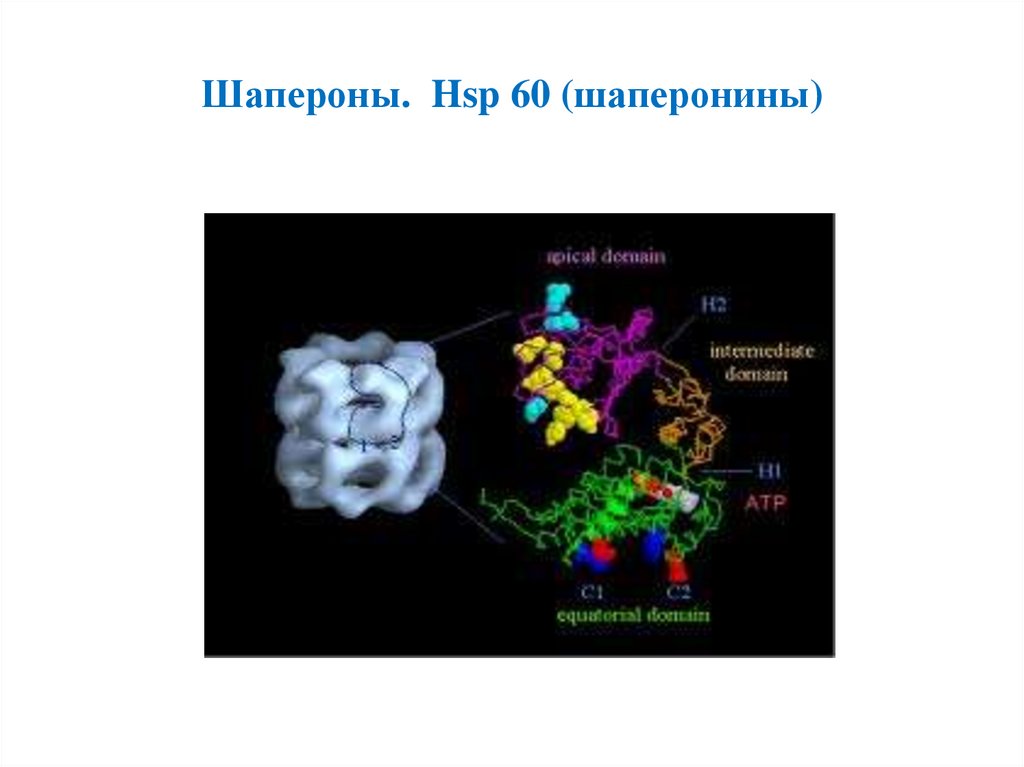
• Hsp 60 (шаперонины)
• Малые шапероны (Hsps, sHsps и др.)
4.
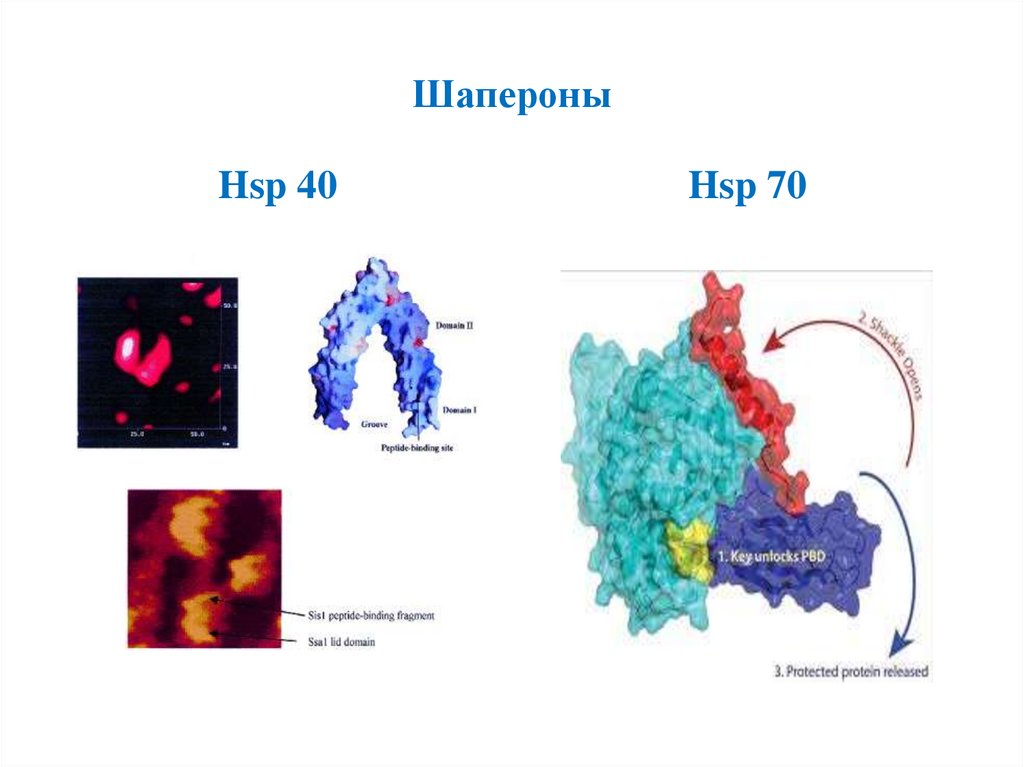
ШапероныHsp 40
Hsp 70
5.
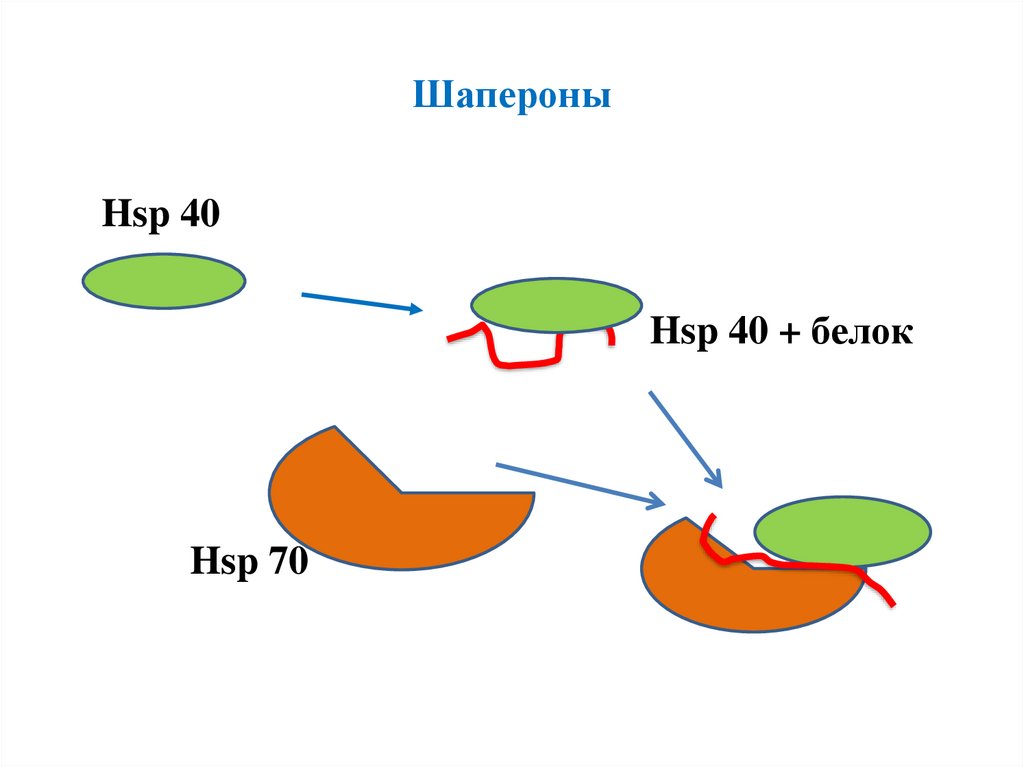
ШапероныHsp 40
Hsp 40 + белок
Hsp 70
6.
Шапероны. Hsp 60 (шаперонины)7.
Шапероны. Hsp 60 (шаперонины)8.
9.
ШапероныФункции шаперонов:
• фолдинг белка (3-я и 4-я структуры)
• транспорт белка через мембраны (из ядра, из
митохондрий)
• участие в сигнальной трансдукции
• регуляция клеточного цикла
• регуляция апоптоза
• защита белков от агрегации и потери нативной
конформации
10.
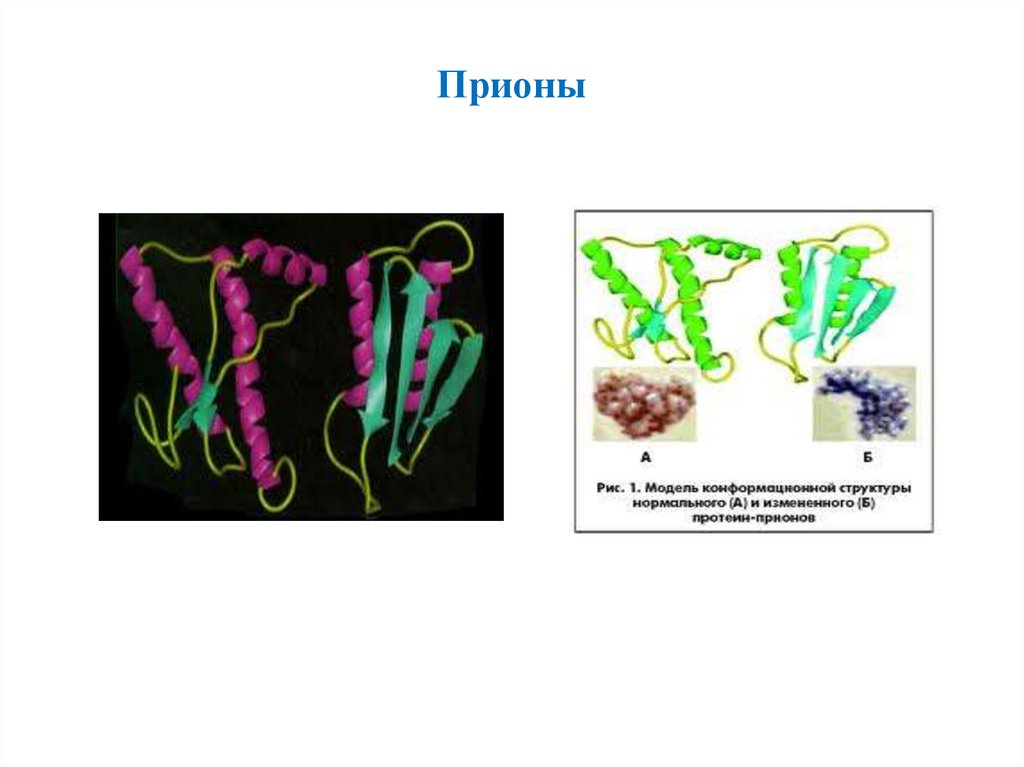
Прионы11.
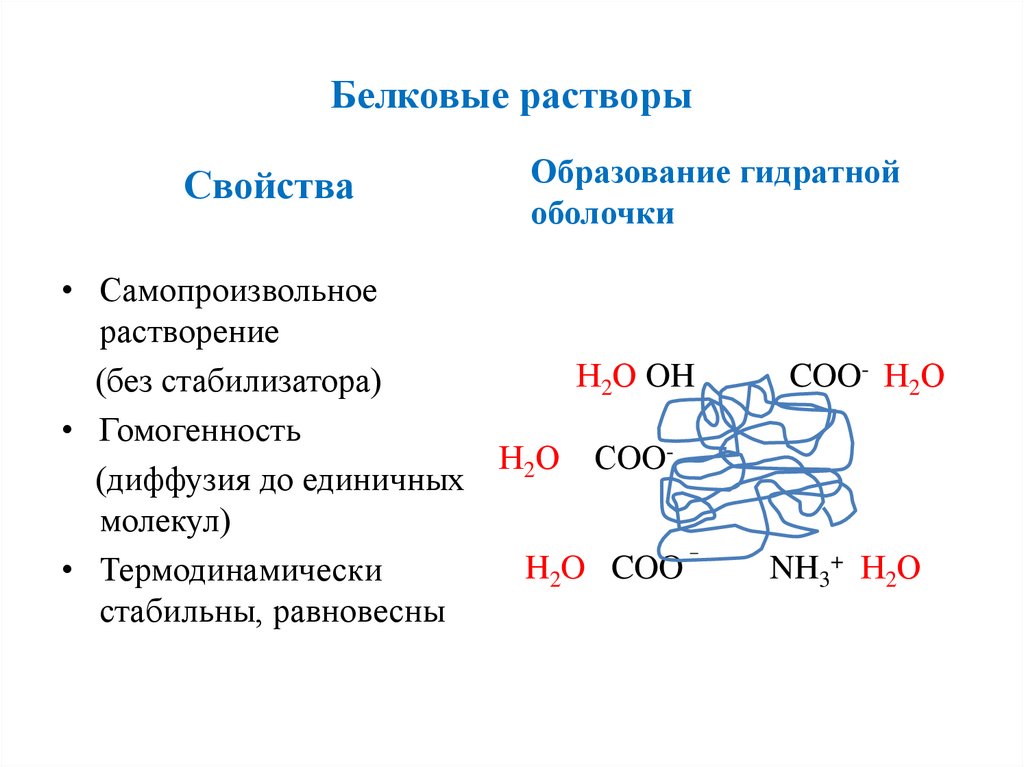
Белковые растворыСвойства
Образование гидратной
оболочки
• Самопроизвольное
растворение
Н2О OH
(без стабилизатора)
• Гомогенность
Н2О СOO(диффузия до единичных
молекул)
H2O COO
• Термодинамически
стабильны, равновесны
COO- Н2О
NH3+ Н2О
12.
Белковые растворы.Свойства коллоидов:
Высокая вязкость
Медленное диффундирование
Набухание
Эффект Тиндаля
Не диализируются
Золь Гель
Коацервация Синерезис
13.
Растворимость белков в зависимости от рНсреды
Нейтральные белки
растворимость
min
max
рН 7,0
˂7,0˃
Кислые белки
рН˂7,0
рН˃7,0
Основные белки
рН˃7,0
рН˂7,0
Минимальная растворимость при pH=pI
14.
15.
Дегидратация (высаливание) белкаФакторы:
а) соли щелочных, щелочно-земельных металлов, соли
аммония
лиотропные ряды : Li + ˃ Na+ ˃ NH4+ ˃ K+ ˃Mg2+˃ Ca2+
SO4- ˃ F- ˃ CH3COO ˃־Cl-˃ NO3-˃ Iб) спирт до 70 , ацетон
в) мочевина ( низкие концентрации)
NH2 C NH2
O
16.
Денатурирующие факторыфизические
Температура (˃ 60)
Давление
УФ
Ионизация
Ультразвук
вибрация
химические
• Сильные кислоты и
щелочи - ТХУ, HCL,
NaOH
• Тяжелые металлы - Hg, Pb
• Окислители - H2O2,
KMnO4
• Восстановители – KI
• Детергенты (ионные) –
додецилсульфат Na
17.
Спектры поглощения белковв инфракрасной области
(для всех белков)
УФ в трех зонах (для всех белков):
а) λ= 280 нм (ароматические АК)
б) λ= 210-250 нм (ароматические АК, водородные связи,
α-спираль)
в) λ= 186 нм (пептидные связи)
В видимой области спектра (хромопротеины)









 Биология
Биология








