Похожие презентации:
Единый государственный экзамен Химия 2021
1.
Единый государственныйэкзамен
Химия 2021
ЕГЭ
Задание 4
2.
Задание 4. Ковалентная химическая связь, ее разновидности имеханизмы образования. Характеристики ковалентной связи
(полярность и энергия связи). Ионная связь. Металлическая
связь. Водородная связь.
Вещества молекулярного и немолекулярного строения. Тип
кристаллической решетки. Зависимость свойств веществ от
их состава и строения.
Примерное время выполнения задания – 2 - 3 минуты
Уровень сложности задания – базовый
Максимальный балл за выполнение задания - 1
Задание № 4 рассчитано на проверку знаний о химической связи, ее видах и
механизмах образования; веществах молекулярного и немолекулярного
строения, типах кристаллических решеток.
Задание содержит перечень веществ, из которых необходимо выбрать два с
определенным видом химической связи или строением (типом
кристаллической решетки) согласно условию задания. В ответе надо
записать цифры, под которыми указаны выбранные элементы.
3.
Перед выполнением предложенных заданий повторите:Образование химической связи
Атомы химических элементов практически всегда образуют
соединения.
Исключением
являются
благородные
газы,
принадлежащие главной подгруппе VIII группы Периодической
таблицы. Их низкая активность объясняется заполненностью
орбиталей внешнего энергетического уровня.
Соединения атомов различных элементов возможны только при
наличии свободных орбиталей, с содержащимися в них
валентными электронами на внешнем слое атома. Поведение
химического элемента в реакциях зависит от валентных
электронов, чем их меньше, тем активнее элемент отдаёт их и,
наоборот, чем больше валентных электронов, тем неохотнее
элемент разлучается с ними.
Запомните! Если элемент легко отдает свои электроны, то он
проявляет восстановительные свойства, а если тяжело, то
окислительные.
4.
Химическая связь – это взаимодействие, обеспечивающеесвязь между атомами, преобразуя их в сложные группы.
В
основе
химических
связей
лежат
определенные
электростатические силы притяжения и отталкивания,
обуславливающие взаимодействие положительно заряженных
ядер и отрицательно заряженных электронов.
5.
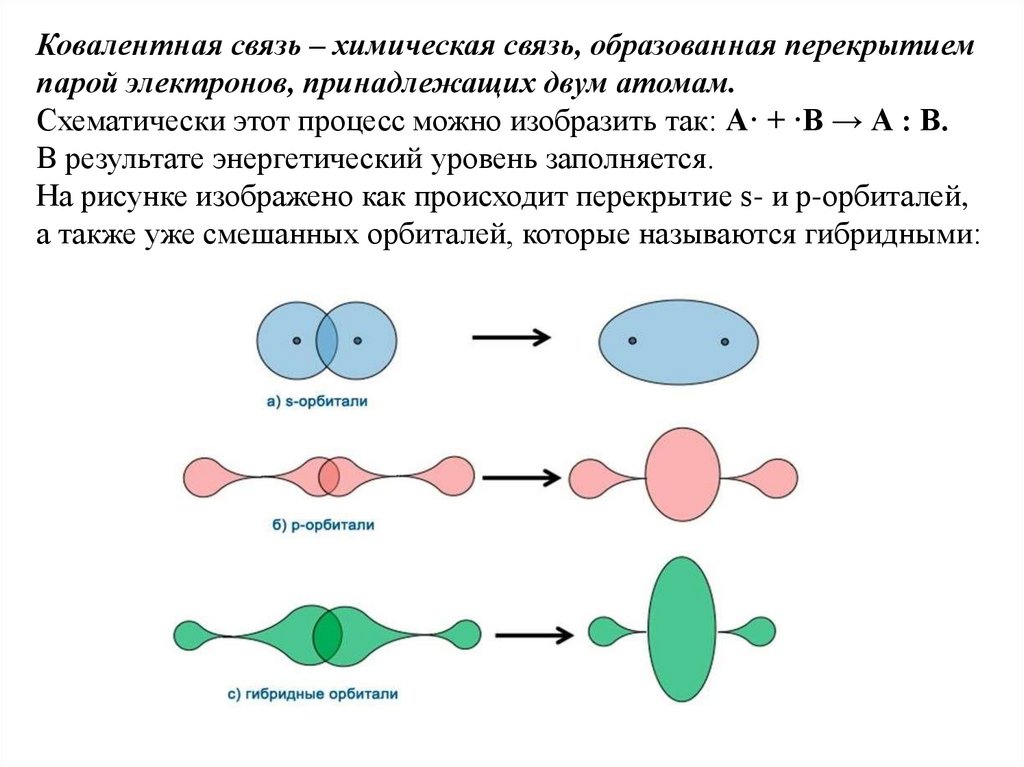
Ковалентная связь – химическая связь, образованная перекрытиемпарой электронов, принадлежащих двум атомам.
Схематически этот процесс можно изобразить так: A· + ·В → А : В.
В результате энергетический уровень заполняется.
На рисунке изображено как происходит перекрытие s- и р-орбиталей,
а также уже смешанных орбиталей, которые называются гибридными:
6.
Существуют два пути образования ковалентной связи. Перекрытием двухорбиталей атомов – соседей, имеющих по одному свободному электрону, либо
перекрытием свободной орбитали атома с орбиталью другого атома,
имеющего электронную пару. Второй путь называется донорно –
акцепторным механизмом.
Донор – это определенный атом, который предоставляет неподелённую
электронную пару. Акцептор – это атом, который содержит в себе свободную
орбиталь.
Способность атомов притягивать электроны у разных элементов различна.
Она обусловлена электроотрицательностью. Если электро-отрицательность
соединяющихся атомов не слишком различна возникает полярная
ковалентная связь. При одинаковой электроотрицательности, если
соединяются атомы одного элемента – неметалла, образующаяся связь
называется ковалентной неполярной. Ну, а если электроотрицательность
различается сильно, то возникает ионная связь.
7.
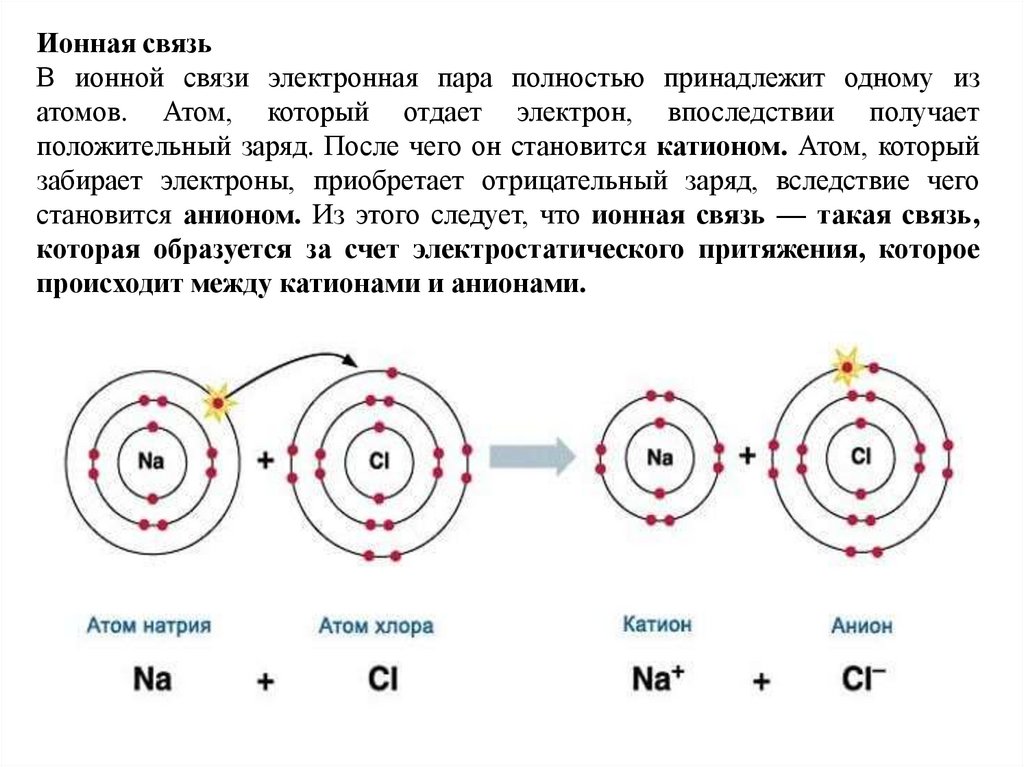
Ионная связьВ ионной связи электронная пара полностью принадлежит одному из
атомов. Атом, который отдает электрон, впоследствии получает
положительный заряд. После чего он становится катионом. Атом, который
забирает электроны, приобретает отрицательный заряд, вследствие чего
становится анионом. Из этого следует, что ионная связь — такая связь,
которая образуется за счет электростатического притяжения, которое
происходит между катионами и анионами.
8.
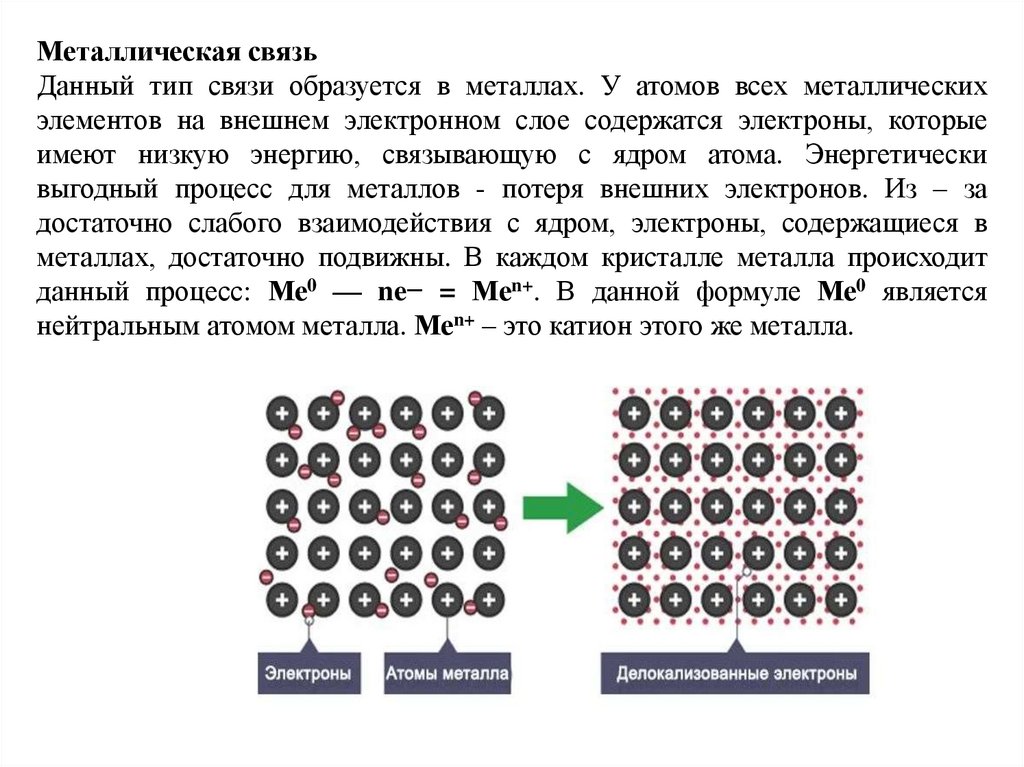
Металлическая связьДанный тип связи образуется в металлах. У атомов всех металлических
элементов на внешнем электронном слое содержатся электроны, которые
имеют низкую энергию, связывающую с ядром атома. Энергетически
выгодный процесс для металлов - потеря внешних электронов. Из – за
достаточно слабого взаимодействия с ядром, электроны, содержащиеся в
металлах, достаточно подвижны. В каждом кристалле металла происходит
данный процесс: Ме0 — ne− = Mеn+. В данной формуле Ме0 является
нейтральным атомом металла. Mеn+ – это катион этого же металла.
9.
Молекулярные и немолекулярные веществаПо строению химические вещества делятся на две группы: те, которые
состоят из молекул называются молекулярными, а содержащие атомы и
ионы – немолекулярными.
Молекулярные вещества имеют низкие t плавления/кипения. Они могут
находиться в трех агрегатных состояниях: жидком, твердом, газообразном. К
этой группе относятся большинство простых веществ неметаллов, а также их
соединений друг с другом. Связи между атомами молекулярных веществ
являются ковалентными.
Немолекулярные вещества имеют высокие t плавления/кипения. Находятся в
твердом состоянии. Это простые вещества металлы, их соединения с
неметаллами, из неметаллов относятся бор, углерод – алмаз, фосфор (черный
и красный), кремний. Немолекулярные вещества образуют ионные, атомные,
молекулярные кристаллы, расположение частиц которых имеет четкую
последовательность и образует решетку.
10.
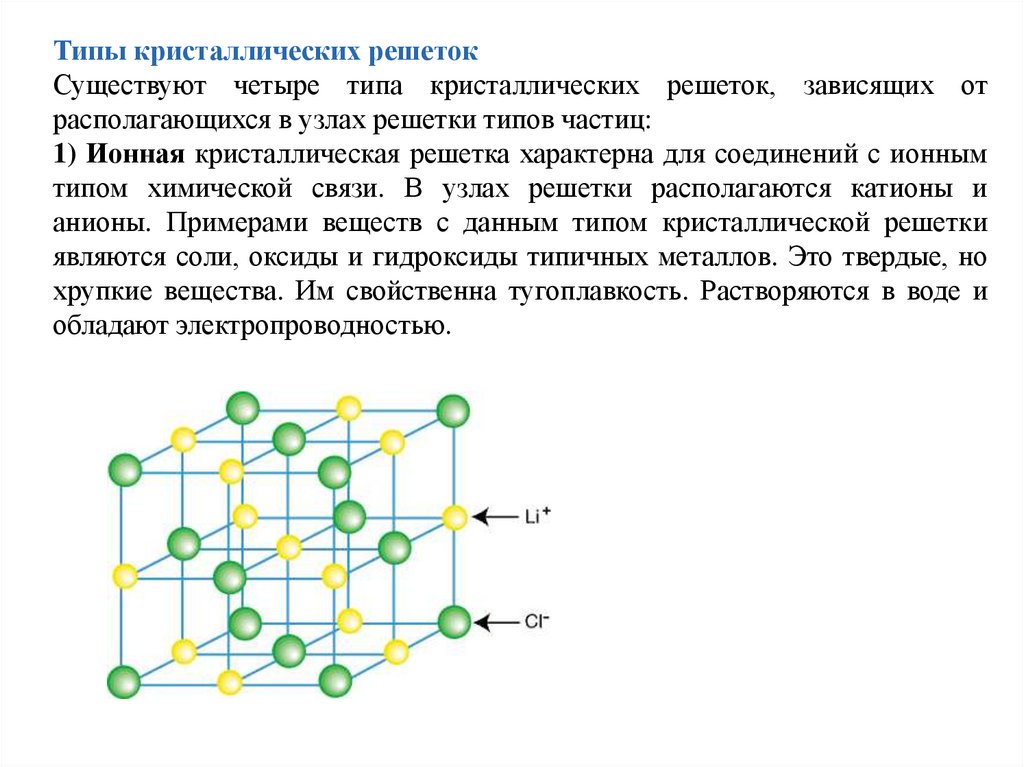
Типы кристаллических решетокСуществуют четыре типа кристаллических решеток, зависящих от
располагающихся в узлах решетки типов частиц:
1) Ионная кристаллическая решетка характерна для соединений с ионным
типом химической связи. В узлах решетки располагаются катионы и
анионы. Примерами веществ с данным типом кристаллической решетки
являются соли, оксиды и гидроксиды типичных металлов. Это твердые, но
хрупкие вещества. Им свойственна тугоплавкость. Растворяются в воде и
обладают электропроводностью.
11.
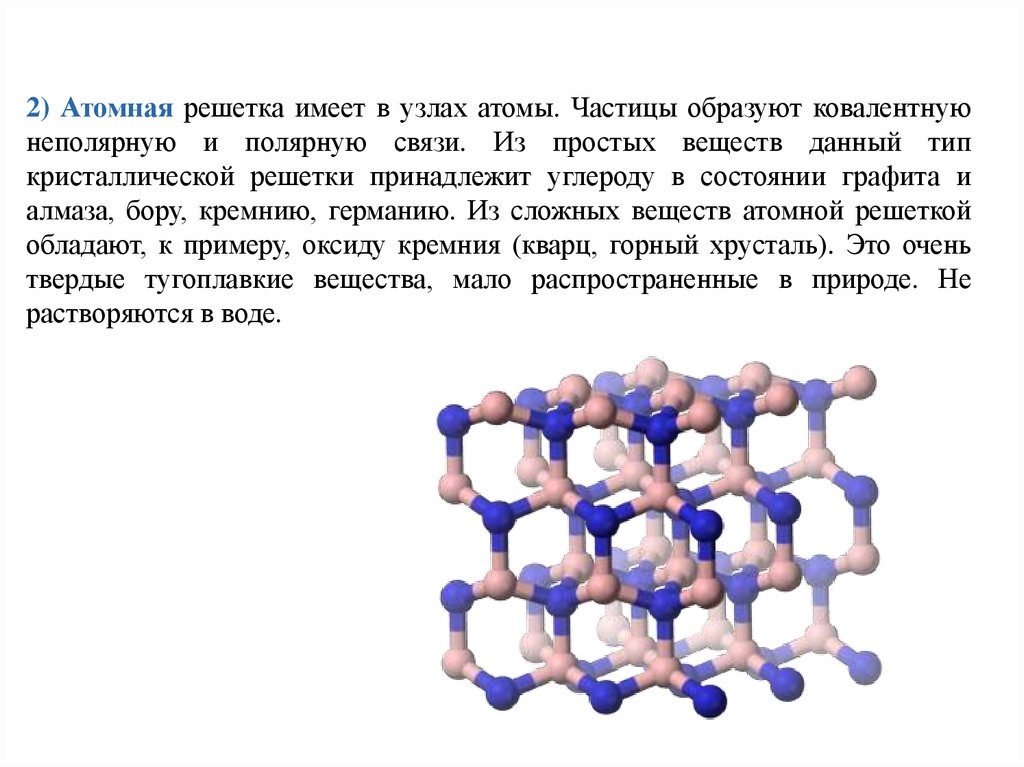
2) Атомная решетка имеет в узлах атомы. Частицы образуют ковалентнуюнеполярную и полярную связи. Из простых веществ данный тип
кристаллической решетки принадлежит углероду в состоянии графита и
алмаза, бору, кремнию, германию. Из сложных веществ атомной решеткой
обладают, к примеру, оксиду кремния (кварц, горный хрусталь). Это очень
твердые тугоплавкие вещества, мало распространенные в природе. Не
растворяются в воде.
12.
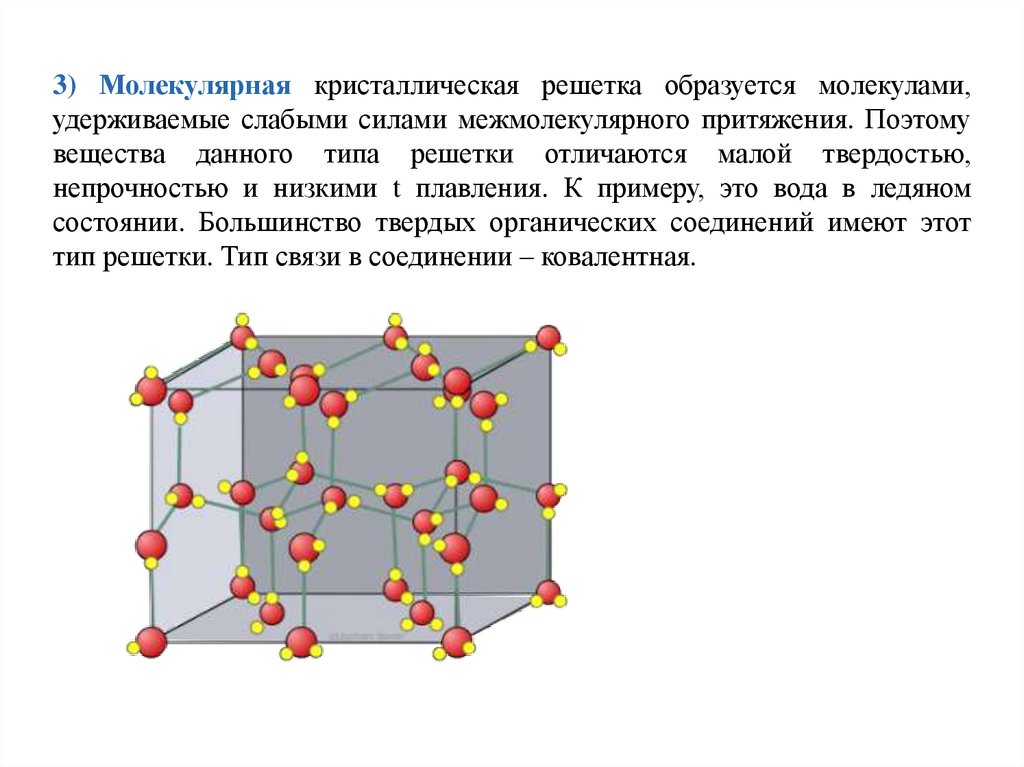
3) Молекулярная кристаллическая решетка образуется молекулами,удерживаемые слабыми силами межмолекулярного притяжения. Поэтому
вещества данного типа решетки отличаются малой твердостью,
непрочностью и низкими t плавления. К примеру, это вода в ледяном
состоянии. Большинство твердых органических соединений имеют этот
тип решетки. Тип связи в соединении – ковалентная.
13.
4) Металлическая. В узлах расположены атомы и катионы металла. Этометаллы и их сплавы, соединения с металлической связью. А, как известно,
атомы металла легко расстаются со своими электронами на внешнем уровне.
Поэтому такой тип решетки определяет пластичность и ковкость веществ.









 Химия
Химия








