Похожие презентации:
Алканы
1. 4.02.2022
УГЛЕВОДОРОДЫ–это
органические соединения, состоящие
из двух химических элементов –
УГЛЕРОДА И ВОДОРОДА.
2. АЛКАНЫ
Строение, номенклатура,изомерия и физические
свойства.
3.
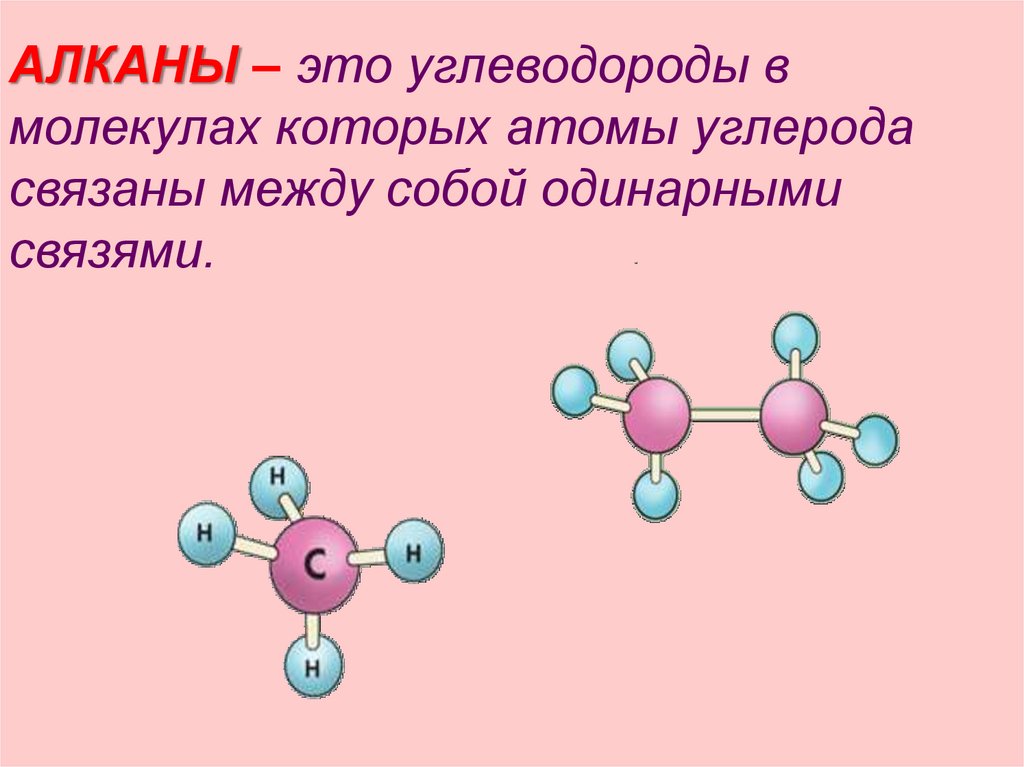
АЛКАНЫ – это углеводороды вмолекулах которых атомы углерода
связаны между собой одинарными
связями.
4.
Все алканы отвечают общейформуле
СnН2n+2
где n=1, 2, 3…+∞
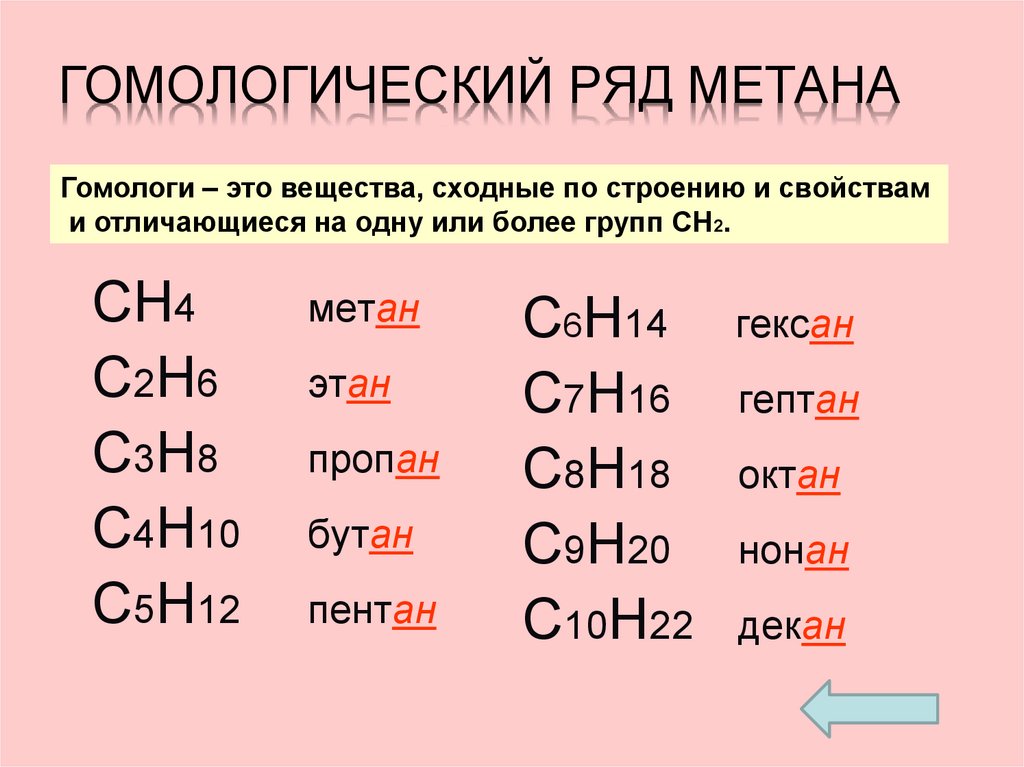
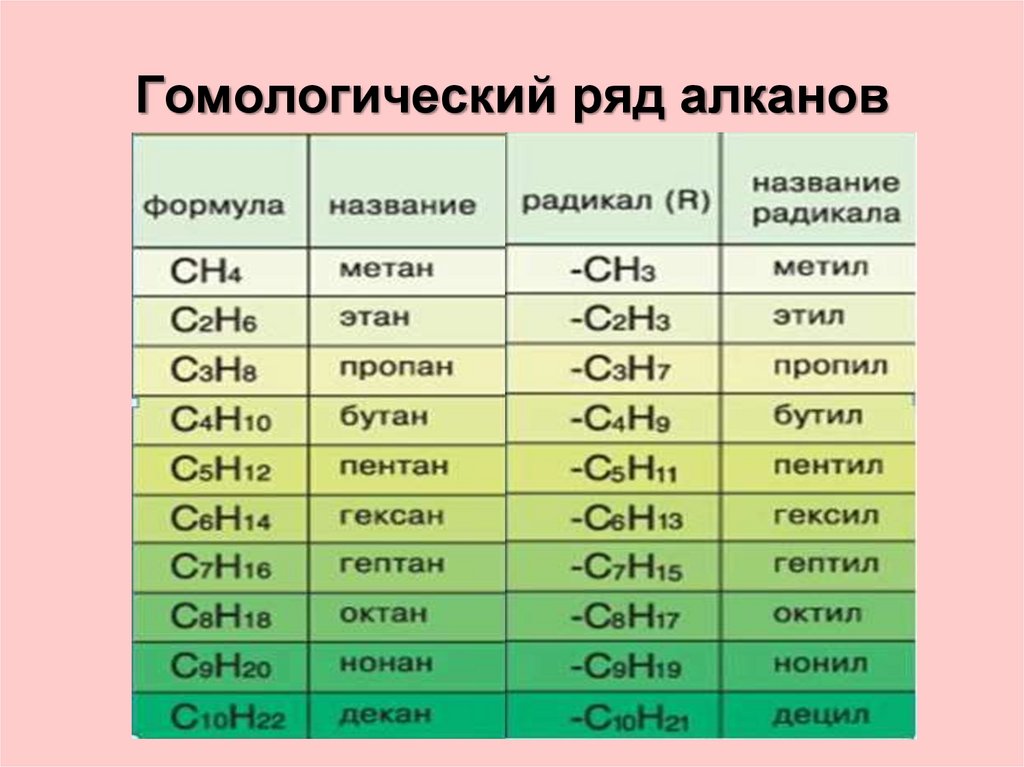
5. Гомологический ряд метана
ГОМОЛОГИЧЕСКИЙ РЯД МЕТАНАГомологи – это вещества, сходные по строению и свойствам
и отличающиеся на одну или более групп СH2.
СН4
С2H6
C3H8
C4H10
C5H12
метан
этан
пропан
бутан
пентан
C6H14
C7H16
C8H18
C9H20
C10H22
гексан
гептан
октан
нонан
декан
6.
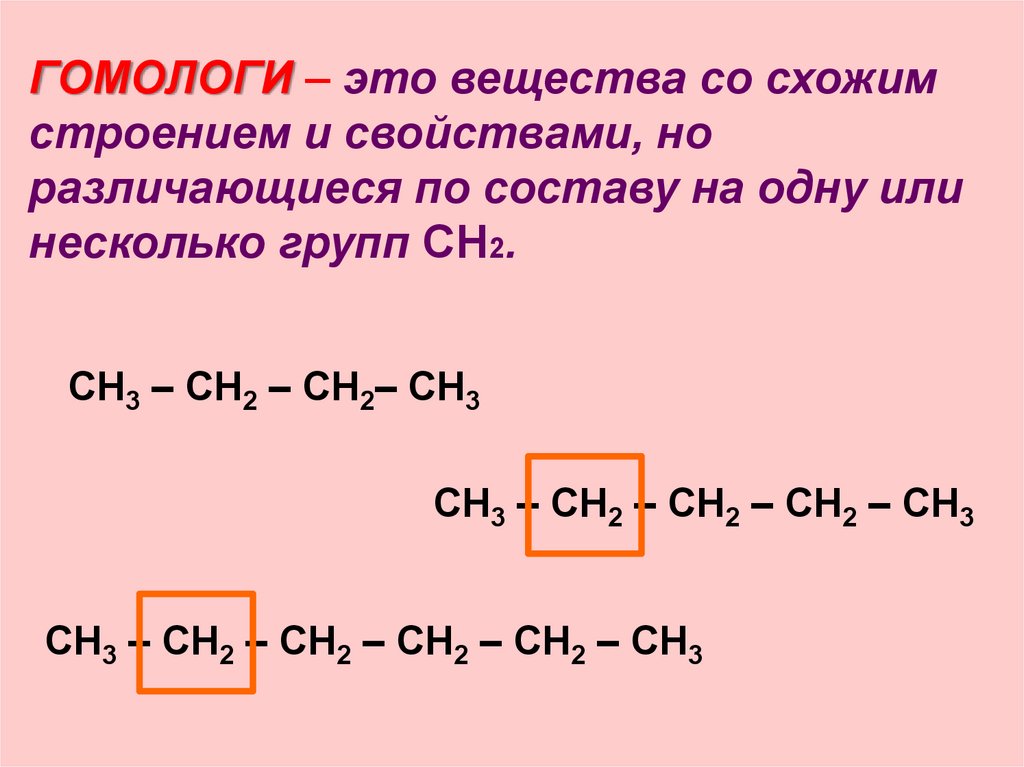
ГОМОЛОГИ – это вещества со схожимстроением и свойствами, но
различающиеся по составу на одну или
несколько групп CH2.
СН3 – СН2 – СН2– СН3
СН3 – СН2 – СН2 – СН2 – СН3
СН3 – СН2 – СН2 – СН2 – СН2 – СН3
7. Гомологический ряд алканов
8.
БутанС4Н10
Молекулярная формула
Структурные формулы
СН3 – СН2 – СН2 – СН3
СН3– СН – СН3
СН3
Бутан
Изобутан
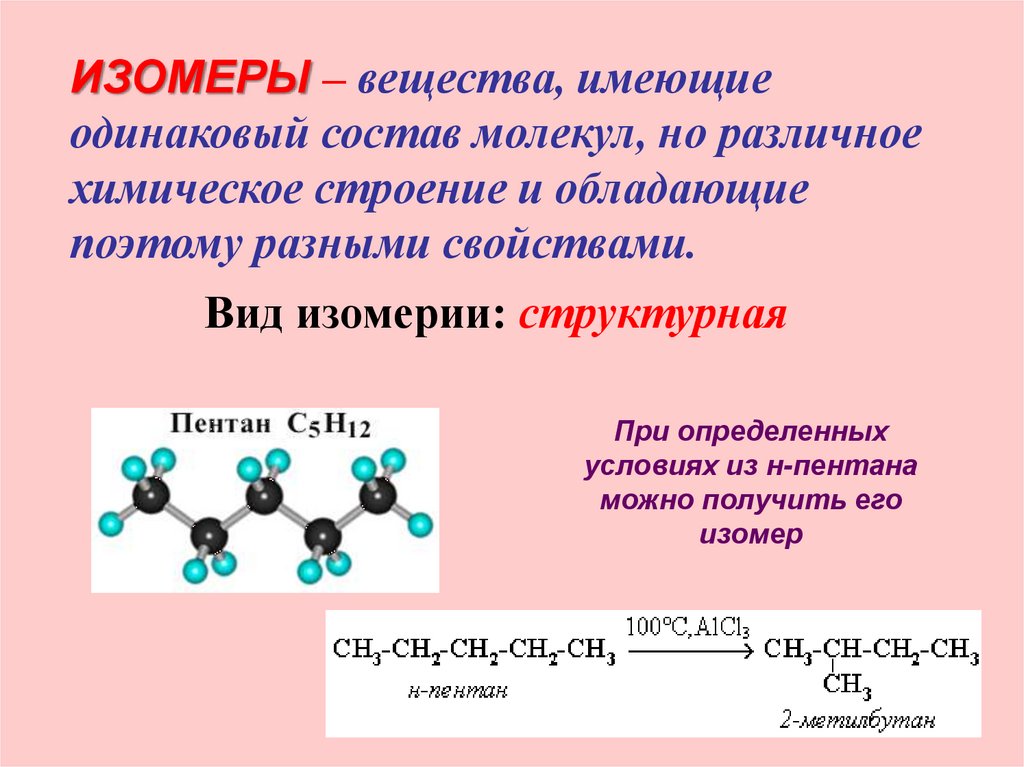
9.
ИЗОМЕРЫ – вещества, имеющиеодинаковый состав молекул, но различное
химическое строение и обладающие
поэтому разными свойствами.
Вид изомерии: структурная
При определенных
условиях из н-пентана
можно получить его
изомер
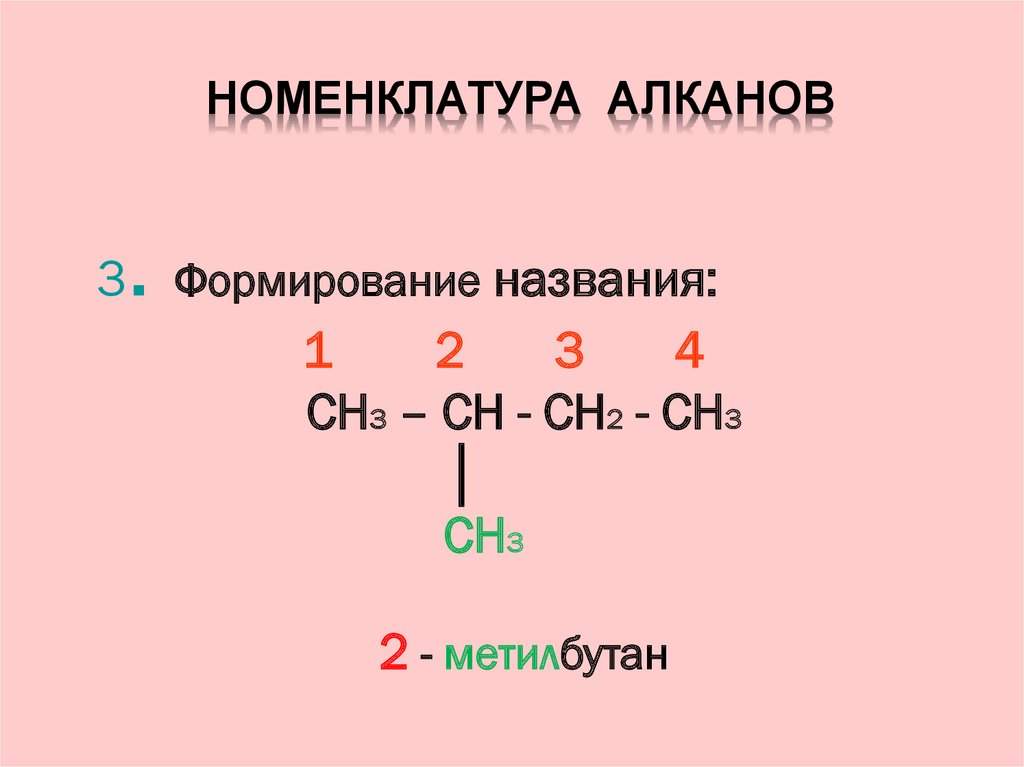
10. номенклатура алканов
НОМЕНКЛАТУРА АЛКАНОВАлгоритм.
1. Выбор главной цепи:
CH3 – CH - CH2 - CH3
│
CH3
11. Номенклатура алканов
НОМЕНКЛАТУРА АЛКАНОВ2.
Нумерация атомов главной цепи:
1
2
3
4
CH3 – CH - CH2 - CH3
│
CH3
12. Номенклатура алканов
НОМЕНКЛАТУРА АЛКАНОВ.
3 Формирование названия:
1
2
3
4
CH3 – CH - CH2 - CH3
│
CH3
2 - метилбутан
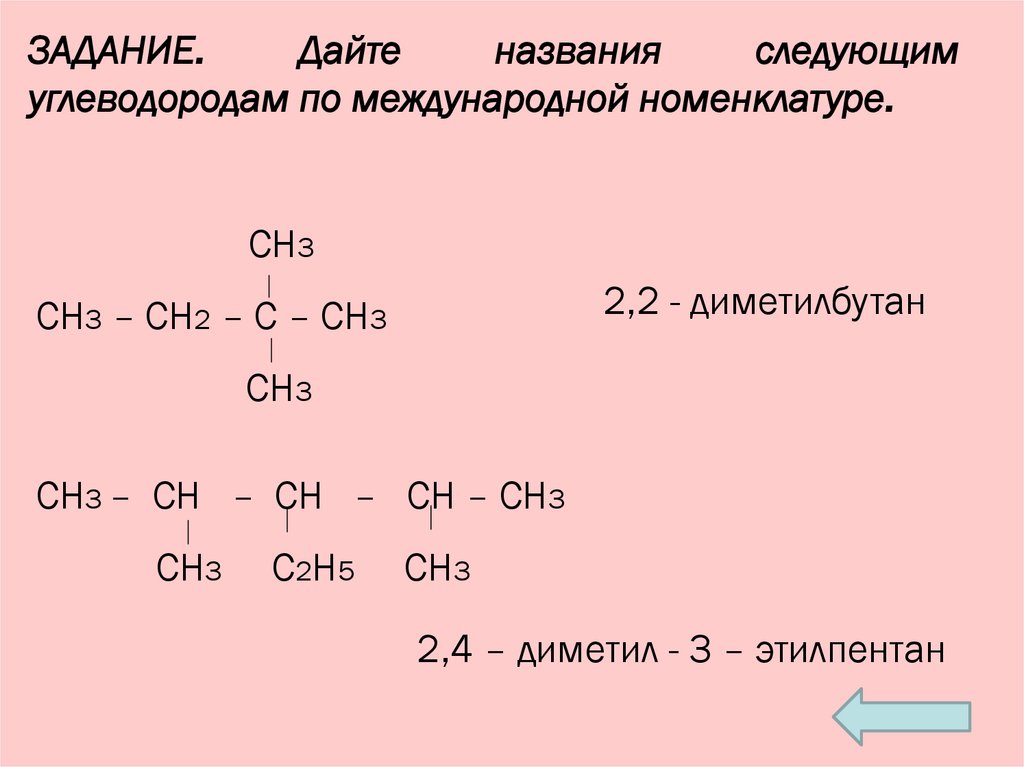
13.
ЗАДАНИЕ.Дайте
названия
следующим
углеводородам по международной номенклатуре.
СН3
2,2 - диметилбутан
СН3 – СН2 – С – СН3
СН3
СН3 – СН – СН – СН – СН3
СН3
С2Н5
СН3
2,4 – диметил - 3 – этилпентан
14.
СН3І
СН3 –СН2 – С – СН –СН3
І
2, 3, 3 - триметилпентан
І
СН3 СН3
С2Н5
СН3 – СН – СН – СН3
2 этил, 3 – метилпентан
С2Н5
СН3
СН3– СН2 – СН – СН – СН – СН3
С2Н5
СН2 – СН3
4 – метил –
5 – этилгептан
15.
• Составте структурные формулы следующихвеществ и укажите первичные, вторичные и
третичные атомы.
• А) 2,3 – диметилпентан
• Б)3,3,4 - триметилгексан
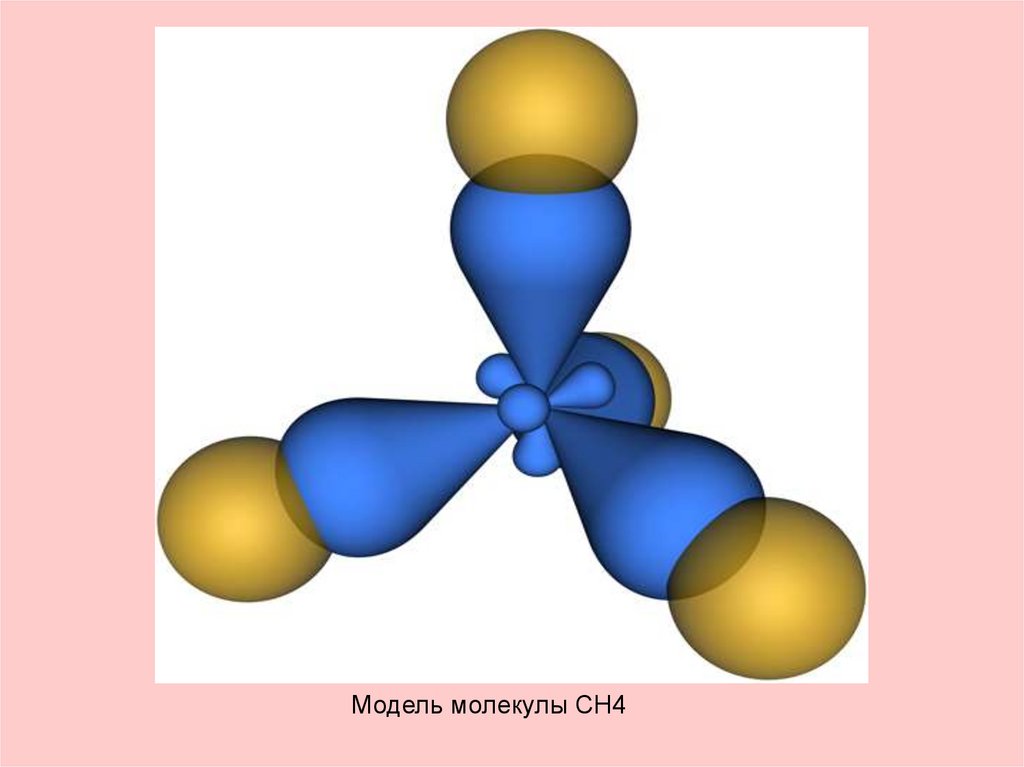
16. Строение молекулы метана
Молекулярная формула метанаCH4
Пространственное
строение молекулы
метана
17.
Модель молекулы CH418. Какие химические связи в молекуле метана?
Какой вид гибридизацииатомов углерода будет
осуществляться в
молекулах алканов?
sp3 - гибридизация
19.
Молекула метанапредставляет собой
тетраэдр с атомом
углерода в центре и
атомами водорода по
вершинам тетраэдра.
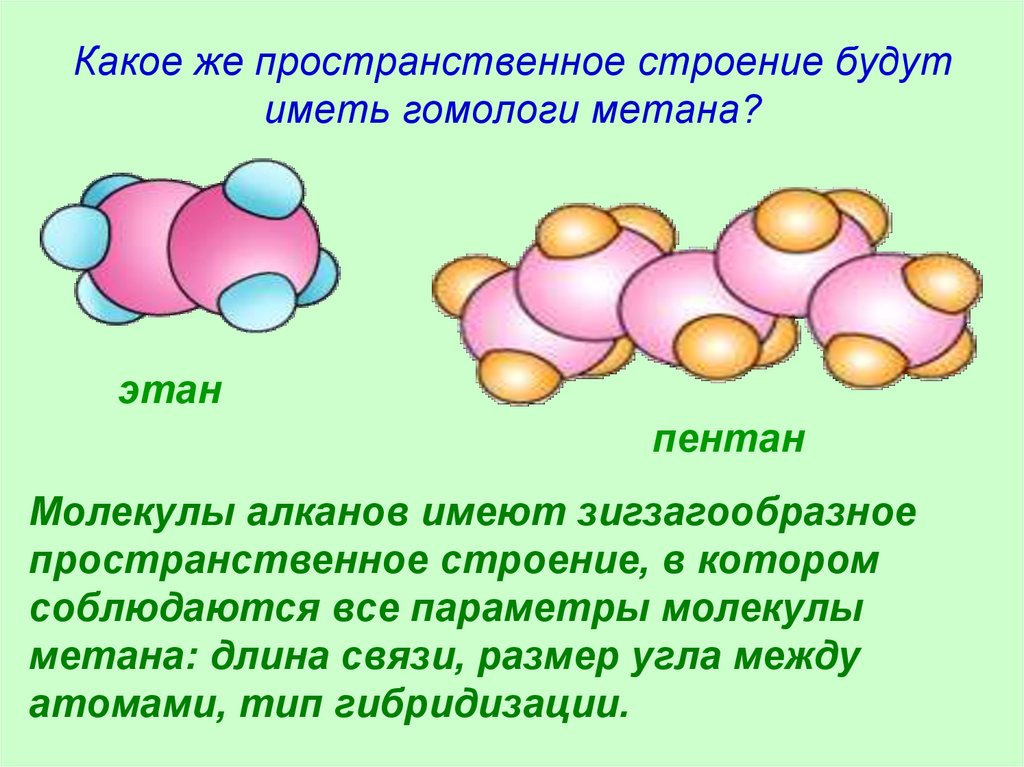
20. Какое же пространственное строение будут иметь гомологи метана?
этанпентан
Молекулы алканов имеют зигзагообразное
пространственное строение, в котором
соблюдаются все параметры молекулы
метана: длина связи, размер угла между
атомами, тип гибридизации.
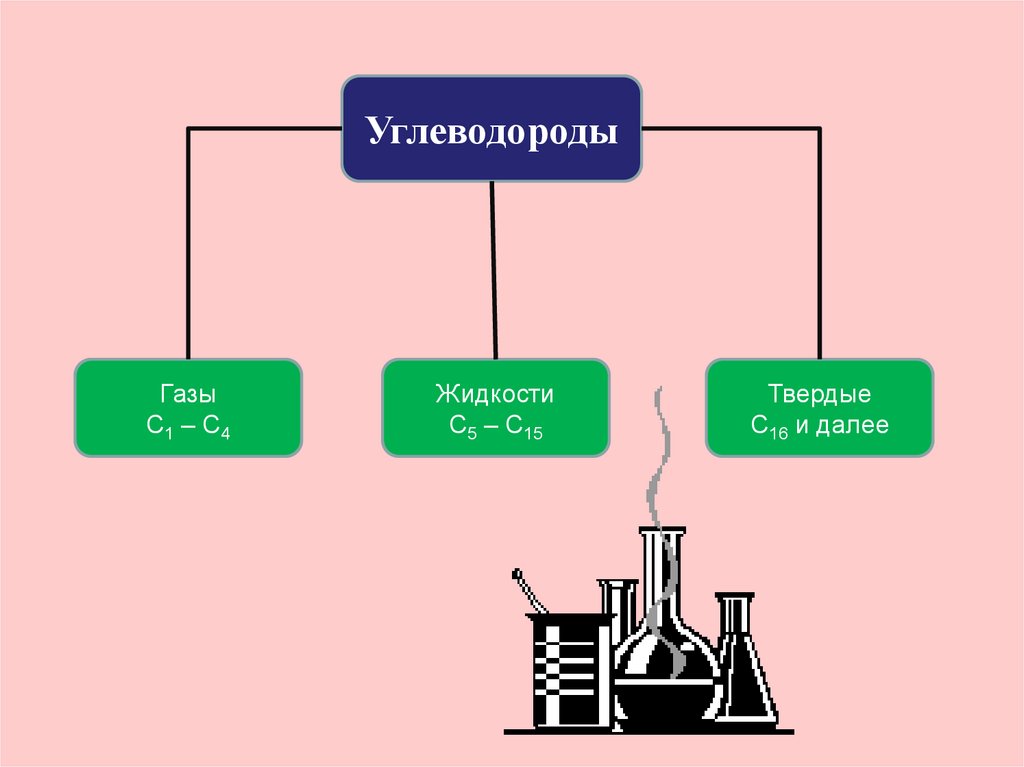
21.
УглеводородыГазы
С1 – С4
Жидкости
С5 – С15
Твердые
С16 и далее
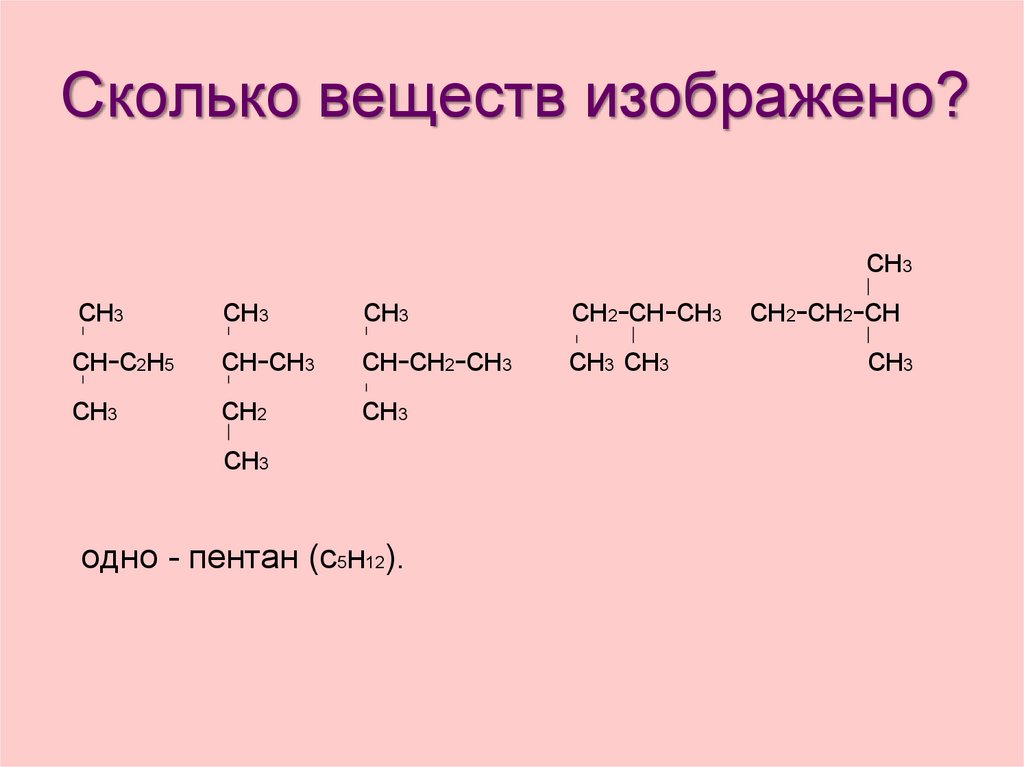
22. Сколько веществ изображено?
сн3сн-с2н5
сн3
сн3
сн-сн3
сн2
сн3
сн3
сн-сн2-сн3
сн3
одно - пентан (с5н12).
сн2-сн-сн3
сн3 сн3
сн3
сн2-сн2-сн
сн3
23.
галогенированиезамещение
Для каждого типа
реакций привести
примеры
Химические свойства алканов
нитрование
дегидрирование
отщепление
ароматизация
горение
окисление
Каталитическое
окисление
пиролиз
Разрушение цепи
крекинг
изомеризация
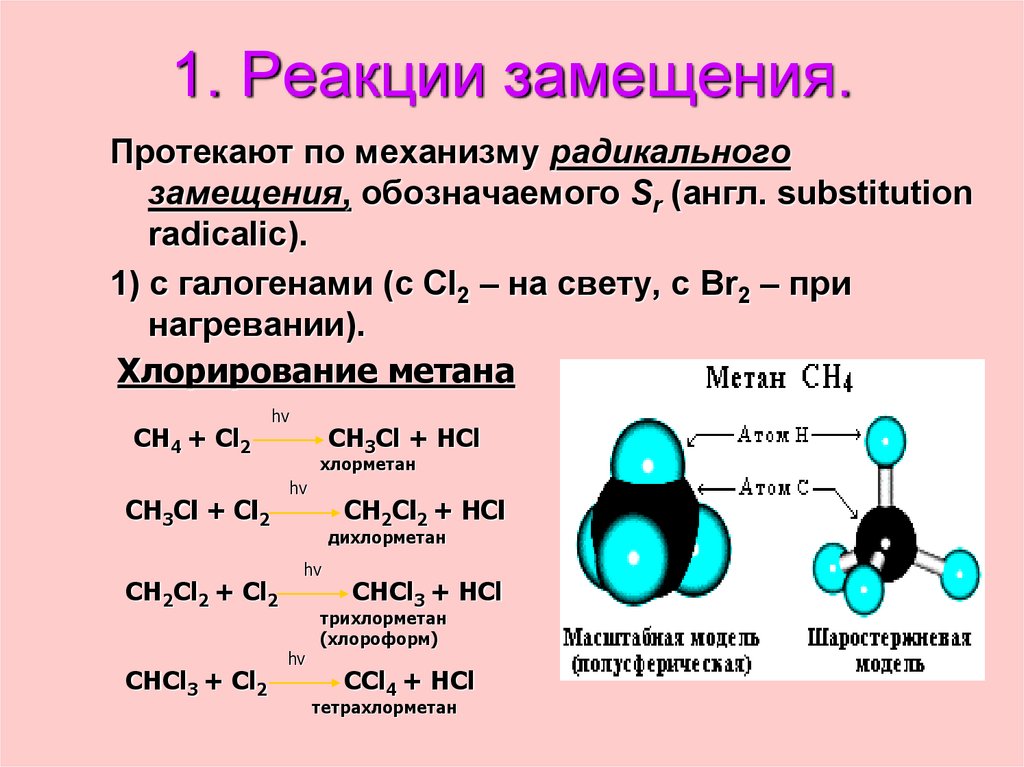
24. 1. Реакции замещения.
Протекают по механизму радикальногозамещения, обозначаемого Sr (англ. substitution
radicalic).
1) с галогенами (с Cl2 – на свету, с Br2 – при
нагревании).
Хлорирование метана
CH4 + Cl2
hv
CH3Cl + Cl2
CH2Cl2 + Cl2
CHCl3 + Cl2
CH3Cl + HCl
хлорметан
hv
CH2Cl2 + HCl
дихлорметан
hv
hv
CHCl3 + HCl
трихлорметан
(хлороформ)
CCl4 + HCl
тетрахлорметан
25. ХИМИЧЕСКИЕ СВОЙСТВА: 1. РЕАКЦИЯ ЗАМЕЩЕНИЯ.
Реакции протекают по радикальному механизму.1) Реакция галогенирования:
t
СН4 + Сl2
CH3Cl + HCl + Q
2) Реакция нитрования (Коновалова):
Н
Н
С
Н + НО
NO2
t
СН3
NO2 + H2O + Q
Н
3) Реакция сульфирования:
Н
t
Н
С
Н
Н + НО
SO3H
СН3
SO3H + H2O + Q
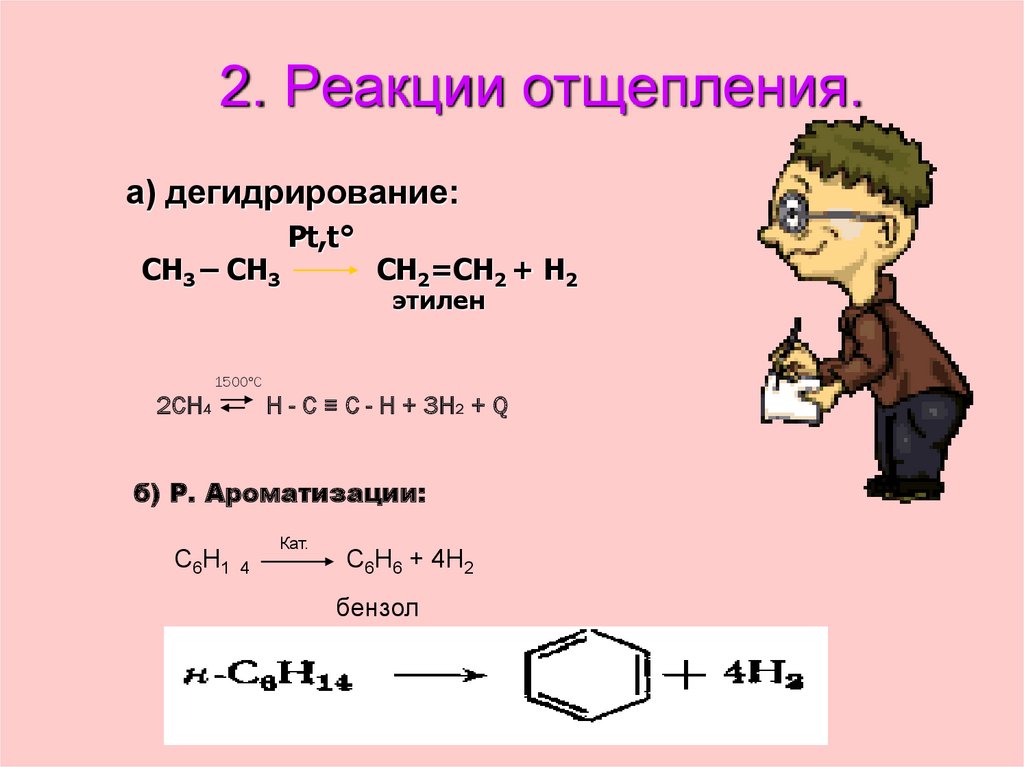
26. 2. Реакции отщепления.
а) дегидрирование:CH3 – CH3
Pt,t°
CH2=CH2 + H2
этилен
1500°С
2СН4
Н - С ≡ С - Н + 3Н2 + Q
б) Р. Ароматизации:
С6Н1
Кат.
4
С6Н6 + 4Н2
бензол
27. 3. Реакции окисления.
а) все алканы горят собразованием углекислого
газа и воды :
б) при недостатке кислорода
алканы могут сгорать до
угарного газа или с
образованием сажи
(коптят):
28. Горение алканов:
29. РЕАКЦИЯ ГОРЕНИЯ:
CH4 + 2O2 → CO2 + 2H2O + Q30.
4. Разрушение цепи.а) для метана характерен пиролиз:
0
СН4 1000
С+ 2Н2
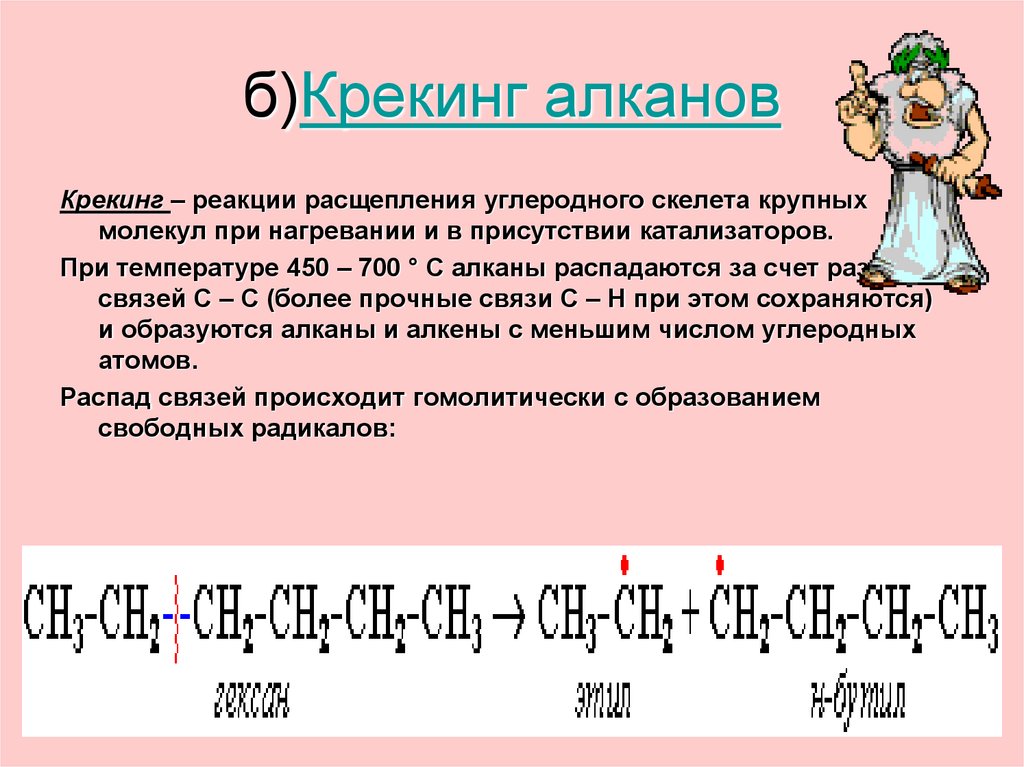
31. б)Крекинг алканов
Крекинг – реакции расщепления углеродного скелета крупныхмолекул при нагревании и в присутствии катализаторов.
При температуре 450 – 700 ° С алканы распадаются за счет разрыва
связей С – С (более прочные связи С – Н при этом сохраняются)
и образуются алканы и алкены с меньшим числом углеродных
атомов.
Распад связей происходит гомолитически с образованием
свободных радикалов:
32. в)Реакции изомеризации.
Алканы подвергаются изомеризации принагревании на катализаторе AlCl3 :
33.
МЕТАН – газ, без цвета и запаха,почти в 2 раза легче воздуха, мало
растворим в воде. Он образуется в
природе в результате разложения без
доступа воздуха остатков
растительных и животных
организмов. Поэтому может быть
обнаружен в заболоченных водоемах,
где появляется в виде пузырьков газа,
или накапливается в каменноугольных
шахтах, куда выделяется из угольных
пластов. В значительном количестве
(80-97%) метан содержится в
природном газе и в попутных
нефтяных газах.
34.
ЭТАН, ПРОПАН И БУТАНвходят в состав природного
и попутного нефтяного
газов. АЛКАНЫ содержатся
в нефти. С ростом
относительной
молекулярной массы
наблюдается переход
количественных отношений
в качественные:
изменяется агрегатное
состояние, возрастают
температуры плавления и
кипения.




















 Химия
Химия