Похожие презентации:
Сера. Важнейшие соединения серы
1.
ФармацияДисциплина «Общая и неорганическая химия»
Раздел «Химия элементов»
Электронный дидактический материал И - типа
на тему:
Сера. Важнейшие соединения серы.
Составитель: Галимуллина Л.Н., преподаватель КМК.
Выход
2.
Цели занятияУчебная: добиться прочного
усвоения
системы
знаний,
сформировать умение объяснять
факты на основе причинноследственных
связей,
закономерностей.
Развивающая: формирование
навыков
самообразования,
развитие речи, памяти, мышления,
самореализации личности.
Воспитательная: формирование
у студентов общечеловеческих
ценностей;
целостного
миропонимания и современного
научного мировоззрения.
Далее
Назад
Содержание
Выход
3.
ВведениеЭлектронный дидактический материал на тему:
«Сера. Важнейшие соединения серы» предназначен для проведения
теоретического занятия и самостоятельной работы студентов
медицинских училищ и колледжей по специальности «Фармация».
Рекомендации по работе с ЭДМ:
1. Ознакомьтесь с требованиями ФГОС по данной теме
2. Изучите информационный материал занятия.
3. Выучите термины и определения.
4. Выполните задания для закрепления знаний по учебнику Ерохин
Ю.М. Сборник задач и упражнений – стр. 94-95 (1-17).
Далее
Назад
Содержание
Выход
4.
Требования к студентамПосле изучения темы «Сера.
Важнейшие
соединения
серы»
студент должен знать:
общую характеристику элементов
VIА группы, особенности строения,
валентность элементов; получение и
свойства серы и её важнейших
соединений, биологическое значение
серы, применение серы и её
соединений в медицине.
Далее
Назад
Содержание
Выход
5.
АктуальностьВ группе VIA к широко известным
химическим элементам относится сера.
В фармации применяются сера в виде
простого вещества, серная кислота и
сульфаты, тиосульфат натрия.
Сера входит в состав многих
лекарственных субстанций (стрептоцид
H2NC6H4SO2NH2 , значительное число
лекарств, названия которых начинаются
с приставки сульфа-: сульфазин,
сульфадимезин и др.)
Сера входит в состав белков.
Общая масса серы в организме
человека ~ 120г.
Далее
Назад
Содержание
Выход
6.
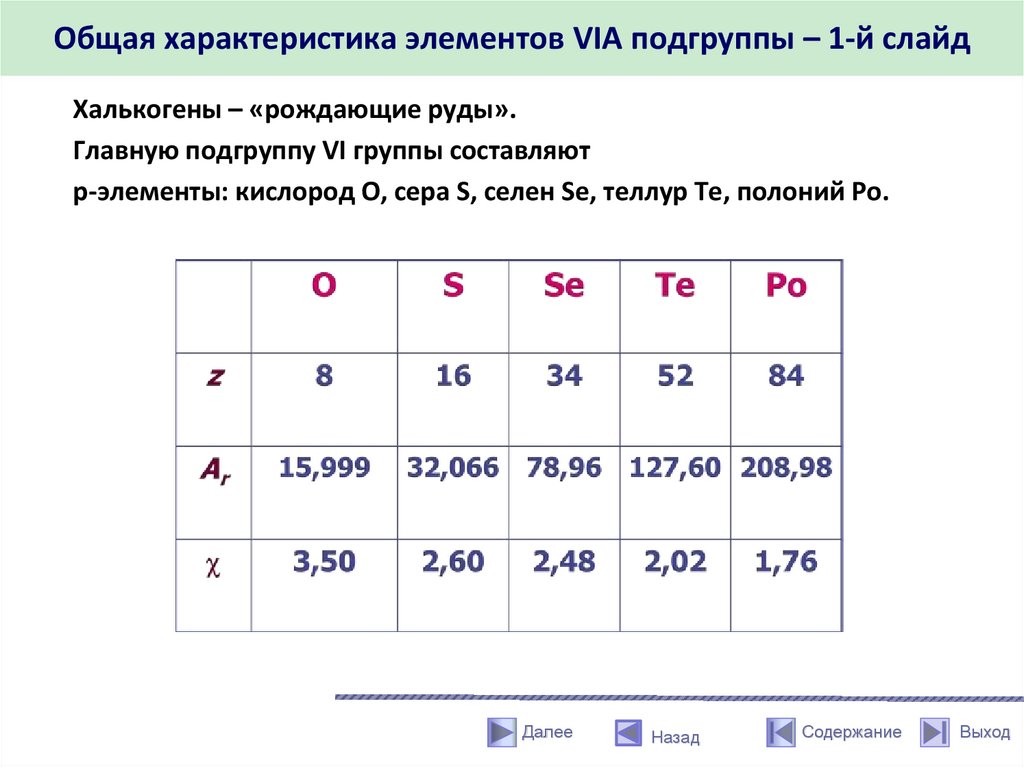
Общая характеристика элементов VIA подгруппы – 1-й слайдХалькогены – «рождающие руды».
Главную подгруппу VI группы составляют
р-элементы: кислород О, сера S, селен Se, теллур Те, полоний Ро.
Далее
Назад
Содержание
Выход
7.
Сера в природе – 1-й слайдСера широко распространена в
природе и встречается как в
свободном состоянии (самородная
сера), так и виде соединений.
Сера
Минералы сульфидные:
Пирит - FeS2
Халькозин -Cu2S
Ковелин - CuS
Халькопирит - CuFeS2
Минералы сульфатные:
Гипс CaSO4•2H2O
Мирабилит – Na2SO4•10H2O
Горькая соль-MgSO4*7H2O
Далее
Назад
Содержание
Выход
8.
Сера в природе (продолжение)Пирит
Халькозин
Ковелин
Халькопирит
Мирабилит
Гипс
Далее
Назад
Содержание
Выход
9.
Сера в природе (окончание)Содержание серы в земной коре составляет 0,0048 %.
Много соединений серы содержится в нефти (тиофен C4H4S,
органические сульфиды) и нефтяных газах (сероводород).
Самородная сера встречается в местах выхода вулканических газов на
камчатке, курильских островах.
Далее
Назад
Содержание
Выход
10.
Физические свойства серыСера - твердое хрупкое вещество желтого
цвета, в воде практически нерастворима,
не смачивается водой и плавает на её
поверхности.
Хорошо растворяется в сероуглероде и
других органических растворителях, плохо
проводит тепло и электрический ток.
При плавлении сера образует
легкоподвижную жидкость желтого
цвета, которая при 160°С темнеет, её
вязкость повышается, и при 200°С сера
становится темно-коричневой и вязкой,
как смола.
Пары серы имеют цвет от оранжевожелтого до соломенно-желтого цвета. Пар
состоит из молекул состава S8, S6, S4, S2.
Далее
Назад
Содержание
Выход
11.
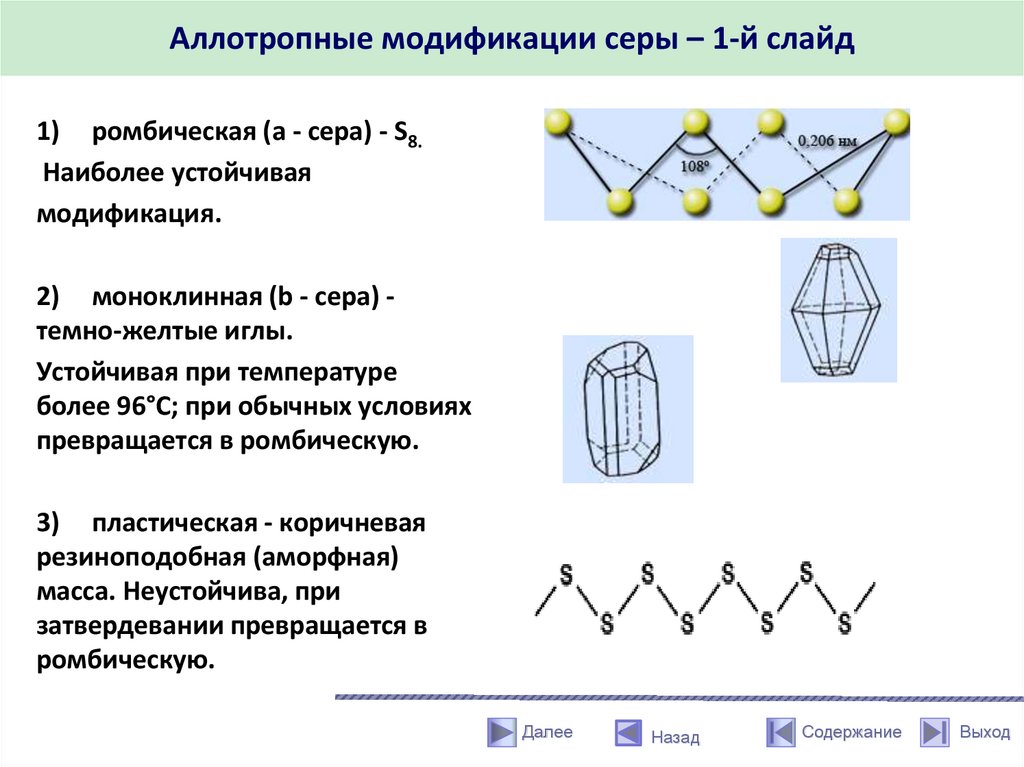
Аллотропные модификации серы – 1-й слайд1) ромбическая (a - сера) - S8.
Наиболее устойчивая
модификация.
2) моноклинная (b - сера) темно-желтые иглы.
Устойчивая при температуре
более 96°С; при обычных условиях
превращается в ромбическую.
3) пластическая - коричневая
резиноподобная (аморфная)
масса. Неустойчива, при
затвердевании превращается в
ромбическую.
Далее
Назад
Содержание
Выход
12.
Аллотропные модификации серы (окончание)Моноклинная
сера
Свойство
Ромбическая сера
Цвет
Светло-желтый
порошок
Желтые иглы
Темножелтая масса
2,07
1,96
-
112,8
119,3
-
Плотность,
г/см3
Температура
плавления,
°С
Температура
кипения, °С
Пластическая сера
444,6
Далее
Назад
Содержание
Выход
13.
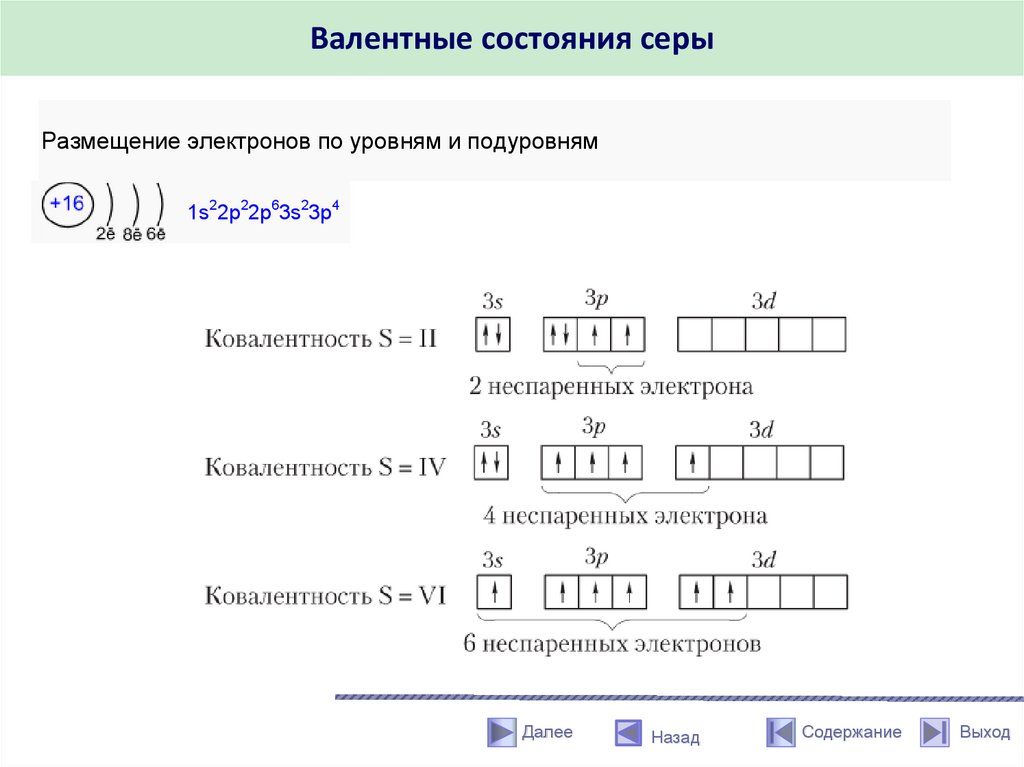
Валентные состояния серыРазмещение электронов по уровням и подуровням
1s22p22p63s23p4
Далее
Назад
Содержание
Выход
14.
Валентные состояния серы, соединенияСтепень окисления
Вещества
-2
0
H2 S
S
сероводород простое
сульфиды вещество
Na2 S
Al2S3
+4
SO2
оксид
серы (IV)
H2SO3
K2SO3
NaHSO3
+6
SO3
оксид
cеры(VI)
H2SO4
Na2SO4
NaHSO4
Наиболее устойчивы соединения фосфора со степенью окисления +6
Далее
Назад
Содержание
Выход
15.
Получение серы1.
При нагревании пирита без доступа воздуха
FeS2 → FeS + S.
2.
Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2 → 2S + 2H2O
3. Реакция Вакенродера:
2H2S + SO2 → 3S + 2H2O
4. Смешивание газообразных сероводорода и сернистого газа:
2H2S + SO2 → 3S↓+ 2H2O
5. Реакция соляной кислоты с раствором тиосульфата натрия:
Na2S2O3+2HCl → S↓ +SO2+2NaCl+H2O
Далее
Назад
Содержание
Выход
16.
Химические свойства серы 1-й слайдПри комнатной температуре сера
вступает в реакции только с ртутью.
С повышением температуры её
активность значительно
повышается. При нагревании сера
непосредственно реагирует со
многими простыми веществами, за
исключением инертных газов,
азота, селена, теллура, золота,
платины, иридия и йода. Сульфиды
азота и золота получены косвенным
путем.
Далее
Назад
Содержание
Выход
17.
Химические свойства серы (продолжение)Окислительные свойства серы
(S0 + 2ē → S-2)
1) Сера реагирует со щелочными
металлами без нагревания:
2Na + S → Na2S
c остальными металлами
(кроме Au, Pt) - при повышенной t°:
2Al + 3S → Al2S3
Zn + S → ZnS
Реакция соединения серы с железом
Далее
Назад
Содержание
Выход
18.
Химические свойства серы (продолжение)С некоторыми неметаллами сера образует бинарные соединения.
2)Взаимодействие с водородом происходит при 150–200 °С:
H2 + S → H2S
3)Взаимодействие с фосфором и углеродом
При нагревании без доступа воздуха сера реагирует с фосфором,
углеродом, проявляя окислительные свойства:
2P + 3S → P2S3
2S + C → CS2.
Далее
Назад
Содержание
Выход
19.
Химические свойства серы (продолжение)Восстановительные свойства сера проявляет в реакциях с сильными
окислителями:
(S - 2ē → S+2;
S - 4ē → S+4;
S - 6ē → S+6)
4) c кислородом:
Сера горит в кислороде при 280 °С, на воздухе при 360 °С, при этом
образуется смесь оксидов:
S + O2 → S+4O2
2S + 3O2 → 2S+6O3
5)
c галогенами (кроме йода):
S + Cl2 → S+2Cl2
6)
c кислотами - окислителями:
S + 2H2SO4(конц) → 3S+4O2 + 2H2O
S + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
Далее
Назад
Содержание
Выход
20.
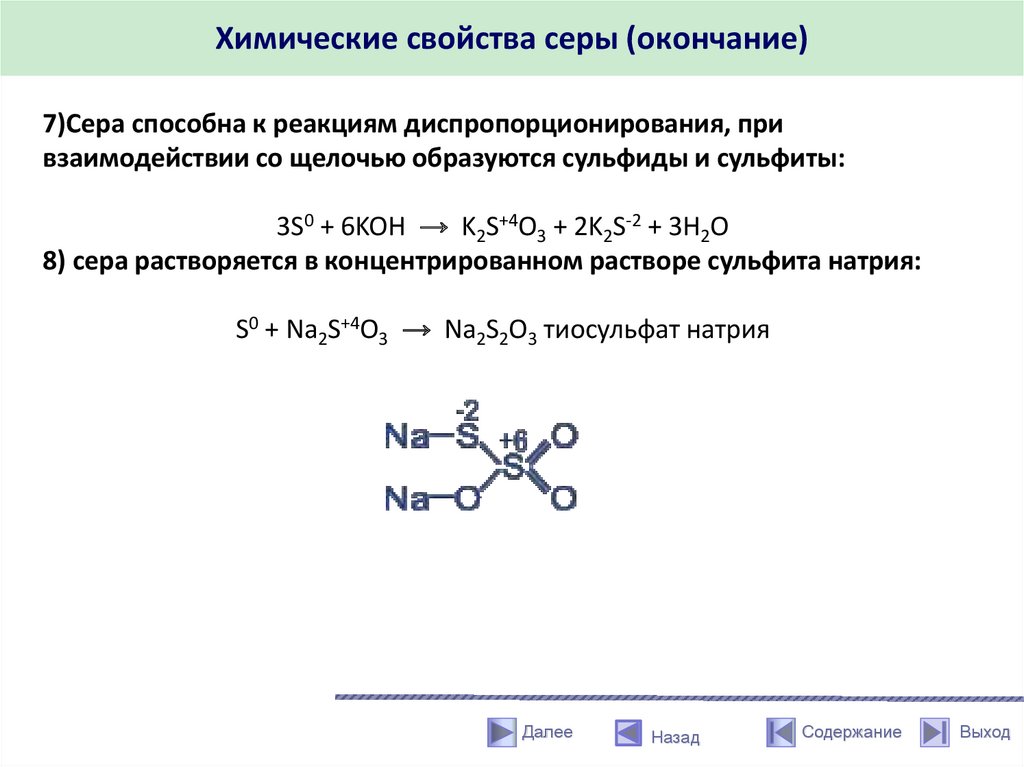
Химические свойства серы (окончание)7)Сера способна к реакциям диспропорционирования, при
взаимодействии со щелочью образуются сульфиды и сульфиты:
3S0 + 6KOH → K2S+4O3 + 2K2S-2 + 3H2O
8) сера растворяется в концентрированном растворе сульфита натрия:
S0 + Na2S+4O3 → Na2S2O3 тиосульфат натрия
Далее
Назад
Содержание
Выход
21.
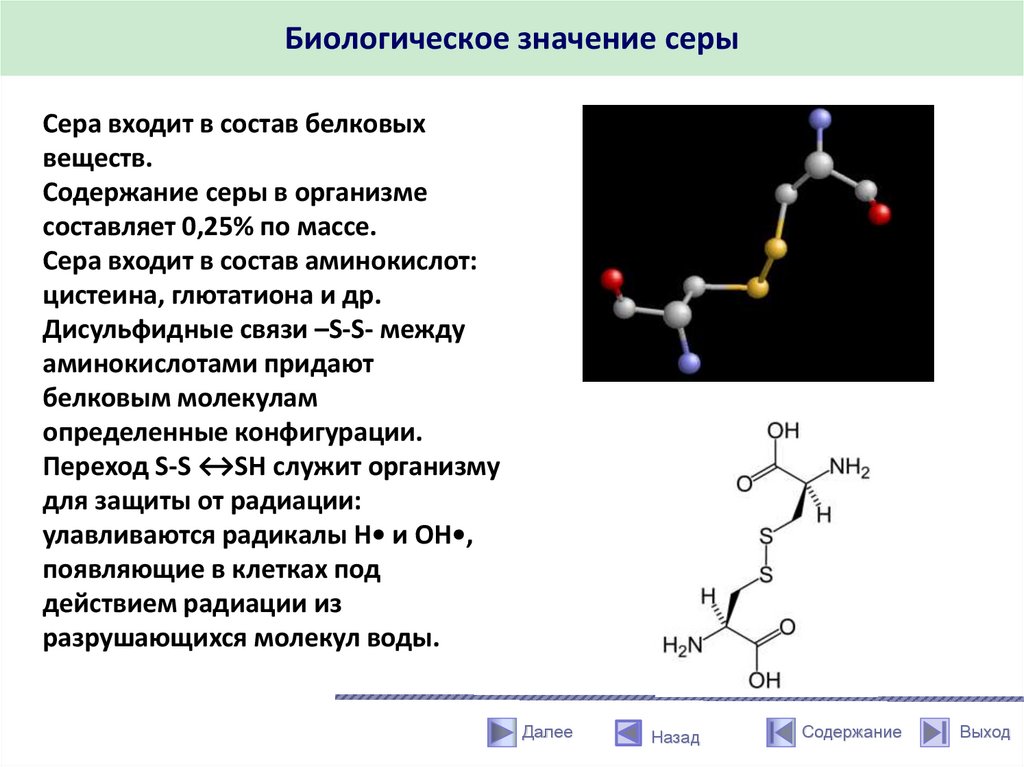
Биологическое значение серыСера входит в состав белковых
веществ.
Содержание серы в организме
составляет 0,25% по массе.
Сера входит в состав аминокислот:
цистеина, глютатиона и др.
Дисульфидные связи –S-S- между
аминокислотами придают
белковым молекулам
определенные конфигурации.
Переход S-S ↔SH служит организму
для защиты от радиации:
улавливаются радикалы Н• и ОН•,
появляющие в клетках под
действием радиации из
разрушающихся молекул воды.
Далее
Назад
Содержание
Выход
22.
СероводородСтроение молекулы сероводорода
H2S аналогично строению
молекулы воды, однако в отличие
от воды молекулы сероводорода
не образуют между собой
водородных связей.
Содержится в вулканических газах
и постоянно образуется на дне
Черного моря. Образуется при
гниение белков, поэтому тухлые
яйца пахнут сероводородом.
Далее
Назад
Содержание
Выход
23.
Физические свойства сероводородаПри обычных условиях сероводород – бесцветный газ, с сильным
характерным запахом тухлых яиц.
Тпл = -86 °С,Ткип = -60 °С
Плохо растворим в воде, при 20 °С в 100 г воды растворяется 2,58 мл
H2S.
хорошо растворим в спирте, хуже – воде (при комнатной температуре
только 2,5 объема в одном объеме воды). При этом образуется слабая
двухосновная сероводородная кислота:
H2S +H2O ↔ H3О+ + HS Очень ядовит, при вдыхании вызывает паралич, что может привести к
смертельному исходу.
В природе выделяется в составе вулканических газов, образуется при
гниении растительных и животных организмов.
При растворении в воде образует слабую сероводородную кислоту.
Далее
Назад
Содержание
Выход
24.
Химические свойства сероводорода -1-й слайд1)В водном растворе сероводород обладает
свойствами слабой двухосновной кислоты:
H2S = HS- + H+;
HS- = S2- + H+.
2)Сероводород горит в воздухе голубым
пламенем. При ограниченном доступе воздуха
образуется свободная сера:
2H2S + O2 = 2H2O + 2S.
При избыточном доступе воздуха горение
сероводорода приводит к образованию оксида
серы (IV):
2H2S + 3O2 = 2H2O + 2SО2.
Далее
Назад
Содержание
Выход
25.
Химические свойства сероводорода (продолжение)3)Сероводород обладает восстановительными свойствами.
В зависимости от условий сероводород может окисляться в водном
растворе до серы, сернистого газа и серной кислоты.
Например, он обесцвечивает бромную воду:
H2S + Br2 = 2HBr + S
взаимодействует с хлорной водой:
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
Струю сероводорода можно поджечь, используя диоксид свинца, так как
реакция сопровождается большим выделением тепла:
3PbO2 + 4H2S = 3PbS + SO2 + 4H2O
Далее
Назад
Содержание
Выход
26.
Химические свойства сероводорода (продолжение)Взаимодействие сероводорода с сернистым газом используется для
получения серы из отходящих газов металлургического и сернокислого
производства:
SO2 + 2H2S = 3S + 2H2O
С этим процессом связано образование самородной серы при
вулканических процессах.
При одновременном пропускании сернистого газа и сероводорода через
раствор щелочи образуется тиосульфат:
4SO2 + 2H2S + 6NaOH = 3Na2S2O3 + 5H2O
Далее
Назад
Содержание
Выход
27.
Получение сероводорода1)Реакция разбавленной соляной кислоты с сульфидом железа (II)
FeS + 2HCl = FeCl2 + H2S
2)Взаимодействие сульфида алюминия с холодной водой
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
3)Прямой синтез из элементов происходит при пропускании водорода над
расплавленной серой:
H2 + S = H2S
4)Нагревание смеси парафина с серой.
Далее
Назад
Содержание
Выход
28.
Сероводородная кислота и её солиСероводородной кислоте присущи все свойства слабых кислот. Она
реагирует с металлами, оксидами металлов, основаниями.
Как двухосновная, кислота образует два типа солей – сульфиды и
гидросульфиды.
2KOH + H2S = K2S + 2H2O
KOH + H2S = KHS +H2S
Гидросульфиды хорошо растворимы в воде, сульфиды щелочных и
щелочно-земельных металлов также, сульфиды тяжелых металлов
практически нерастворимы.
Сульфиды щелочных и щелочноземельных металлов не окрашены,
остальные имеют характерную окраску, например, сульфиды меди (II),
никеля и свинца – черные, кадмия, индия, олова – желтые, сурьмы –
оранжевый.
Далее
Назад
Содержание
Выход
29.
Получение сульфидов1)Прямое взаимодействие простых веществ при нагревании в инертной
атмосфере
Fe + S = FeS.
2)Восстановление твердых солей оксокислот
BaSO4 + 4C = BaS + 4CO (при 1000°С)
SrSO3 + 2NH3 = SrS + N2 + 3H2O (при 800°С)
CaCO3 + H2S + H2 = CaS + CO + 2H2O (при 900°С)
3)Малорастворимые сульфиды металлов осаждают из их растворов
действием сероводорода или сульфида аммония
Mn(NO3)2 + H2S = MnS↓ + 2HNO3
Pb(NO3)2 + (NH4)2S = PbS↓ + 2NH4NO3
Далее
Назад
Содержание
Выход
30.
Химические свойства сульфидов1)Растворимые сульфиды в воде сильно гидролизованны, имеют
щелочную среду:
Na2S + H2O = NaHS + NaOH
S2- + H2O = HS- + OH2)Окисляются кислородом воздуха, в зависимости от условий возможно
образование оксидов, сульфатов и металлов:
2CuS + 3O2 = 2CuO + 2SO2
CaS + 2O2 = CaSO4
Ag2S + O2 = 2Ag + SO2
3)Сульфиды, особенно растворимые в воде, являются сильными
восстановителями:
2KMnO4 + 3K2S + 4H2O = 3S + 2MnO2 + 8KOH.
Далее
Назад
Содержание
Выход
31.
Токсичность сероводородаНа воздухе сероводород воспламеняется около 300 °С.
Взрывоопасны его смеси с воздухом, содержащие от 4 до 45%
Н2S. 0,1 % Н2S в воздухе быстро вызывает тяжелое отравление.
Признаки отравления сероводородом:
потеря обоняния
головная боль, головокружение и тошнота
внезапные обмороки
Противоядием служит, прежде всего, чистый воздух.
ПДК Н2S в воздухе производственных помещений считается
0,01 мг/л.
Далее
Назад
Содержание
Выход
32.
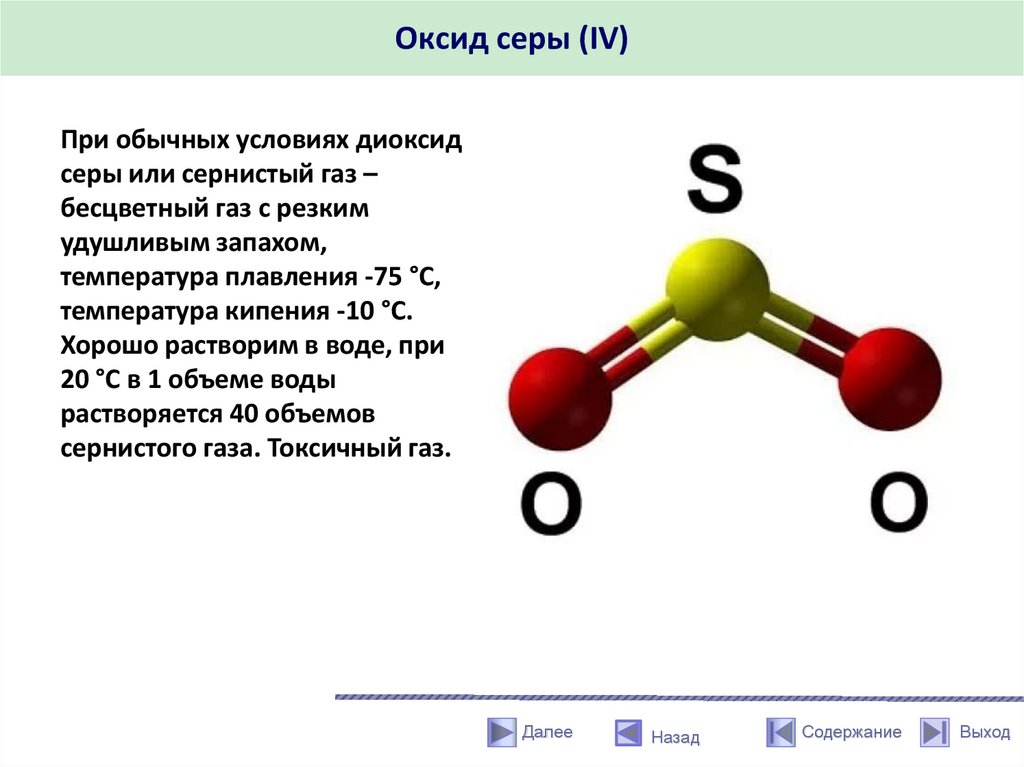
Оксид серы (IV)При обычных условиях диоксид
серы или сернистый газ –
бесцветный газ с резким
удушливым запахом,
температура плавления -75 °С,
температура кипения -10 °С.
Хорошо растворим в воде, при
20 °С в 1 объеме воды
растворяется 40 объемов
сернистого газа. Токсичный газ.
Далее
Назад
Содержание
Выход
33.
Получение оксида серы (IV)Получение:
1)Сжигание серы на воздухе
S + O2 = SO2.
2)Окисление сульфидов
4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
3)Действие сильных кислот на сульфиты металлов
Na2SO3 + 2H2SO4 = 2NaHSO4 + H2O + SO2.
4)Взаимодействие концентрированной серной кислоты с медью
при нагревании:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Далее
Назад
Содержание
Выход
34.
Химические свойства оксида серы (IV) – 1-й слайд1)Сернистый газ обладает высокой реакционной способностью. Диоксид
серы – кислотный оксид. Он довольно хорошо растворим в воде с
образованием гидратов. Также он частично взаимодействует с водой,
образуя слабую сернистую кислоту, которая не выделена в
индивидуальном виде:
SO2 + H2O = H2SO3
В результате диссоциации образуются протоны, поэтому раствор имеет
кислую среду.
2) При пропускании газообразного диоксида серы через раствор
гидроксида натрия образуется сульфит натрия. Сульфит натрия реагирует
с избытком диоксида серы и образуется гидросульфит натрия:
2NaOH + SO2 = Na2SO3 + H2O;
Na2SO3+ SO2 = 2NaHSO3.
Далее
Назад
Содержание
Выход
35.
Химические свойства оксида серы (IV) - окончание3)Для сернистого газа характерна окислительно-восстановительная
двойственность, например, он, проявляя восстановительные свойства,
обесцвечивает бромную воду:
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
NaHSO3+I2+H2O=NaHSO4+2HI
и раствор перманганата калия:
5SO2 + 2KMnO4 + 2H2O = 2KНSO4 + 2MnSO4 + H2SO4.
окисляется кислородом в серный ангидрид:
2SO2 + O2 = 2SO3.
4)Окислительные свойства проявляет при взаимодействии с сильными
восстановителями, например:
SO2 + 2CO = S + 2CO2 (при 500 °С, в присутствии Al2O3);
SO2 + 2H2 = S + 2H2O.
Далее
Назад
Содержание
Выход
36.
Химические свойства сульфитов1)Растворимые сульфиты сильно гидролизуются:
Na2SO3 + H2O = NaHSO3 + NaOH
SO32- + H2O = HSO3- + OH2)Сернистая кислота и её соли проявляют ярко выраженные
восстановительные свойства :
NaHSO3+I2+H2O=NaHSO4+2HI
Fe2(SO4)3 + SO2 + 2H2O = 2FeSO4 + 2H2SO4;
K2Cr2O7 + 3K2SO3 + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4H2O.
3)Водные растворы сульфитов щелочных металлов окисляются на
воздухе :
2Na2SO3 + O2 = 2Na2SO4
4)Твердые сульфиты щелочных металлов при сильном нагревании
диспропорционируют :
4Na2SO3 = 3Na2SO4 + Na2S (при 900°С)
а соли щелочноземельных металлов разлагаются при нагревании в
вакууме до оксидов:
CaSO3 = CaO + SO2
Далее
Назад
Содержание
Выход
37.
Соединения серы (VI)Степень окисления +6 для серы
является довольно устойчивой и
проявляется в соединениях с более
электроотрицательными
элементами: в гексафториде SF6,
оксо- и диоксогалогенидах, оксиде
и соответствующих им анионах.
Мы познакомимся со свойствами
триоксида серы и серной кислоты.
Далее
Назад
Содержание
Выход
38.
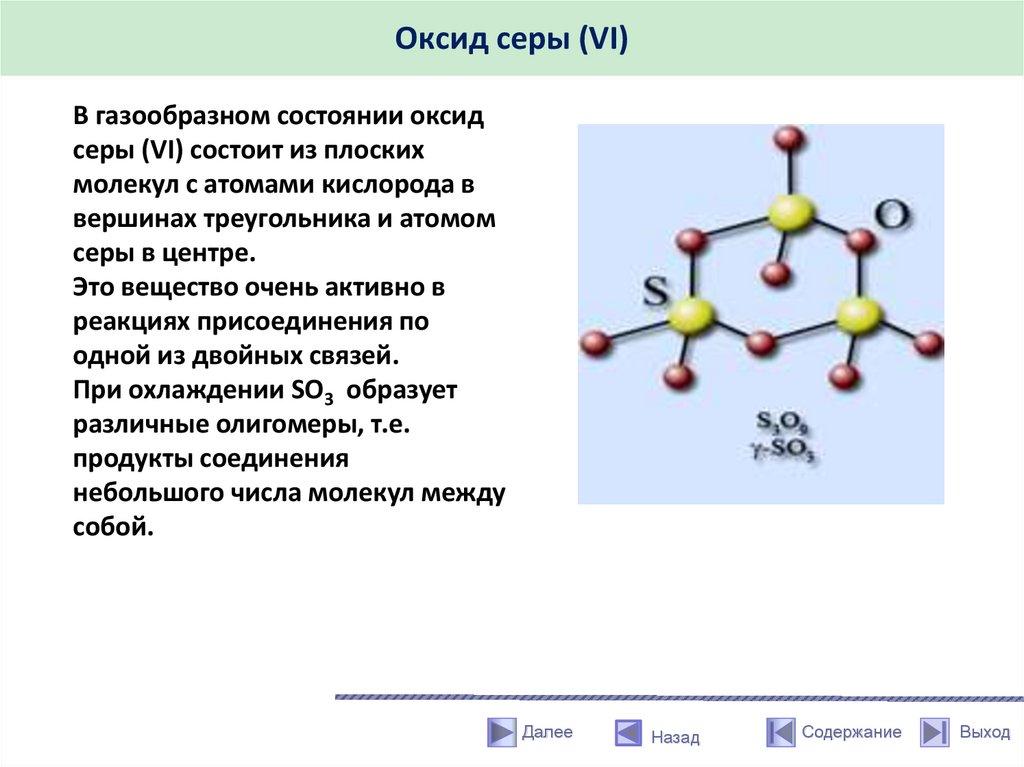
Оксид серы (VI)В газообразном состоянии оксид
серы (VI) состоит из плоских
молекул с атомами кислорода в
вершинах треугольника и атомом
серы в центре.
Это вещество очень активно в
реакциях присоединения по
одной из двойных связей.
При охлаждении SO3 образует
различные олигомеры, т.е.
продукты соединения
небольшого числа молекул между
собой.
Далее
Назад
Содержание
Выход
39.
Получение оксида серы (VI)Получение оксида серы (VI)
1)В промышленности производится в огромных масштабах с целью
получения серной кислоты:
2SO2 + O2 = 2SO3 (450 °C, катализатор V2O5).
2)В лаборатории получают термическим разложением некоторых
сульфатов:
Fe2(SO4)3 = Fe2O3 + 3SO3.
Далее
Назад
Содержание
Выход
40.
Химические свойства оксида серы (VI)1)Серный ангидрит термически неустойчив. Его разложение
начинается при 450 °С, а при 1200 °С в газовой фазе полностью
отсутствуют молекулы SO3:
2SO3 = 2SO2 + O2
2)Бурно взаимодействует с водой с выделением большого количества
тепла. Газообразный триоксид серы плохо поглощается водой, так как
образуется туман :
nSO3 + H2O = H2SO4· nSO3 (олеум)
Наибольшее значение имеют реакции соединения SO3
SO3 +H2SO4=H2S2O7 - дисерная кислота
SO3+HCl=HSO3Cl – хлорсульфоновая кислота
Далее
Назад
Содержание
Выход
41.
Химические свойства оксида серы (VI)3)Проявляет свойства типичного кислотного оксида :
SO3 + CaO = CaSO4
SO3 + NaOH = NaHSO4
SO3 + 2NaOH = Nа2SO4 + Н2О
4)Серный ангидрит – одно из самых реакционноспособных
соединений. Он проявляет только окислительные свойства, например:
2SO3 + C = 2SO2 + CO2
2SO3 + 2HBr = SO2 + Br2 + H2SO4
Далее
Назад
Содержание
Выход
42.
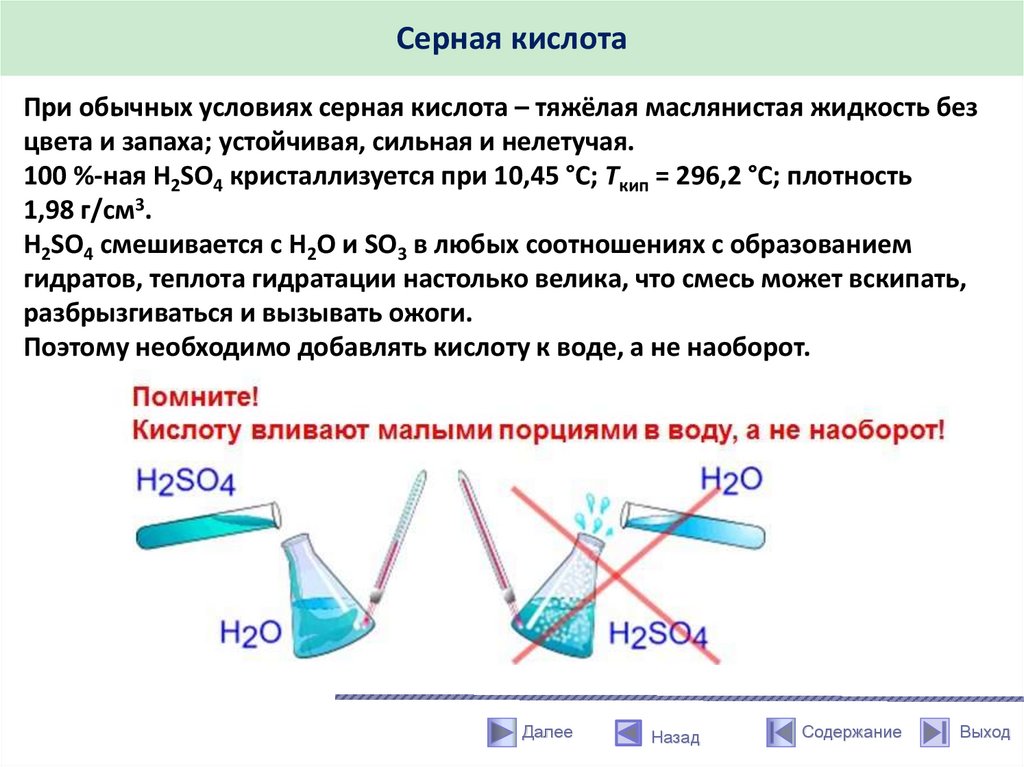
Серная кислотаПри обычных условиях серная кислота – тяжёлая маслянистая жидкость без
цвета и запаха; устойчивая, сильная и нелетучая.
100 %-ная H2SO4 кристаллизуется при 10,45 °С; Ткип = 296,2 °С; плотность
1,98 г/см3.
H2SO4 смешивается с Н2О и SO3 в любых соотношениях с образованием
гидратов, теплота гидратации настолько велика, что смесь может вскипать,
разбрызгиваться и вызывать ожоги.
Поэтому необходимо добавлять кислоту к воде, а не наоборот.
Далее
Назад
Содержание
Выход
43.
Химические свойства оксида серы (VI)1)В водном растворе серная кислота диссоциирует, образуя ион водорода и
кислотный остаток:
H2SO4 = H+ + HSO4HSO4- = H+ + SO42Суммарное уравнение:
H2SO4 = 2H+ + SO422)Проявляет свойства кислот, реагирует с металлами, оксидами металлов,
основаниями и солями:
CaO + H2SO4 = CaSO4 = H2O.
2NaOH + H2SO4 = Na2SO4 + 2H2O.
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O.
Разбавленная серная кислота не проявляет окислительных свойств, при ее
взаимодействии с металлами выделяется водород и соль, содержащая
металл в низшей степени окисления. На холоде кислота инертна по
отношению к таким металлам, как железо, алюминий и даже барий.
Далее
Назад
Содержание
Выход
44.
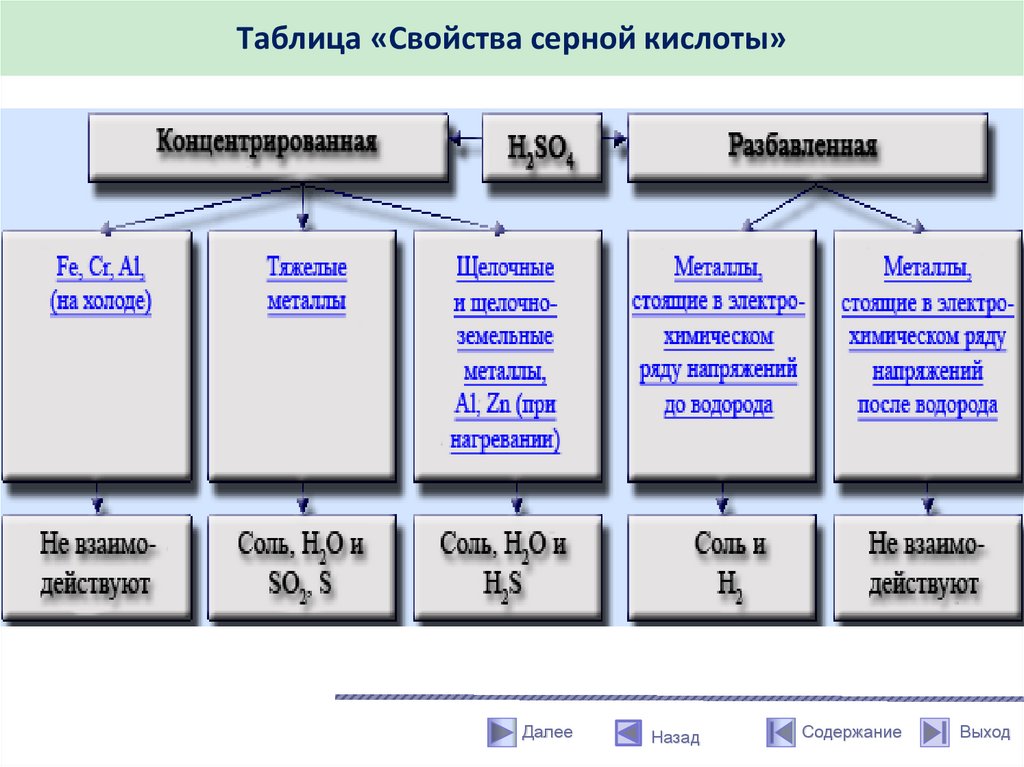
Химические свойства оксида серы (VI)Концентрированная кислота
(«купоросное масло») обладает
окислительными свойствами.
Возможные продукты взаимодействия
простых веществ с концентрированной
серной кислотой приведены в таблице.
Показана зависимость продукта
восстановления от концентрации
кислоты и степени активности металла:
чем активнее металл, тем глубже он
восстанавливает сульфат-ион серной
кислоты.
Концентрированная серная кислота
проявляет сильное водоотнимающее
действие.
Далее
Назад
Содержание
Выход
45.
Химические свойства оксида серы (VI)Концентрированная серная кислота при обычной температуре со
многими металлами не реагирует. Поэтому безводную серную кислоту
можно хранить в железной таре и перевозить в стальных цистернах.
Однако при нагревании концентрированная Н2SO4 взаимодействует
почти со всеми металлами (кроме Рt, Аu и некоторых других), а так же с
неметаллами. При этом она выступает как окислитель, сама
восстанавливается обычно до SO2 ↑. Водород в этом случае не
выделяется, а образуется вода.
Сu + 2Н2SO4 = СuSO4 + SO2↑ + 2Н2O
Концентрированная серная кислота с некоторыми неметаллами:
C + 2H2SO4 + = CO2↑ + 2SO2↑ + 2H2O
2P + 5H2SO4 = 2H3PO4 + 5SO2 ↑
Далее
Назад
Содержание
Выход
46.
Таблица «Свойства серной кислоты»Далее
Назад
Содержание
Выход
47.
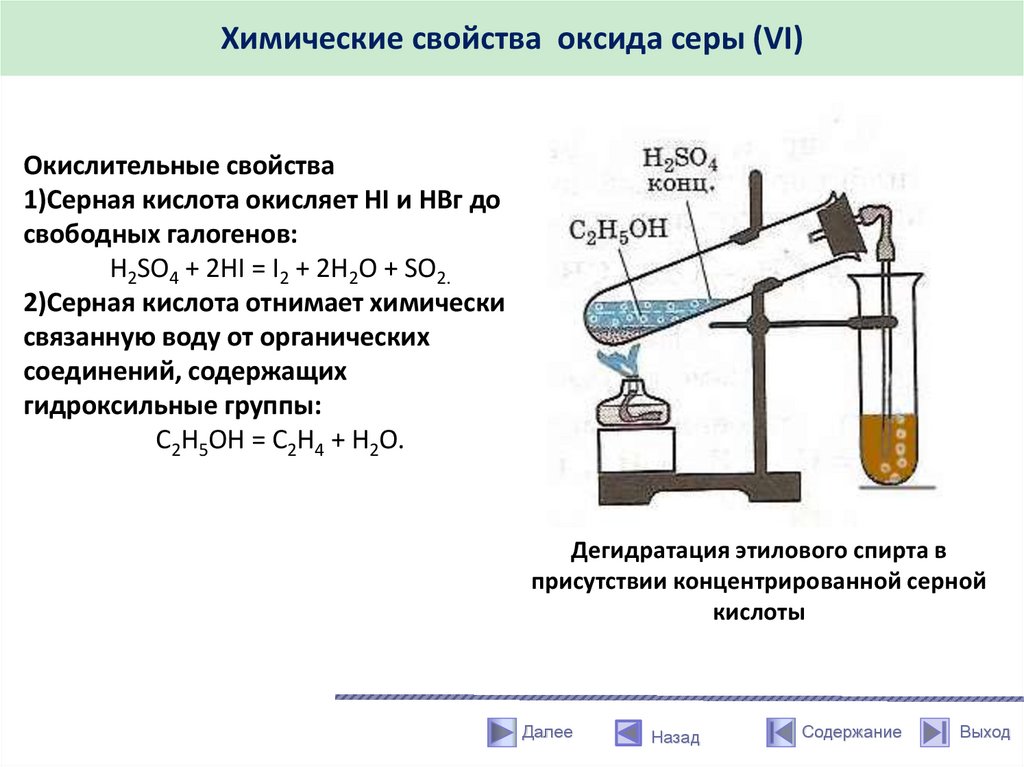
Химические свойства оксида серы (VI)Окислительные свойства
1)Серная кислота окисляет HI и НВг до
свободных галогенов:
H2SO4 + 2HI = I2 + 2H2O + SO2.
2)Серная кислота отнимает химически
связанную воду от органических
соединений, содержащих
гидроксильные группы:
С2Н5ОН = С2Н4 + Н2О.
Дегидратация этилового спирта в
присутствии концентрированной серной
кислоты
Далее
Назад
Содержание
Выход
48.
Химические свойства оксида серы (VI)Окислительные свойства
Обугливание сахара, целлюлозы, крахмала и др. углеводов при контакте с
серной кислотой объясняется также их обезвоживанием:
C6H12O6 + 12H2SO4 = 18H2O + 12SO2↑ + 6CO2↑.
Далее
Назад
Содержание
Выход
49.
Соли серной кислотыСерная кислота, будучи двухосновной, образует два ряда солей: средние,
называемые сульфатами, и кислые, называемые гидросульфатами.
Сульфаты образуются при полной нейтрализации кислоты щелочью (на 1
моль кислоты приходится 2 моля щелочи), а гидросульфаты — при
недостатке щелочи (на 1 моль кислоты — 1 моль щелочи):
Н2SO4 + 2NаOH = Nа2SO4 + 2Н2О
Н2SO4 + NaOH = NаHSO4 + Н2О
.
Далее
Назад
Содержание
Выход
50.
Соли серной кислотыБольшинство солей серной кислоты
растворимо в воде.
Соли СаSO4и РbSO4мало растворимы в
воде, а ВаSO4 практически нерастворима
как в воде, так и в кислотах. Это свойство
позволяет использовать любую
растворимую соль бария, например ВаСl2,
как реагент на серную кислоту и ее соли
(точнее, на ион SO4 2-):
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
NaSO4 + BaCl2 = BaSO4↓ + 2NaCl
При этом выпадает белый нерастворимый
в воде и кислотах осадок сульфата бария.
Далее
Назад
Содержание
Выход
51.
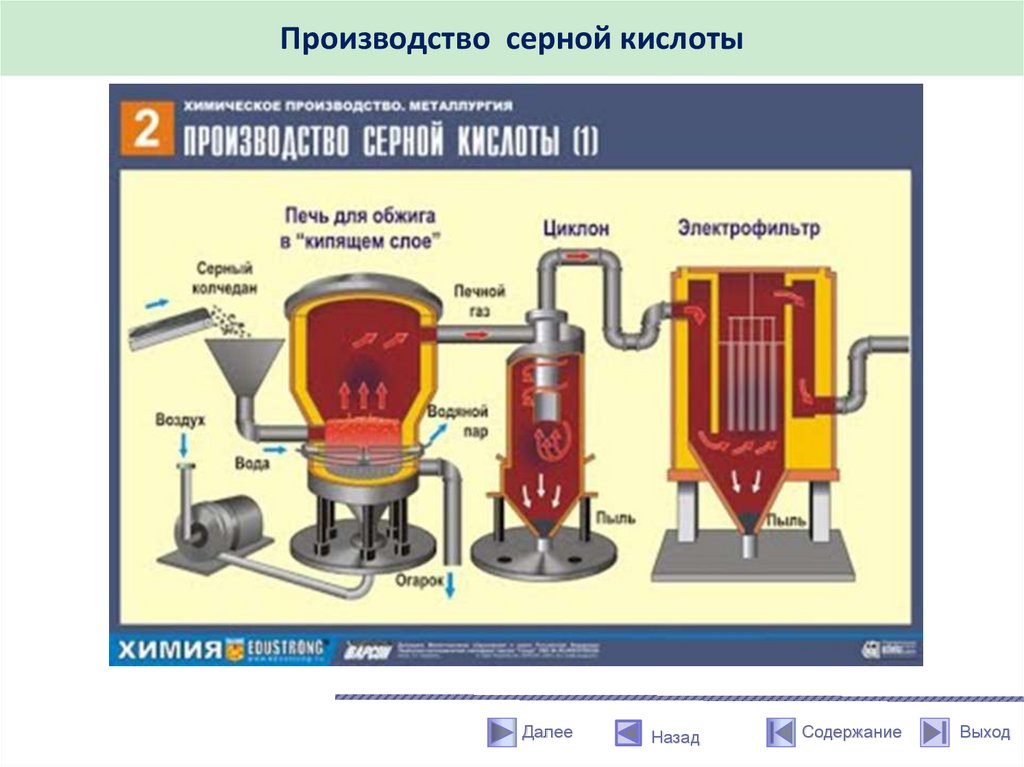
Производство серной кислотыДалее
Назад
Содержание
Выход
52.
Производство серной кислотыПЕРВАЯ СТАДИЯ - обжиг пирита в печи
для обжига в "кипящем слое".
ВТОРАЯ СТАДИЯ – каталитическое
окисление SO2 в SO3 кислородом в
контактном аппарате.
ТРЕТЬЯ СТАДИЯ - поглощение SO3
серной кислотой в поглотительной башне.
Далее
Назад
Содержание
Выход
53.
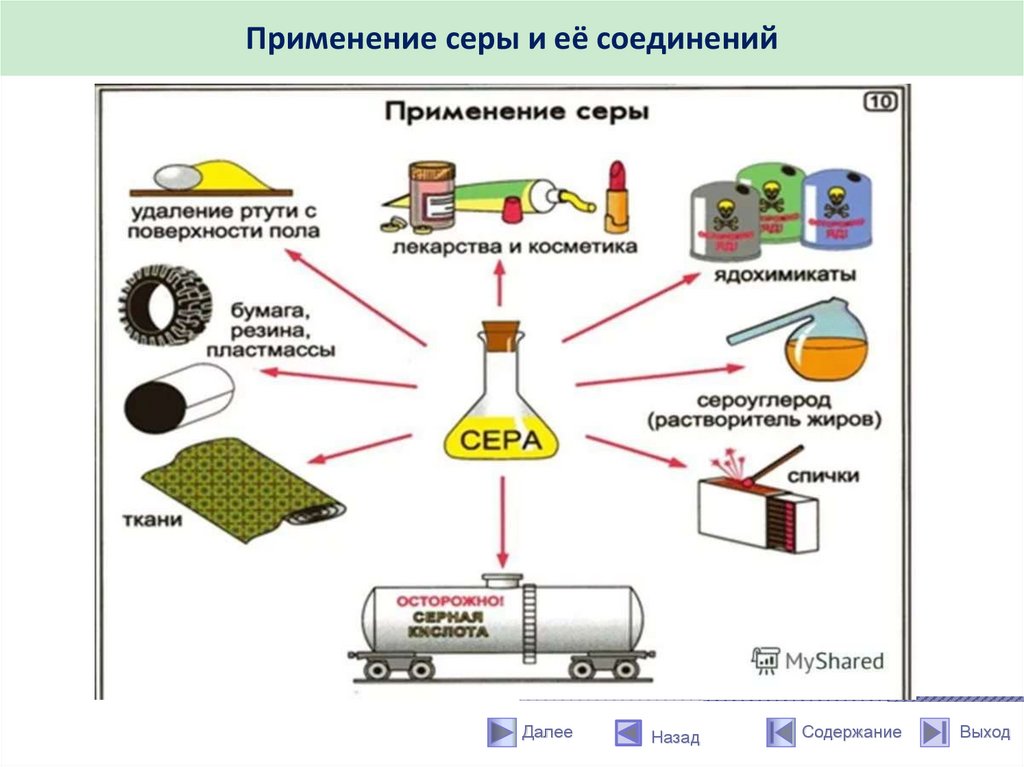
Применение серы и её соединенийСеру используют для производства серной кислоты, изготовления спичек,
черного пороха, бенгальских огней, для борьбы с вредителями сельского
хозяйства и лечения болезней, в производстве красителей, взрывчатых
веществ, люминофоров.
Сероводород идет на производство серы, сульфитов, тиосульфатов и серной
кислоты, в лабораторной практике – для осаждения сульфидов.
Оксид серы (IV) применяется в производстве серной кислоты, сульфитов,
тиосульфатов, для отбеливания шелка, шерсти, как средство для
дезинфекции, для консервирования фруктов и ягод.
Далее
Назад
Содержание
Выход
54.
Применение серы и её соединенийДалее
Назад
Содержание
Выход
55.
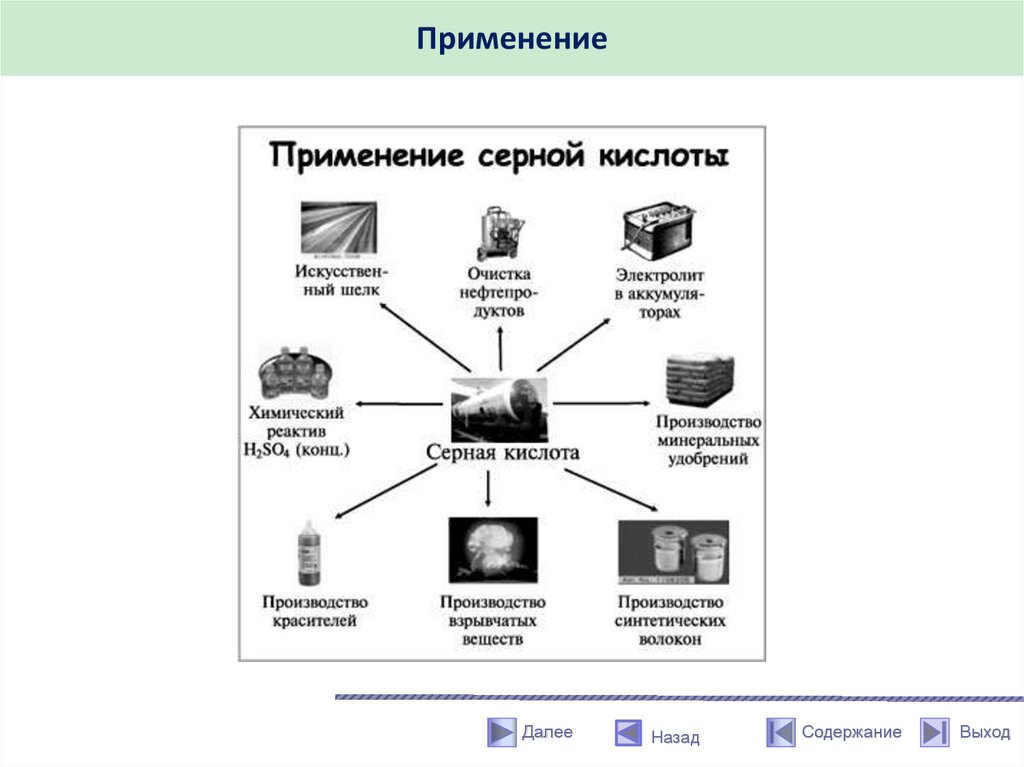
Применение серной кислотыСерная кислота – один из важнейших продуктов основной химической
промышленности. Служит электролитом в свинцовых аккумуляторах.
Применяется в производстве фосфорной, соляной, борной, плавиковой и др.
кислот. Концентрированная серная кислота служит для очистки
нефтепродуктов от сернистых и непредельных органических соединений.
Разбавленная серная кислота применяется для удаления окалины с
проволоки и листов перед лужением и оцинкованием, для травления
металлических поверхностей перед покрытием хромом, никелем, медью и
др. Серная кислота – необходимый компонент нитрующих смесей и
сульфирующее средство при получении многих красителей и лекарственных
веществ. Благодаря высокой гигроскопичности применяется для осушки
газов, для концентрирования азотной кислоты.
Далее
Назад
Содержание
Выход
56.
ПрименениеДалее
Назад
Содержание
Выход
57.
Тиосерная кислота. Тиосульфат натрия.Н2S2O3 – тиосерная кислота
Содержит серу в разных степенях окисления S+4 и S0
Тиосерная кислота неустойчива, уже при комнатной температуре она
распадается.
Значительно устойчивее ее соли- тиосульфаты. Из них наиболее
употребителен тиосульфат натрия Na2S2O3 · 5Н2О.
Далее
Назад
Содержание
Выход
58.
Тиосерная кислота. Тиосульфат натрия.Физические свойства натрия тиосульфата - белое кристаллическое
вещество, хорошо растворяется в воде, на свету разлагается.
Химические свойства
Подвергается гидролизу по аниону
Реагирует с йодом:
2Na2S2O3 + I2 = 2NaI + Na2S4O6 – обесцвечивание иода
С кислотами:
Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3
H2S2O3 → S↓ + SO2↑ + Н2О
Образующаяся тиосерная кислота H2S2O3 неустойчива и разлагается на S,
SO2 и Н2О, при этом наблюдается помутнение раствора за счет
выделившейся серы
Эта реакция является качественной реакцией на тиосульфат – ион S2O324. Проявляет восстановительные свойства:
Na2S2O3+ Br2 + H2O = 2HBr + S + Na2SO4
Далее
Назад
Содержание
Выход
59.
Литература1. Бабков А.В. Химия: учебник для студ. сред. мед. учеб. заведений М.: издательский центр «Академия», 2014.
2. Ерохин Ю.М. Химия для профессий и специальностей технического
и естественно-научного профилей: учебник для студентов
учреждений сред. проф. образования/Ю.М. Ерохин, И.Б. Ковалева.
– 4-е изд., стер. – М.: Издательский центр «Академия», 2017.-496 с.
3. Хомченко, И.Г. Общая химия. / И.Г. Хомченко. - М.: Новая волна,
2014. - 463 c.3.
Далее
Назад
Содержание
Выход














































 Химия
Химия








