Похожие презентации:
Фосфор, его соединения и химические свойства
1.
Фосфор, егосоединения
и химические
свойства
2.
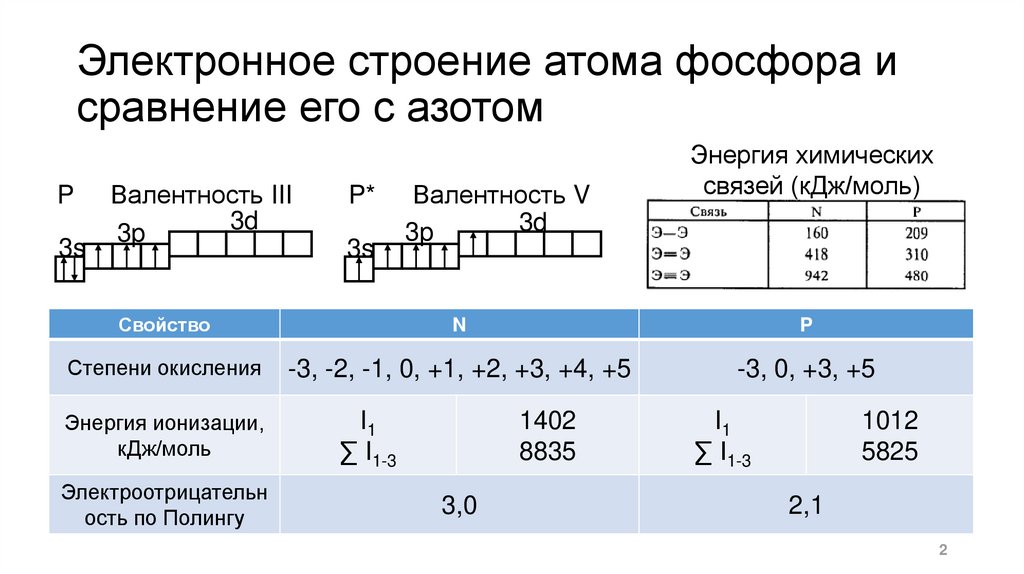
Электронное строение атома фосфора исравнение его с азотом
P
3s
Валентность III
3d
3p
P*
3s
Валентность V
3d
3p
Энергия химических
связей (кДж/моль)
Свойство
N
P
Степени окисления
-3, -2, -1, 0, +1, +2, +3, +4, +5
-3, 0, +3, +5
Энергия ионизации,
кДж/моль
Электроотрицательн
ость по Полингу
I1
∑ I1-3
1402
8835
3,0
I1
∑ I1-3
1012
5825
2,1
2
3.
Природные соединенияИз-за большой химической активности
встречается в природе только в виде соединений.
Важнейшими минералами фосфора являются:
Фосфорит
Апатит
Са3(РО4)2
Са3(РО4)2•СаF2
Са3(РО4)2•СаCl2
3
4.
ПолучениеФридрих Вёлер 1829 год!
Фосфор производят в электрических печах,
восстанавливая апатит углем в присутствии
кремнезема:
2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + 10CO + P4
апатит,
кости
Пары фосфора при этой температуре почти
полностью состоят из молекул Р2, которые при
охлаждении конденсируются в молекулы Р4.
4
5.
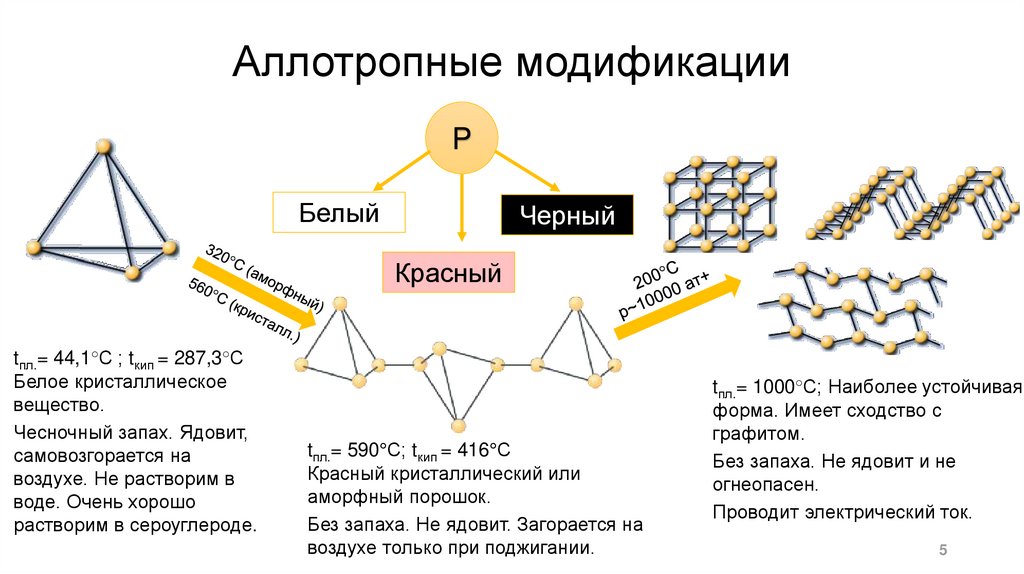
Аллотропные модификацииP
Белый
Черный
Красный
tпл.= 44,1°С ; tкип = 287,3°С
Белое кристаллическое
вещество.
Чесночный запах. Ядовит,
самовозгорается на
воздухе. Не растворим в
воде. Очень хорошо
растворим в сероуглероде.
tпл.= 590°С; tкип = 416°С
Красный кристаллический или
аморфный порошок.
Без запаха. Не ядовит. Загорается на
воздухе только при поджигании.
tпл.= 1000°С; Наиболее устойчивая
форма. Имеет сходство с
графитом.
Без запаха. Не ядовит и не
огнеопасен.
Проводит электрический ток.
5
6.
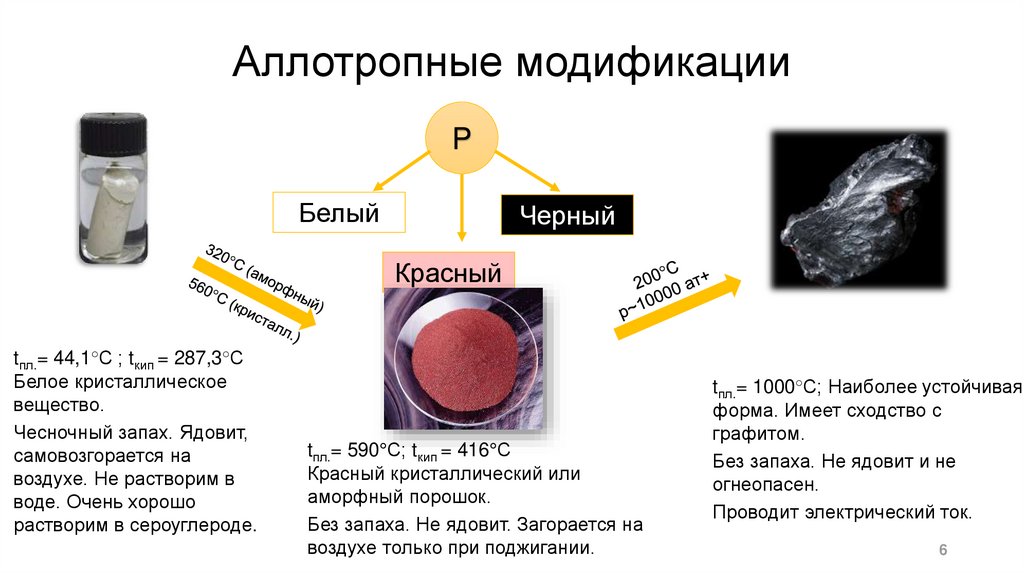
Аллотропные модификацииP
Белый
Черный
Красный
tпл.= 44,1°С ; tкип = 287,3°С
Белое кристаллическое
вещество.
Чесночный запах. Ядовит,
самовозгорается на
воздухе. Не растворим в
воде. Очень хорошо
растворим в сероуглероде.
tпл.= 590°С; tкип = 416°С
Красный кристаллический или
аморфный порошок.
Без запаха. Не ядовит. Загорается на
воздухе только при поджигании.
tпл.= 1000°С; Наиболее устойчивая
форма. Имеет сходство с
графитом.
Без запаха. Не ядовит и не
огнеопасен.
Проводит электрический ток.
6
7.
Химические свойстваВосстановитель с более электроотрицательными неметаллами:
5О2 (изб.) + 4Р = 2Р2О5
3О2 (недост.) + 4Р = 2Р2О3
3Сl2 + 2P = 2PCl3
PСl3 + Cl2 = PCl5
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
Окислитель взаимодействует со многими металлами, образуя фосфиды :
2Р + 3Mg = Mg3P2
7
8.
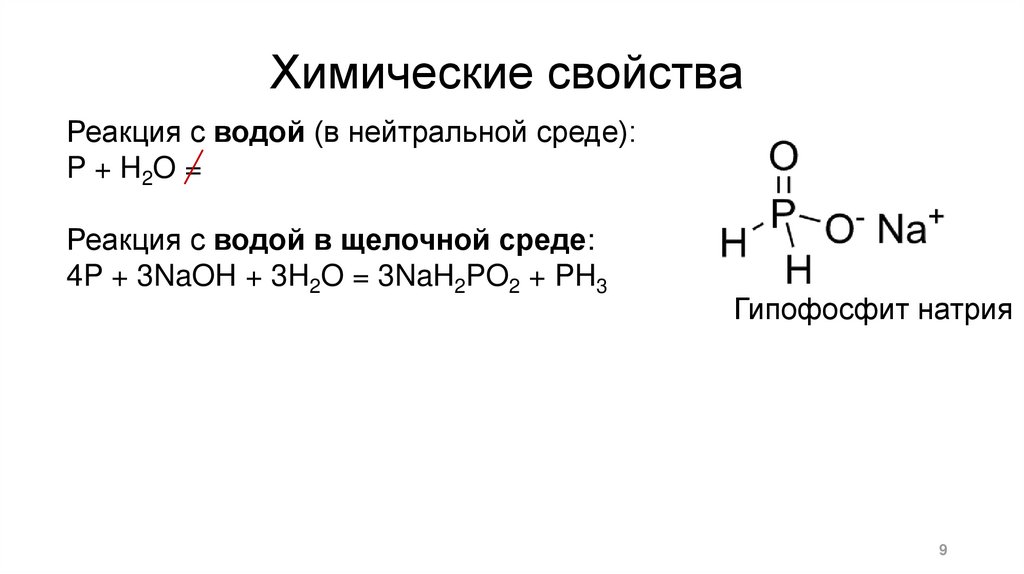
Химические свойстваРеакция с водой (в нейтральной среде):
P + H2 O =
Реакция с водой в щелочной среде:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3
8
9.
Химические свойстваРеакция с водой (в нейтральной среде):
P + H2 O =
Реакция с водой в щелочной среде:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3
Гипофосфит натрия
9
10.
Химические свойстваРеакция с водой (в нейтральной среде):
P + H2 O =
Реакция с водой в щелочной среде:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3
Гипофосфит натрия
Реакция при наличии ионов Ag(I)/Cu(II):
2Р + 5CuSO4 + 8Н2O = 2Н3РO4 + 5Cu + 5H2SO4
Каталитическая реакция красного фосфора с водой:
t, Pt/Cu
2P + 8H2O = 2H3PO4 + 5H2
10
11.
ФосфинФосфор в степени окисления -3 образует водородное
соединение фосфин PH3, аналогичное аммиаку. Эта степень
окисления менее характерна для фосфора, чем для азота.
Фосфин – ядовитый газ с неприятным запахом тухлой рыбы и
чеснока. Он может быть получен из фосфидов обычным
гидролизом или действием кислоты.
Zn3P2 + 6H2O = 3Zn(OH)2 + 2PH3
Zn3P2 + 6HCl = 2PH3 + 3ZnCl2
11
12.
Кислотно-основные свойства фосфинаОсновные свойства фосфина слабее, чем у аммиака:
PH3 + HCl = PH4Cl
Соли фосфония в водных растворах крайне неустойчивы:
PH4+ + H2O PH3 + H3O+
В то же время фосфин является кислотой: активные металлы
замещают в нем один водород, образуя фосфиниды МРН2.
PH3 + M = PH2M + H2 (M = Li,...,Na)
Кислотность фосфина во много раз превосходит кислотность
аммиака, что иллюстрирует реакция взаимодействия двух
гидридов:
NH3 + РН3 = NH4+РН212
13.
Окислительно-восстановительные свойстваФосфин имеет сильные восстановительные свойства
(низшая несвойственная степень окисления фосфора),
самовоспламеняется на воздухе:
РН3 + 2O2 = НРO3 + Н2O
13
14.
1415.
1516.
Окислительно-восстановительные свойстваФосфин имеет сильные восстановительные свойства
(низшая несвойственная степень окисления фосфора),
самовоспламеняется на воздухе:
РН3 + 2O2 = НРO3 + Н2O
в избытке кислорода:
2PH3 + 4O2 P2O5 + 3H2O или PH3 + 2O2 H3PO4
Окисляется очень многими окислителями:
PH3 + 8HNO3(к) → 8NO2↑ + H3PO4 + 4H2O
PH3 + 4Cl2 + 4H2O = H3PO4 + 8HCl
16
17.
Оксид фосфора (III) – P2O3 /P4O6Белый рыхлый кристаллический порошок (tпл = 24 °С, tкип =
174 °С), легко возгоняющийся. Имеет неприятный запах,
ядовит.
P4O6 окисляется кислородом воздуха
P4O6 + 2O2 = P4O10
Реакция сопровождается хемилюминесценцией и является
причиной свечения белого фосфора.
17
18.
Оксид фосфора (III) – P2O3 /P4O6Называют фосфористым ангидридом, так как он
взаимодействует с холодной водой с образованием
фосфористой кислоты:
P4O6 + 6Н2O = 4Н3РO3
При повышенной температуре фосфористая кислота
диспропорционирует на ортофосфорную кислоту и
фосфин:
4Н3РO3 = PH3 + 3H3PO4
18
19.
Оксид фосфора (V) – P2O5 /P4O10Белый порошок, очень гигроскопичен (эффективный
осушитель). Способен отнимать воду от других
соединений.
2HNO3 + P2O5 = 2HPO3 + N2O5
19
20.
Химические свойства P2O5Типичный кислотный оксид - взаимодействует с основаниями и основными
оксидами. Ему соответствует мета- и ортофосфорная кислота.
Реакция с водой:
P2O5 + H2O = 2HPO3 метафосфорная кислота
P2O5 + 3H2O = 2H3PO4 ортофосфорная кислота
Реакция с основными оксидами:
P2O5 + 3К2O = 2К3РО4
С основаниями:
P2O5 + 6NaOH = 2Na3РО4 + 3H2O
Не проявляет окислительных свойств.
20
21.
Ортофосфорная кислотаКристаллическое (tпл = 42 ºС), нелетучее, твердое, бесцветное
вещество.
В промышленности фосфорную кислоту получают действием серной
кислоты на фосфорит:
Ca3(PO4)2 + 3H2SO4 3CaSO4 + 2H3PO4
Альтернативные способы:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
P2O5 + 3H2O = 2H3PO4
Смешивается с водой в любых отношениях.
Типичная кислота неокислитель.
Кислота средней силы.
Не проявляет окислительных свойств.
21
22.
Химические свойстваС металлами, стоящими в ряду напряжения до водорода:
3Mg + 2H3PO4 = Mg3(PO4)2 + 3H2↑
С основными оксидами:
3CaO + 2H3PO4 Сa3(PO4)2 + 3H2O
С основаниями:
H3PO4 + NaOH → NaH2PO4 + H2O
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
H3PO4 + 3NaOH → Na3PO4 + 3H2O
H3PO4 + NH3 → (NH4)2HPO4
22
23.
Химические свойстваС солями более слабых кислот:
2H3PO4 + 3Na2CO3 = 2Na3PO4 + 3H2O + 3CO2↑
При нагревании превращается в пирофосфорную кислоту:
2H3PO4 = H4P2O7 + H2O пирофосфорная кислота
При действии раствора нитрата серебра появляется
желтый осадок:
H3PO4 + 3AgNO3 → Ag3PO4 ↓ + 3HNO3
желтый осадок
Это качественная реакция на фосфорную кислоты и
фосфаты.
23
24.
Соли фосфорной кислотыСредние соли - фосфаты (Na3PO4)
Кислые соли - гидрофосфаты (Na2HPO4)
и дигидрофосфаты (NaH2PO4).
Фосфорная кислота вытесняется более сильными кислотами
из её солей:
Сa3(PO4)2 + 3H2SO4(конц.) = 3CaSO4 + 2H3PO4
24
25.
Применение фосфора• Около 80% от всего производства белого фосфора идет на
синтез чистой ортофосфорной кислоты. Она используется
для получения полифосфатов натрия (их применяют для
снижения жесткости питьевой воды) и пищевых фосфатов.
• Зажигательная поверхность спичечного коробка покрыта
смесью красного фосфора и порошка стекла. В состав
спичечной головки входят окислители (PbO2, KСlO3,
BaCrO4) и восстановители (S, Sb2S3). При трении от
зажигательной поверхности смесь, нанесенная на спичку,
воспламеняется.
26.
Триполифосфат натрия (Е451)26
























 Химия
Химия








