Похожие презентации:
Основные классы неорганических веществ
1.
2.
Задание для студентов на период с 04.02.2022.1. Познакомьтесь с материалом данной
презентации, составьте конспект.
2. Выполните в конспекте задания № 1 -5.
3. Подготовьтесь к устному опросу, для этого
выучите:
- определения всех классов неорганических
соединений и их классификацию;
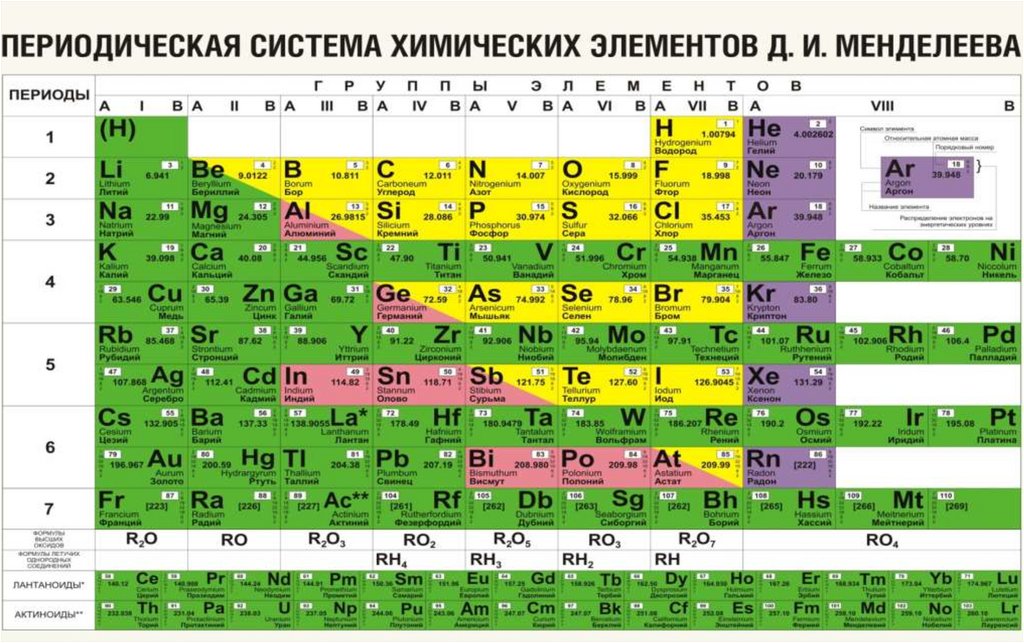
- щелочные и щелочноземельные металлы;
- кислотные остатки;
- названия кислот
3.
Основные классы неорганическихвеществ
• Оксиды;
• Основания;
• Кислоты;
• Соли
4.
оксидыМеталл+ (Ме+) и кислород (О-2)
Неметалл + и кислород (О-2)
Оксиды – это сложные вещества,
состоящие из атомов кислорода и какого либо другого элемента.
Щелочные металлы – Li, Na, K, Rb, Cs, Fr
Щелочноземельные – Са, Sr, Ba, Ra
5.
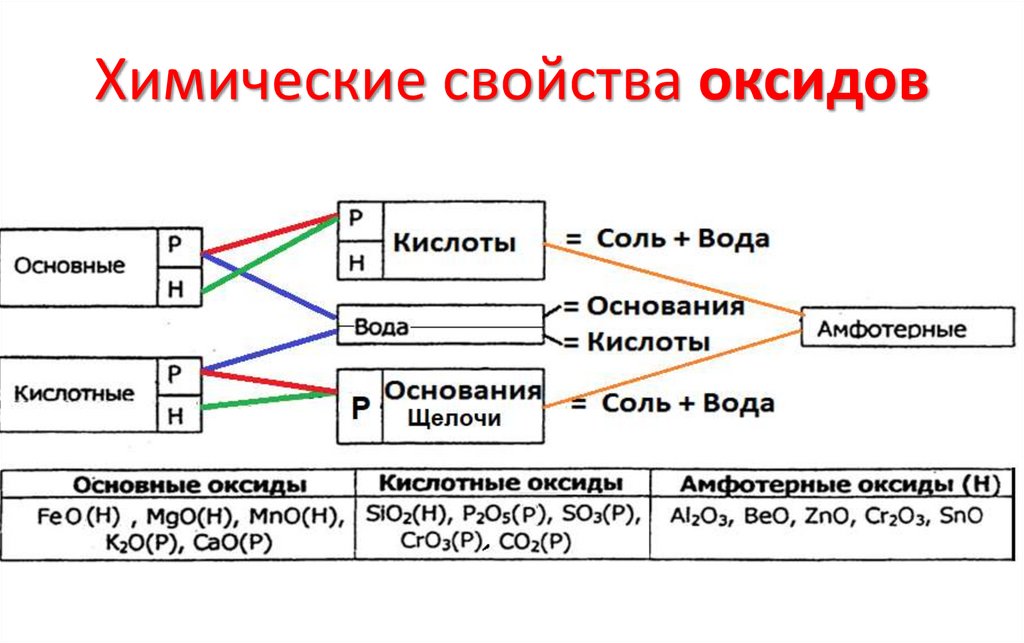
Классификация оксидовОсновные
Ме со СО +1, +2
СaO
Li2O
MgO
K2O
FeO
Кислотные
Амфотерные
(Оксиды
неметаллов)
переходят в состав
кислотных
остатков
(нерастворимые)
Ме со СО (+2),+3 и более
SO3 (VI)
SO2 (IV)
P2O5
Cl2O7
CO
Al2O3
BeO
ZnO
Cr2O3
Mn O
Взаимодействуют с
кислотами и
основаниями
6.
Химические свойства оксидов7.
Задание № 1.Запишите уравнения реакций следующих взаимодействий,
назовите все вещества (вещества подберите сами):
1.
2.
3.
4.
5.
6.
Растворимый основный оксид + кислота =
Нерастворимый основный оксид + кислота =
Растворимый основный оксид + вода =
Растворимый кислотный оксид + основание =
Нерастворимый кислотный оксид + основание =
Растворимый кислотный оксид + вода =
8.
Основание (гидроксиды) - металл+ и ОНРастворимые в воде основания – ЩЕЛОЧИЩелочные металлы – Li, Na, K, Rb, Cs, Fr.
Щелочноземельные – Са, Sr, Ba, Ra
Остальные основания – не растворимы в воде
Основания (гидроксиды) – это сложные
вещества, которые состоят из атомов
металла и одной или нескольких
гидроксогрупп ОН
NaOH, Al(OH)3, LiOH
9.
Химические свойства оснований10.
Задание № 2.Запишите уравнения реакций следующих взаимодействий,
назовите все вещества (вещества подберите сами):
1.
2.
3.
4.
5.
6.
Нерастворимое основание + сильная кислота =
Растворимое основание + кислота =
Растворимое основание + растворимая соль =
Растворимое основание + растворимый кислотный оксид =
Растворимое основание + нерастворимый кислотный оксид =
Нерастворимое основание при нагревании=
11.
КИСЛОТЫКислота – Н+ и кислотный остатокКислоты – это сложные вещества,
содержащие атомы водорода и
кислотный остаток.
Атомы водорода, способны замещаться
на атомы металла, но кислоты не
взаимодействуют с Cu, Hg, Ag, Pt, Au
12.
Названия кислородсодержащих кислот производится отназвания неметалла с прибавлений окончаний – ная или – вая,
если степень окисления его соответствует номеру группы.
По мере понижения степени окисления суффиксы меняются:
- оватая, - истая, - оватистая
HNO3 – азотная, HNO2 – азотистая
HClO4 (+7) – хлорная,
HClO3 (+5) – хлорноватая,
HClO2 (+3) – хлористая,
HClO (+1) – хлорноватистая;
HCl соляная (-1)
H2SO4 (+6) – cерная
H2SO3 (+4) – сернистая
13.
Названия бескислородных кислотпроизводятся от названия неметалла с
окончанием «О» и прибавлением слова
«водородная»
HCl – хлороводородная или соляная кислота
HBr - бромоводородная
HI - йодоводородная
H2S – сероводородная
HF – фтороводородная или плавиковая кислота
14.
Сильные кислоты (ЗАПОМНИТЬ):НCl - соляная
НClO4 - хлорная
НBr - бромоводородная
НI - иодоводородная
Н2SO4 - серная
НNO3 - азотная
15.
кислоты (ЗАПОМНИТЬ):HF – фтороводородная кислота или плавиковая
H2S – сероводородная кислота (очень летучая)
H2SO3 – сернистая кислота (очень слабая)
НNO2 – азотистая кислота
Н3PO4 – фосфорная кислота
Н3PO3 – фосфористая кислота
Н2CO3 – угольная кислота (очень слабая)
Н2SiO3 – кремниевая кислота (не растворимая)
Н2CrO4 - хромовая кислота
Н2MnO4 – марганцовистая кислота
НMnO4 – марганцовая кислота
16.
Химические свойства кислот17.
Задание № 3.Запишите уравнения реакций следующих взаимодействий,
назовите все вещества (вещества подберите сами):
1.
2.
3.
4.
5.
6.
7.
Кислота + растворимое основание =
Кислота + нерастворимое основание =
Кислота + растворимый основный оксид =
Кислота + нерастворимый основный оксид =
Кислота + нерастворимая соль =
Кислота + растворимая соль =
Кислота + металл =
18.
-Кислотные остатки3- (ЗАПОМНИТЬ):
Cl - хлорид
ClO4- - перхлорат
Br - бромид
I - иодид
2SO4 - сульфат
NO3 - нитрат
-
F - фторид
2S - сульфид
SO32 - сульфит
NO2- - нитрит
PO4 - фосфат
(ортофосфат)
3PO3 - фосфит
2CO3 - карбонат
2SiO3 - силикат
2CrO4 - хромат
2Cr2O7 - дихромат
MnO42- - манганат
MnO4- - перманганат
NH4+ - ион аммония
19.
СОЛИСоль – Металл+ и кислотный остатокСоли - это сложные вещества, содержащие атомы
металла и кислотных остатков.
Соли – это продукт полного или частичного
замещения атомов водорода в молекуле кислоты на
атом металла или
продукт полного или частичного замещения
гидроксогрупп в молекуле основания на кислотный
остаток
20.
Классификация солей:Средние (нормальные)
- Кислые H+ (гидро…)
- Основные OH (гидроксо…)
21.
Средние солиПродукты полного замещения атомов водорода в
кислотах металлами, т.е. их молекулы состоят из
атомов металла и кислотного остатка.
H - Cl
H–O
I
C = O
I
H–O
Na – Cl
Na - O
I
C = O
I
Na - O
22.
Кислые солиПродукт неполного замещения атомов
водорода на металл, т.е.в молекулах остался
водород от кислоты (гидро)
H–O
I
S = O
I
H–O
H-O
I
S = O
I
Na – O
NaHSO3
гидросульфит натрия
23.
Кислые солиNa H2PO4 - дигидрофосфат натрия
Na2 H PO4 - гидрофосфат натрия
Ba2+(HCO3)-2 - гидрокарбонат бария
24.
Основные солиПродукт неполного замещения гидроксогрупп оснований
кислотными остатками, т.е. их молекулы содержат
гидроксогруппы.
OH
Cl
Cl
⁄
⁄
⁄
Al - OH
Al - OH
Al - Cl
\
\
\
OH
OH
OH
Гидроксид дигидроксохлорид
алюминия
алюминия
Al(OH)3
Al(OH)2Cl
гидроксохлорид
алюминия
AlOHCl2
25.
Основные соли• Русское название: как • Международное
средние с добавлением название: как средние с
слова «основной»
добавлением приставки
«гидроксo»
Al(OH)2 NO3 – основной
нитрат алюминия
Al(OH)2NO3 –
дигидроксонитрат
алюминия
AlOHSO4 – основной
сернокислый алюминий CrOHSO4 –
гидроксосульфат хрома
26.
Химические свойства солей27.
Задание № 4.Запишите уравнения реакций следующих взаимодействий,
назовите все вещества (вещества подберите сами):
1.
2.
3.
4.
Соль + растворимое основание =
Соль + сильная кислота =
Соль + слабая кислота =
Соль + соль = (обе соли растворимые, но после реакции
одна соль должна быть нерастворимая)
28.
Задание № 51. HSO4, CaO, HCl, Fe(OH)2, Fe(OH), KPO4,
HCO3, Ca(OH), SO, HNO3, KCO3, CuSO4, CuO,
AgNO3, H2S.
Оксиды
Основания
Кислоты
Соли
2. Напишите формулы следующих веществ:
гидроксид железа (III), карбонат натрия,
гидросульфат железа (III), нитрат меди (II),
оксид алюминия, фосфорная кислота, оксид
железа (III), хлорид меди (II), гидрокарбонат
магния, гидроксосульфат меди (II),
дигидроксонитрат алюминия.
29.
3. С какими из указанных веществ будетвзаимодействовать NaOH:
СuO, H2O, H2SO4, CO2, Cu(OH)2, Al(NO3)3
Запишите уравнения возможных реакций.
4. С какими из указанных веществ будет
взаимодействовать HCl:
Ag, FeBr3, CO2, Al, Na2CO3, Cu(OH)2,
AgNO3, CaO, SiO2
Запишите уравнения возможных реакций.
30.
5. Распределите соли по соответствующимграфам, дайте им название.
Al2(SO4)3, AlOHSO4, BaCO3, NaH2PO4, Na2S,
Mg(HS)2, Na2HPO4, Ba(HCO3)2, FeCl3,
Cu(NO3)2, Na3PO4, (CuOH)2CO3, CuCl2,
K2SO3, (MgOH)2SO4, CaOHCl, Al(OH)2NO3
Средние
Кислые
Основные
«гидро»
«гидроксо»
31.
6. Напишите уравнения реакций, назовите всевещества:
CaCl2 + AgNO3 =
K2SO4 + BaCl2 =
7. Закончите схемы уравнений реакций:
фосфат натрия + алюминий =
фосфат калия + гидроксид кальция =
сульфат алюминия + гидроксид натрия =
нитрат бария + серная кислота=
32.
8. Ряд превращений неорганических веществ (образец):1
2
3
4
Cu →CuO →CuSO4 →Cu(OH)2 →CuO
1. Ставим цифры над стрелочками. Это количество реакций ( в нашем случае четыре)
2. Первая реакция. CuO из Cu можно получить по реакции
2Cu + О2 → 2 CuO
3. Вторая реакция. Из CuO получаем CuSO4 по реакции
CuO + Н2SO4 → CuSO4 + Н2О
4.
Третья реакция. CuSO4 можно превратьть в Cu(OH)2 взаимодействием с любой щелочью
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
5. Четвертая реакция. Cu(OH)2 легко переходит при нагревании в CuO
Cu(OH)2 → CuO + Н2О
33.
8. Запишите уравнения реакцийследующих превращений:
Al→Al2O3 →Al2(SO4)3 →Al(OH)3 →Al(NO3)3
Ca → CaO → CaCl2 → Ca(NO3)2 → Ca3(PO4)2 → Ca(H2PO4)2
CuSO4 →Cu(NO3)2 →Pb(NO3)2 →K2PbO2 →Pb(OH)2































 Химия
Химия








