Похожие презентации:
Оксиды и основания
1.
2.
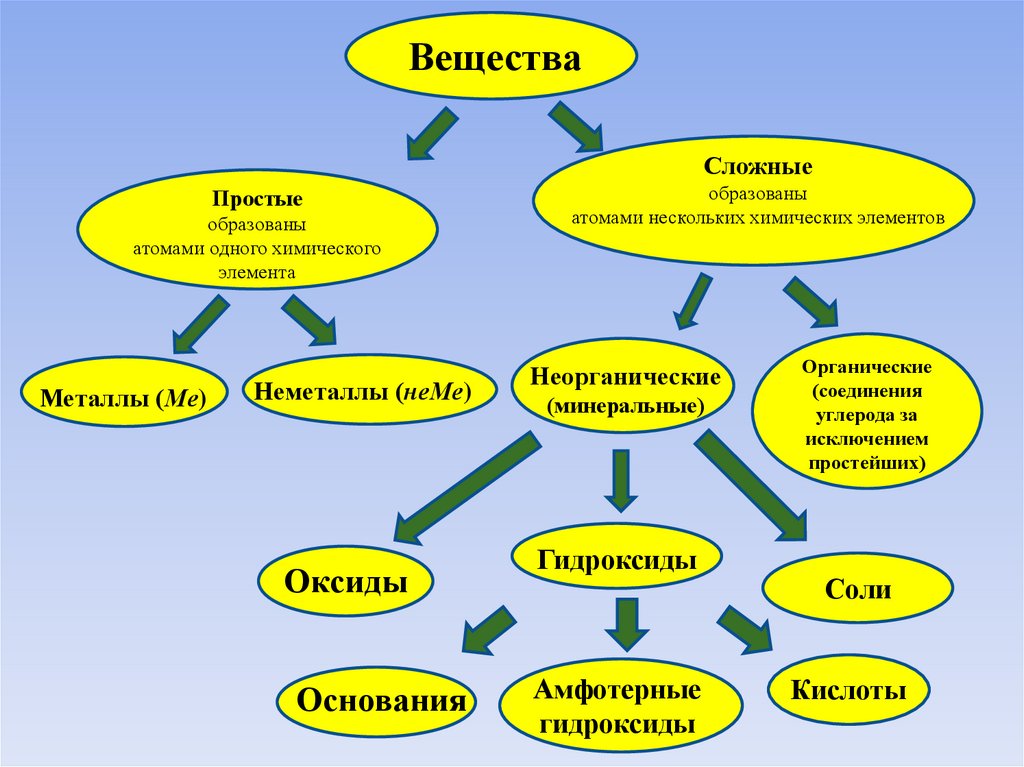
ВеществаСложные
Простые
образованы
атомами одного химического
элемента
Металлы (Ме)
Неметаллы (неМе)
Оксиды
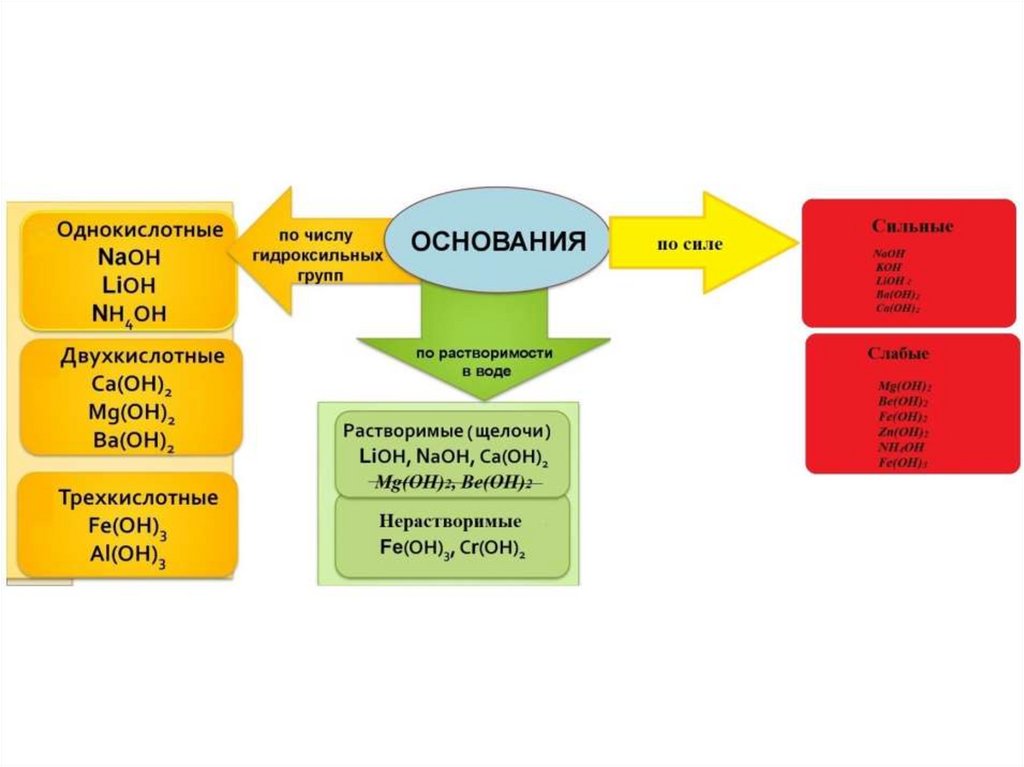
Основания
образованы
атомами нескольких химических элементов
Неорганические
(минеральные)
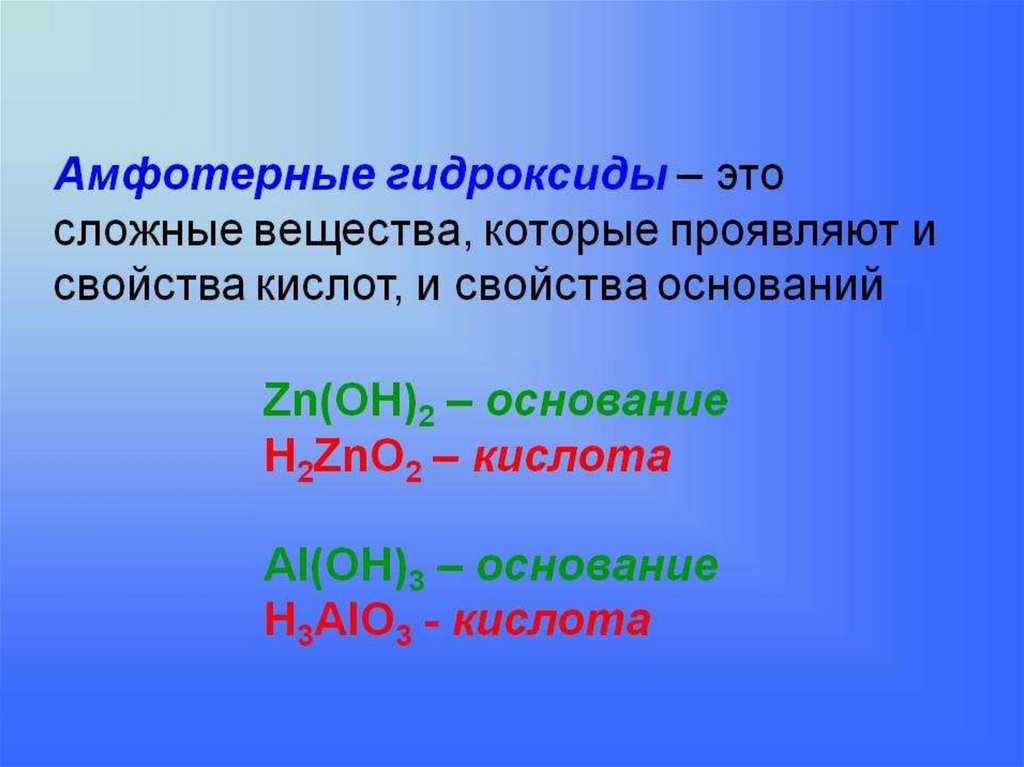
Гидроксиды
Амфотерные
гидроксиды
Органические
(соединения
углерода за
исключением
простейших)
Соли
Кислоты
3.
4.
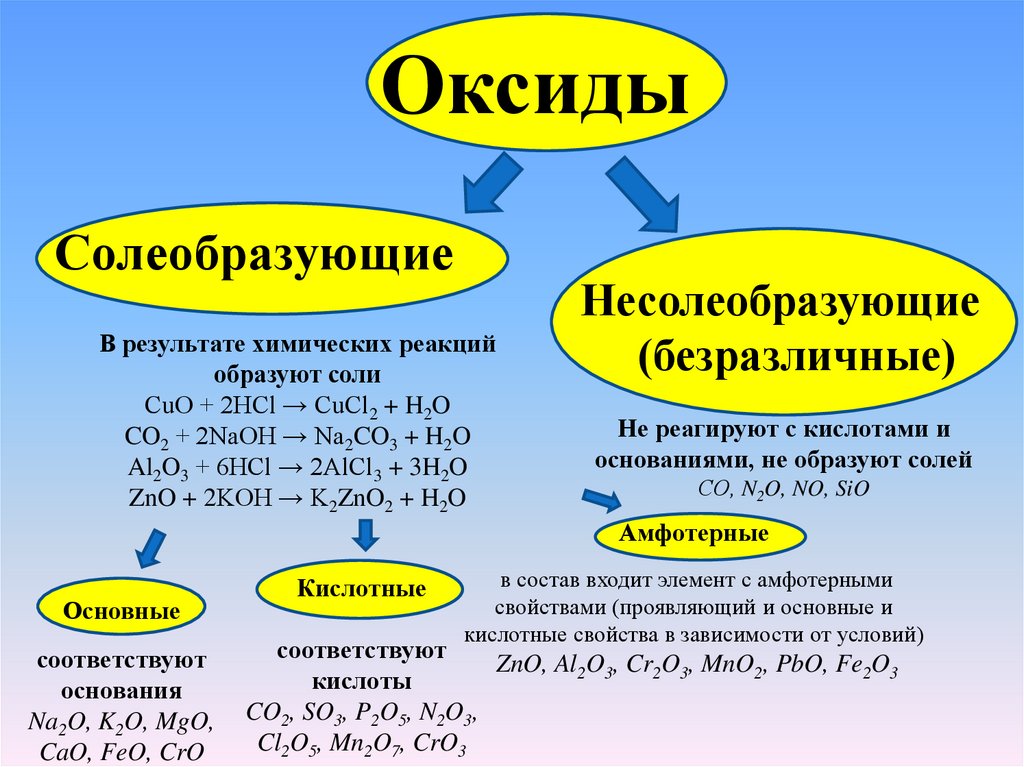
ОксидыСолеобразующие
В результате химических реакций
образуют соли
CuO + 2HCl → CuCl2 + H2O
CO2 + 2NaOH → Na2CO3 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
ZnO + 2KOH → K2ZnO2 + H2O
Несолеобразующие
(безразличные)
Не реагируют с кислотами и
основаниями, не образуют солей
СО, N2O, NO, SiO
Амфотерные
Основные
соответствуют
основания
Na2O, K2O, MgO,
CaO, FeO, CrO
Кислотные
в состав входит элемент с амфотерными
свойствами (проявляющий и основные и
кислотные свойства в зависимости от условий)
соответствуют
ZnO, Al2O3, Cr2O3, MnO2, PbO, Fe2O3
кислоты
CO2, SO3, P2O5, N2O3,
Cl2O5, Mn2O7, CrO3
5.
6.
7.
8.
9.
10.
11.
Физические свойства оснований:Щёлочи - твёрдые белые кристаллические вещества (за
исключением NH4OH - прозрачная жидкость), хорошо
растворимые в воде. Растворение, как правило, сопровождается
выделением тепла. Водные растворы щелочей мылкие на ощупь,
едкие. Разъедают кожу, ткань.
Нерастворимые основания - твёрдые вещества, имеющие
разнообразную окраску






 Химия
Химия