Похожие презентации:
Естественные семейства химических элементов
1.
Естественные семействахимических элементов.
Амфотерность.
Химия, 8 класс
2.
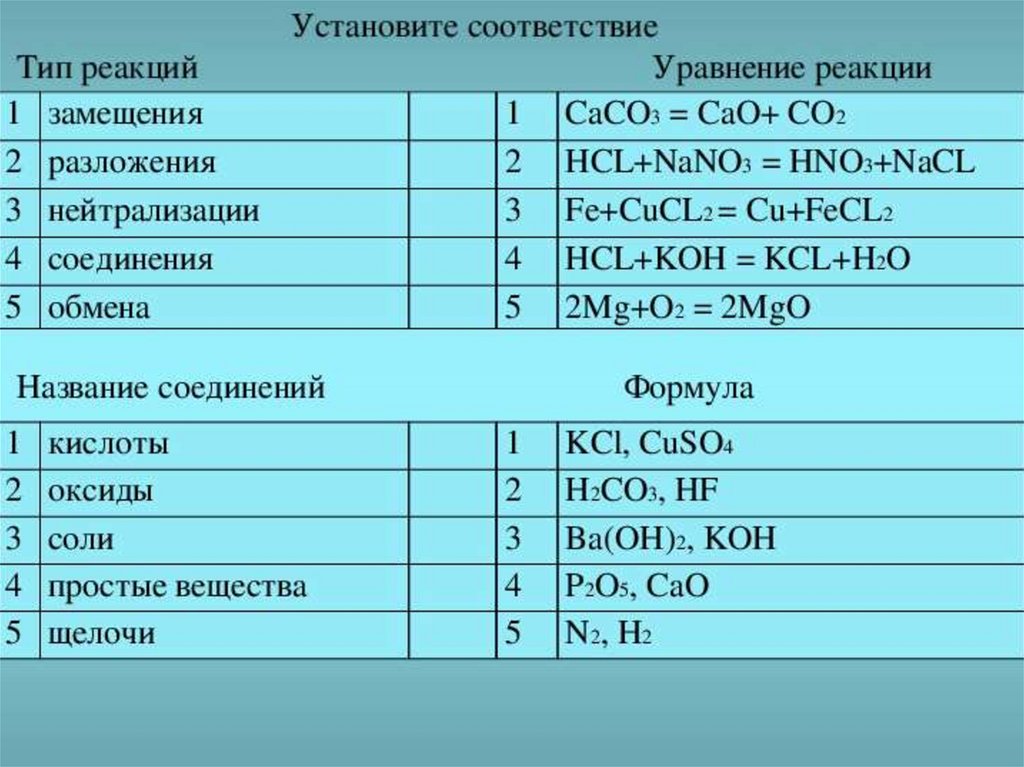
Вспомним• Откройте
периодическую
систему
Д.И.Менделеева. Что вы по ней можете
сказать?
• Охарактеризуйте с ее помощью элемент
под №20, №25
3.
Размышления• На протяжении курса мы познакомились с
элементами разных семейств: щелочные и
щелочноземельные металлы, галогены и
инертные газы. Как вы думаете, что
объединяет элементы в семейства?
4.
Определение• Естественные семейства – элементы, особенно близкие
по свойствам их простых веществ.
• Естественные семейства делятся на:
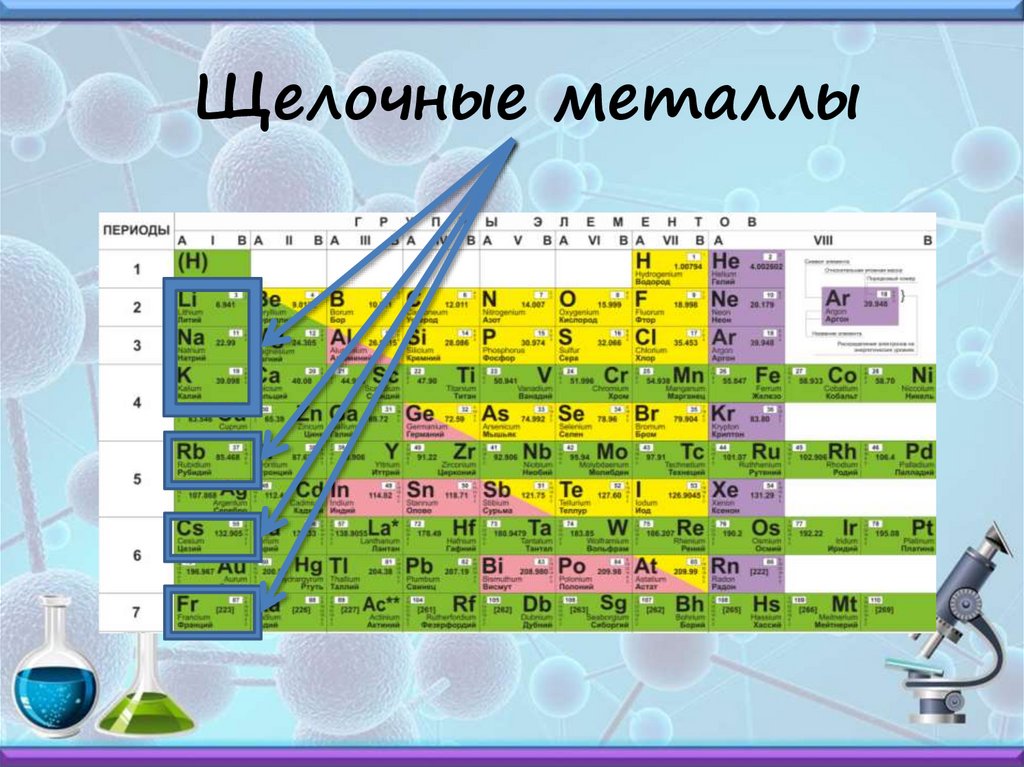
IА группа – щелочные металлы (кроме водорода)
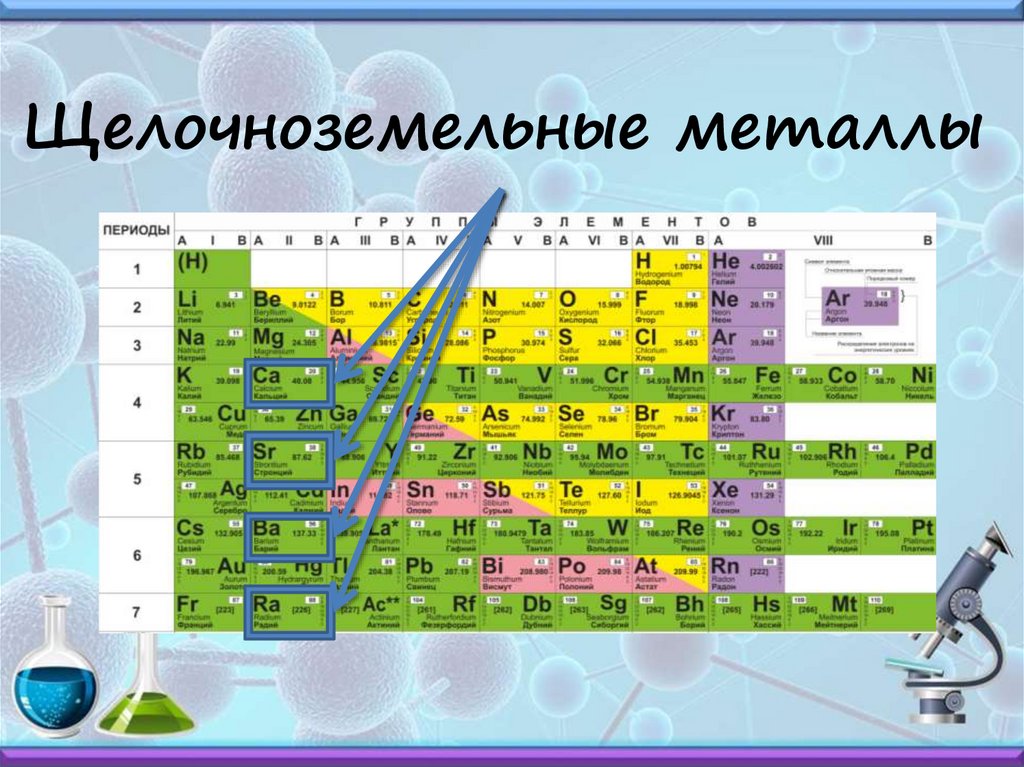
IIА группа – щелочноземельные металлы (кроме
бериллия, магния)
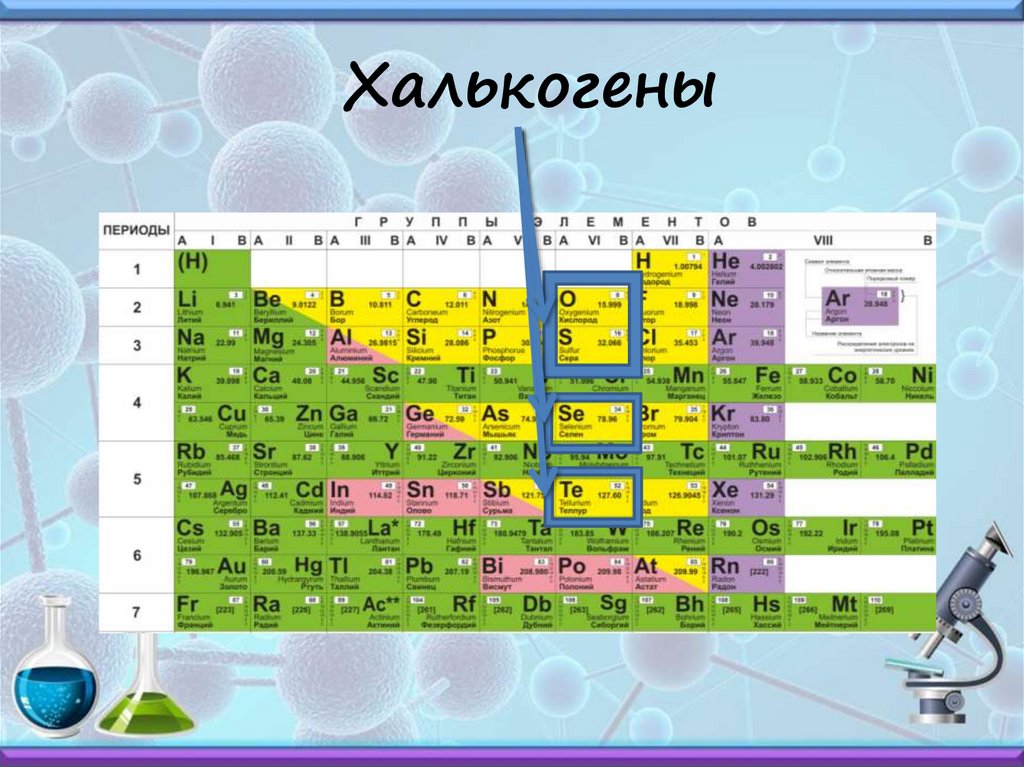
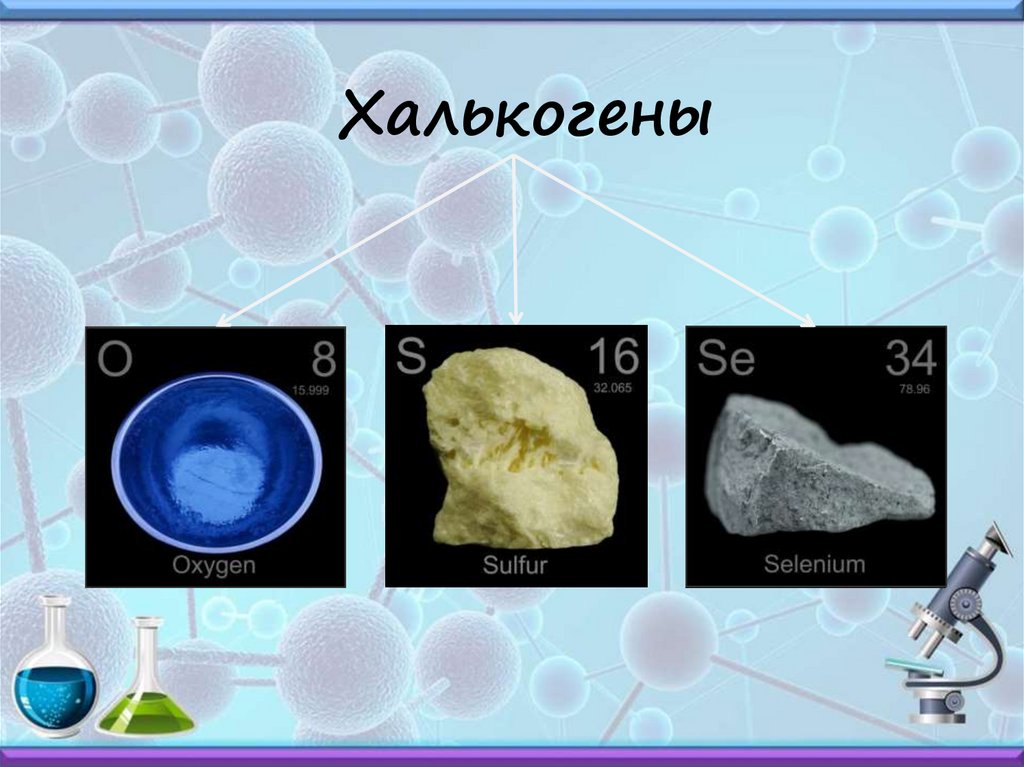
VIА группа – халькогены
VIIA группа – галогены
VIIIA группа – благородные газы
5.
Щелочные металлы6.
Щелочные металлы7.
Физические свойства:1. Мягкие (легко режутся ножом).
2. Легкие.
3. Пластичные.
4. Легкоплавкие.
5. Хорошо проводят электрический ток.
6. Обладают металлическим блеском.
8.
Химические свойства:1. Реагируют с водой
2K +2Н2О = 2КОН + Н2
Ме2О реагируют с водой
основной оксид
К2О + Н2О = 2КОН
2. Реагируют с кислородом
(образуются пероксиды,
исключение литий)
2Li + O2 = Li2O
2Na + O2 = Na2 O2
3. Реагируют с хлором
2Na + CL2 = 2NaCl
4. Реагируют с серой
2К + S = K2S
9.
Щелочноземельные металлы10.
Щелочноземельныеметаллы
11.
Физические свойства:1. Имеют различные оттенки
2. Легкие.
3. Более твердые, чем щелочные
12.
Химические свойства:1. Реагируют с водой
Ca +2Н2О = Ca(ОН)2 + Н2
2. Реагируют с кислородом
2Ca + O2 = 2 CaO
3.Реагируют с хлором
Ca + Cl2 = CaCl2
4. Реагируют с серой
МеО – основной оксид
Ca+ S = CaS
реагирует с водой
СаО + Н2О = Са(ОН)2
13.
Халькогены14.
Халькогены15.
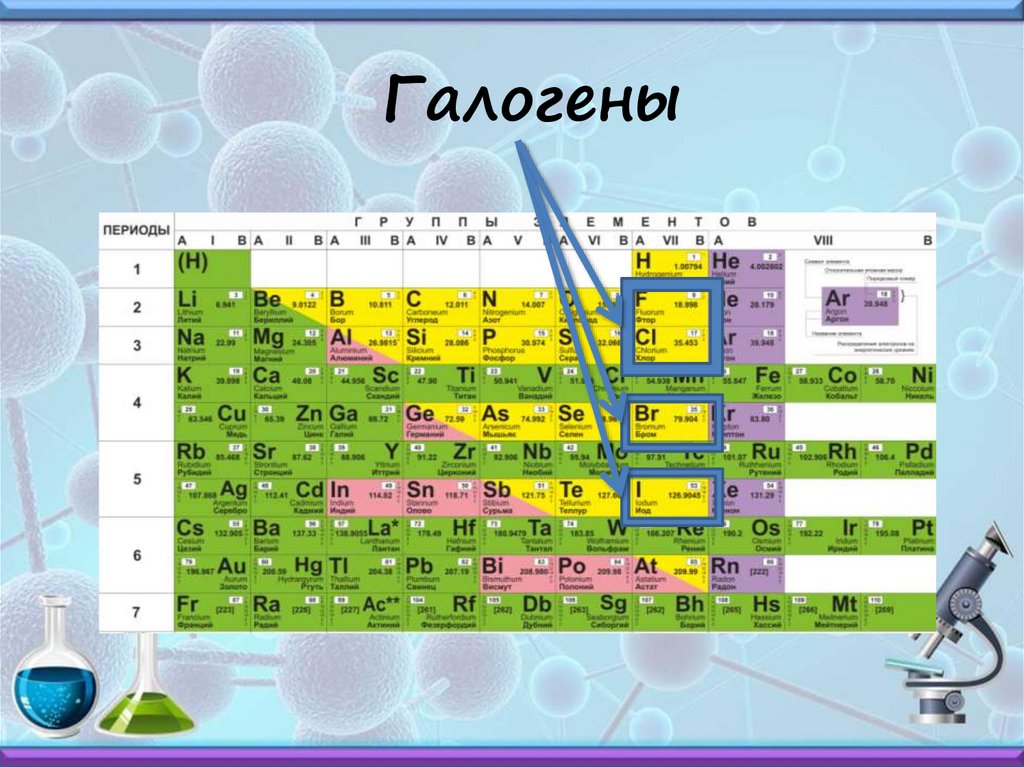
Галогены16.
Галогены17.
Физические свойства:F2 – желтоватый газ
Cl2 – желто-зеленый газ
Br2 - коричнево-бурая жидкость
I2 – темно-серые с характерным блеском,
пары фиолетового цвета
18.
Химические свойства:1. Реагируют с металлами
2Al + 3Br2 = 2AlBr3
2. Реагируют с водородом.
H2 + F2 = 2HF фтороводород
hv
H2 + Cl2 = 2HCl хлороводород
t
H2 + Br2 = 2HBr бромоводород
t
H2 + I2 = 2HI йодоводород
Водные растворы галогеноводородов – кислоты
19.
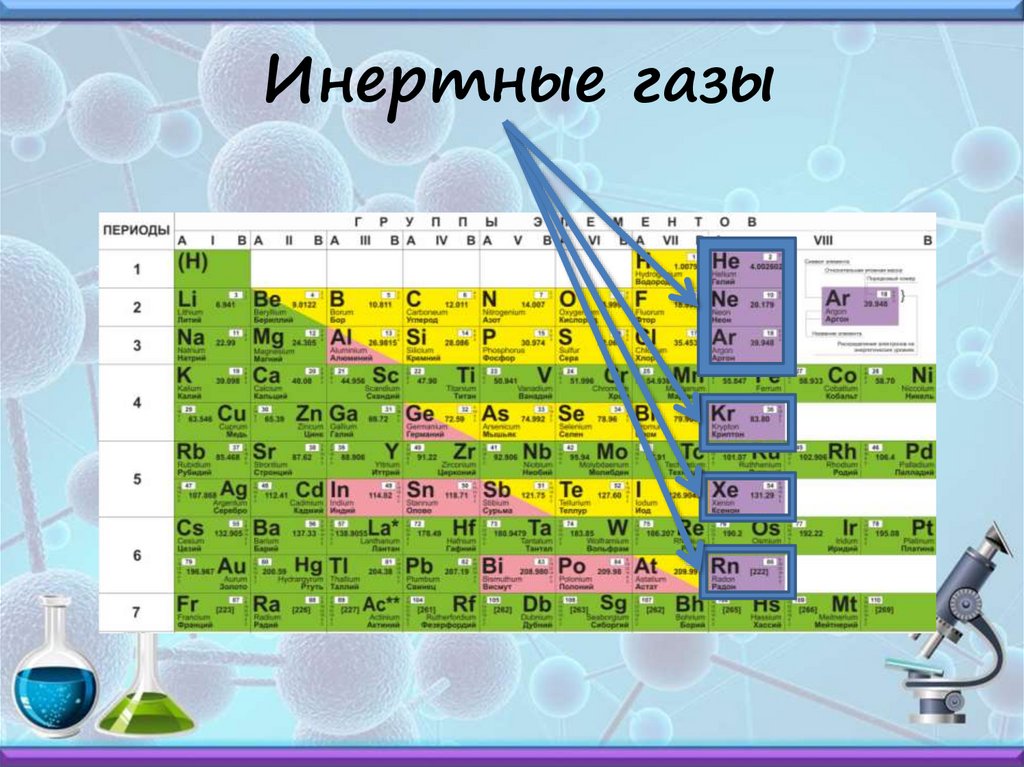
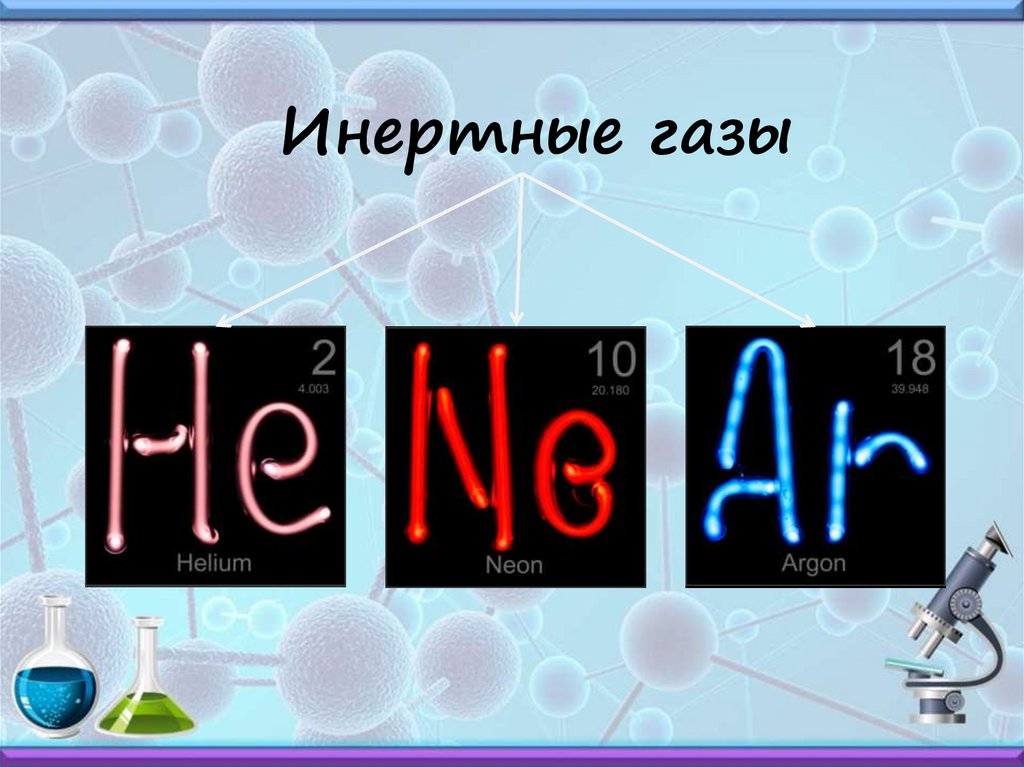
Инертные газы20.
Инертные газы21.
Первые попыткиклассификации
химических элементов
Металлы
(основные
оксиды
и основания)
Неметаллы
(кислотные
оксиды
и кислоты)
Барон Йёнс
Якоб Берце́лиус
(1779-1848)
22.
Первые попыткиклассификации
химических элементов
Металлы
(основные
оксиды
и основания)
Неметаллы
(кислотные
оксиды
и кислоты)
Переходные
элементы
Барон Йёнс
Якоб Берце́лиус
(1779-1848)
23.
Амфотерность– это свойство веществ проявлять кислотные
или основные свойства в зависимости от
природы второго реагента, принимающего
участие в реакции
24.
Аналогично ведет себяи оксид алюминия:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
25.
Амфотерные свойства проявляют:Be
Zn
BeO
ZnO
Be(OH)2
Zn(OH)2
Cr
Pb
Sn
Fe
Cr2O3
PbO
SnO
Fe2O3
Cr(OH)3
Pb(OH)2
Sn(OH)2
Fe(OH)3
26.
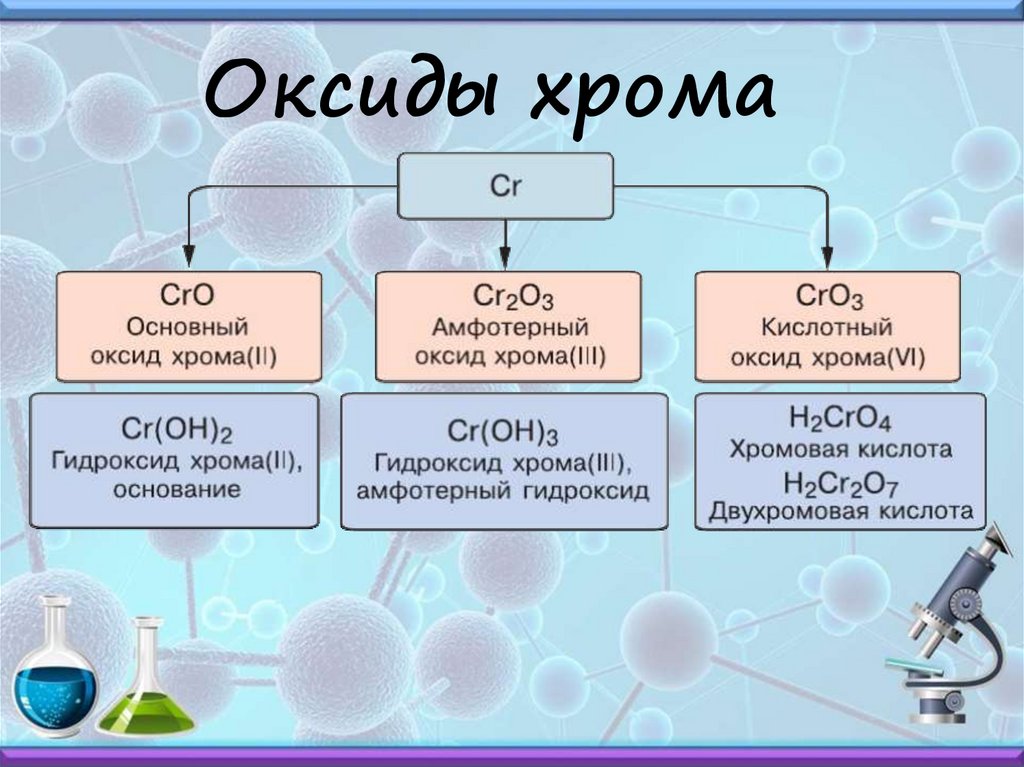
Оксиды хрома27.
Все амфотерные гидроксидынерастворимы в воде:
ZnCl2 + 2KOH = Zn(OH)2↓ + 2KCl
BeSO4 + 2NaOH = Be(OH)2 + Na2SO4
28.
При нагревании амфотерныегидроксиды разлагаются:
t
Zn(OH)2 = ZnO + H2O
29.
Домашнее задание• Параграф 28 - учить.
• Карточка заданий























 Химия
Химия








