Похожие презентации:
Радиоактивные превращения атомных ядер
1.
12.
- Радиоактивность – способность атомныхядер самопроизвольно превращаться в другие
ядра с испусканием частиц.
«Радио» - излучаю;
«Активус» - действенный.
- Радиоактивность - самопроизвольное
излучение веществом альфа-, бетта- и гаммалучей
3.
1896г - открыл явлениерадиоактивности
(способность атомов
некоторых химических
элементов к
самопроизвольному
излучению)
4.
• Пьер Кюри• Было известно, что
магнитное поле
отклоняет только
заряженные
летящие частицы,
причем
положительные и
отрицательные в
разные стороны.
5.
Природа радиоактивногоизлучения
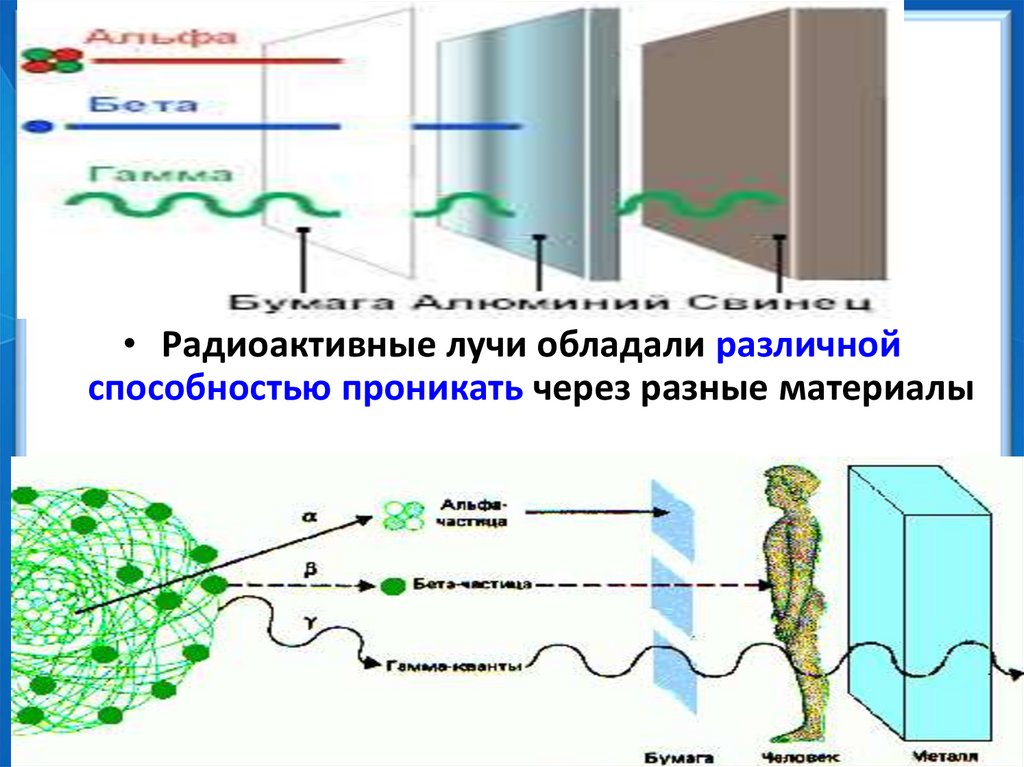
β-лучи - поток электронов – отрицательно
заряженные частицы.
a-лучи
заряжены положительно, - это
атомы гелия, они имеют значительно
бóльшую массу, чем β-частицы.
третий вид лучей - гаммалучи, не отклоняющиеся в самых
сильных магнитных полях,
представляет собой
электромагнитное излучение.
6.
a - частица – ионизированные ядраатома гелия.
Масса - 6,644656⋅10 −27 кгa - лучи
обладают наименьшей проникающей
способностью. Слой бумаги толщиной около
0,1 мм для них уже не прозрачен. Слабо
отклоняются в магнитном поле. У a - частицы
на каждый из двух элементарных зарядов
приходится две атомные единицы массы.
7.
b - частицы поток электронов –отрицательно заряженные частицы,
движущиеся со скоростями, близкими к
скорости света. Они сильно отклоняются как в
магнитном, так и в электрическом поле. b –
лучи гораздо меньше поглощаются при
прохождении через вещество. Алюминиевая
пластинка полностью их задерживает при
толщине в несколько миллиметров.
8.
А в 1900 году Вилларом была открыта еще однасоставляющая, гамма-лучи ( ).
- лучи представляют собой
электромагнитные волны. По своим
свойствам сильно напоминают
рентгеновские, но только их
проникающая способность гораздо
больше. Не отклоняются магнитным
полем. Проходят сквозь метровый
бетонный слой или слой свинца
толщиной в 1 см. Их интенсивность
убывает лишь вдвое.
9. Применение Гамма-излучения
1. В технике, например для обнаружения дефектов вметаллических деталях – гамма-дефектоскопия.
2. В радиационной химии для инициирования химических
превращений, например процессов полимеризации.
3. В пищевой промышленности для стерилизации продуктов
питания.
4. Гамма-излучение может вызывать лучевое поражение
организма, вплоть до его гибели.
5. Используется в медицине для лечения опухолей, для
стерилизации помещений, аппаратуры и лекарственных
препаратов.
6. Применяют также для получения мутаций с последующим
отбором хозяйственно-полезных форм. Так выводят
высокопродуктивные сорта микроорганизмов (например,
для получения антибиотиков ) и растений.
10.
Радиоактивность являлась привилегией самыхтяжелых
элементов
периодической
системы
Д.И.Менделеева. Среди элементов, содержащихся в земной
коре, радиоактивными являются все,
с порядковыми
номерами более 83, т. е. расположенные в таблице
Менделеева после висмута.
11.
• Радиоактивные лучи обладали различнойспособностью проникать через разные материалы
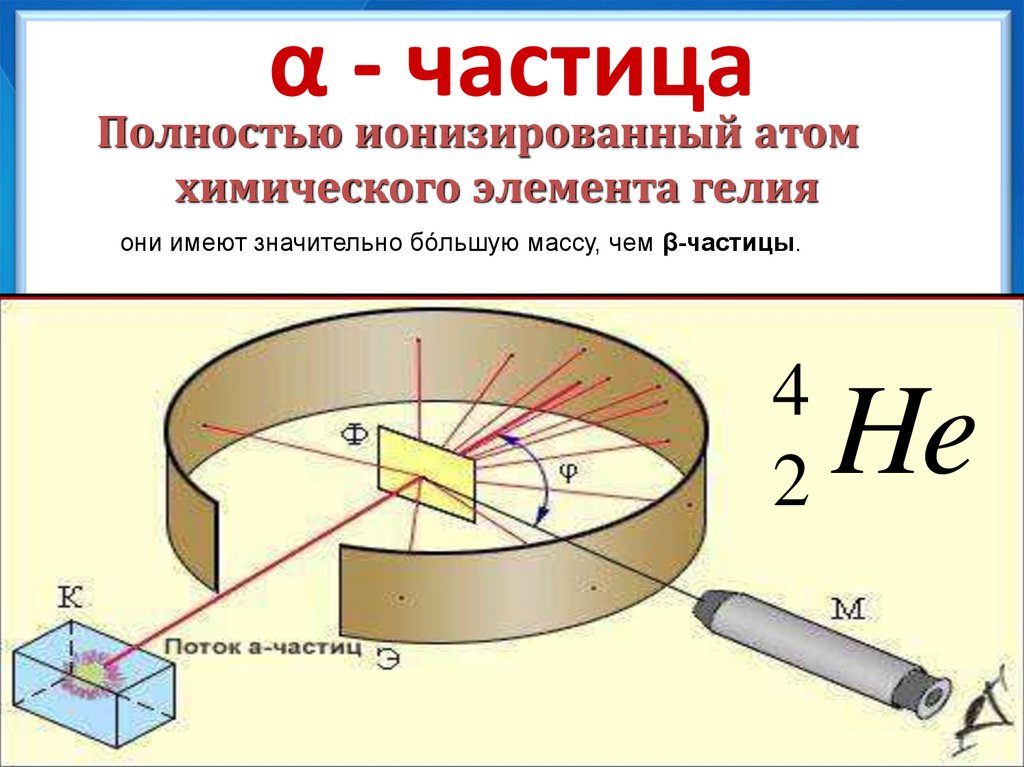
12. α - частица
Полностью ионизированный атомхимического элемента гелия
они имеют значительно бóльшую массу, чем β-частицы.
4
2
He
13. Рассеяние α-частицы в атоме Томсона (a) и в атоме Резерфорда (b).
Рассеяние α-частицыв атоме Томсона (a) и
в атоме Резерфорда (b).
14. Модель атома Томсона
15. Планетарная (ядерная) модель атома
Атом – шар, по всему объёмукоторого равномерно
распределён положительный
заряд.
Внутри шара находятся
электроны.
Каждый электрон может
совершать колебательные
движения около своего
положения равновесия.
Положительный заряд шара
равен по модулю суммарному
заряду электронов, поэтому
заряд атома в целом равен
нулю.
Планетарная (ядерная)
модель атома
Атом
–
микрочастица, состоящая из
положительно заряженного
ядра и окружающих его
электронов. Размеры атома
определяются размерами
его электронной оболочки и
составляют примерно 10–
10
м.
Масса
атома
определяется в основном
массой
его
ядра
и
возрастает
пропорционально
количеству нуклонов в нем.
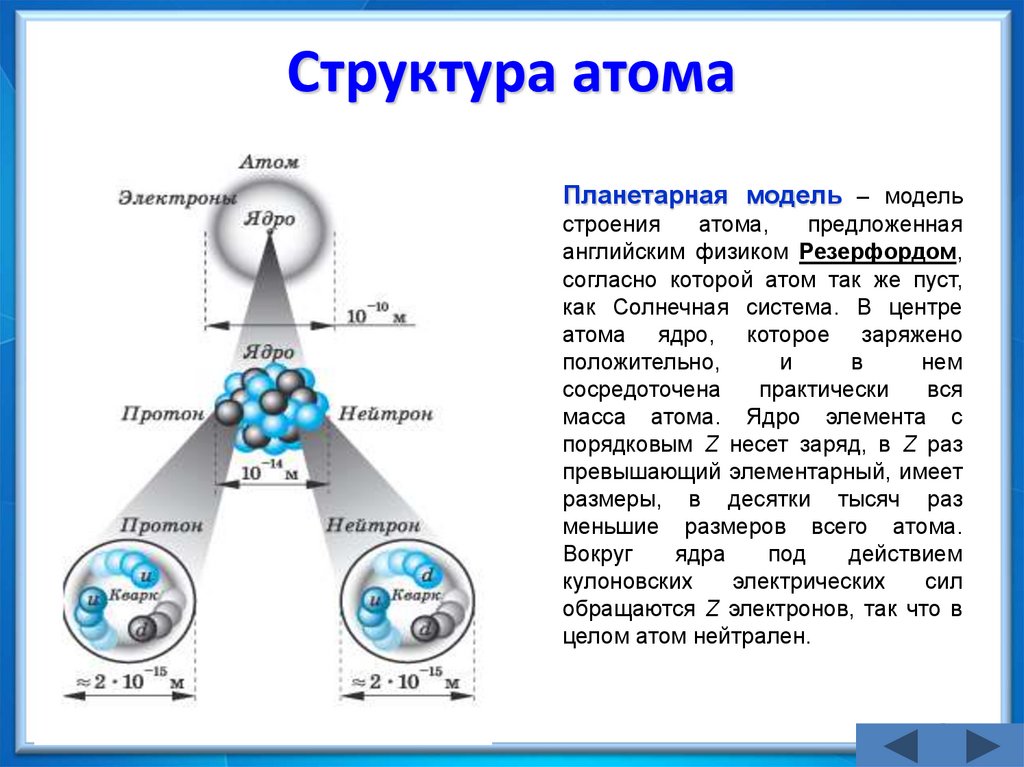
16. Структура атома
Планетарная модель – модельстроения
атома,
предложенная
английским физиком Резерфордом,
согласно которой атом так же пуст,
как Солнечная система. В центре
атома ядро, которое заряжено
положительно,
и
в
нем
сосредоточена
практически
вся
масса атома. Ядро элемента с
порядковым Z несет заряд, в Z раз
превышающий элементарный, имеет
размеры, в десятки тысяч раз
меньшие размеров всего атома.
Вокруг
ядра
под
действием
кулоновских
электрических
сил
обращаются Z электронов, так что в
целом атом нейтрален.
17. Противоречие модели Томсона с экспериментом:
• 1. Так как масса электронов мала, они не могутзаметно изменить траекторию движения альфачастиц.
• 2. Заметное рассеивание альфа-частиц может
вызвать только положительная часть атома и
лишь в том случае, если она сконцентрирована в
очень малом объёме.
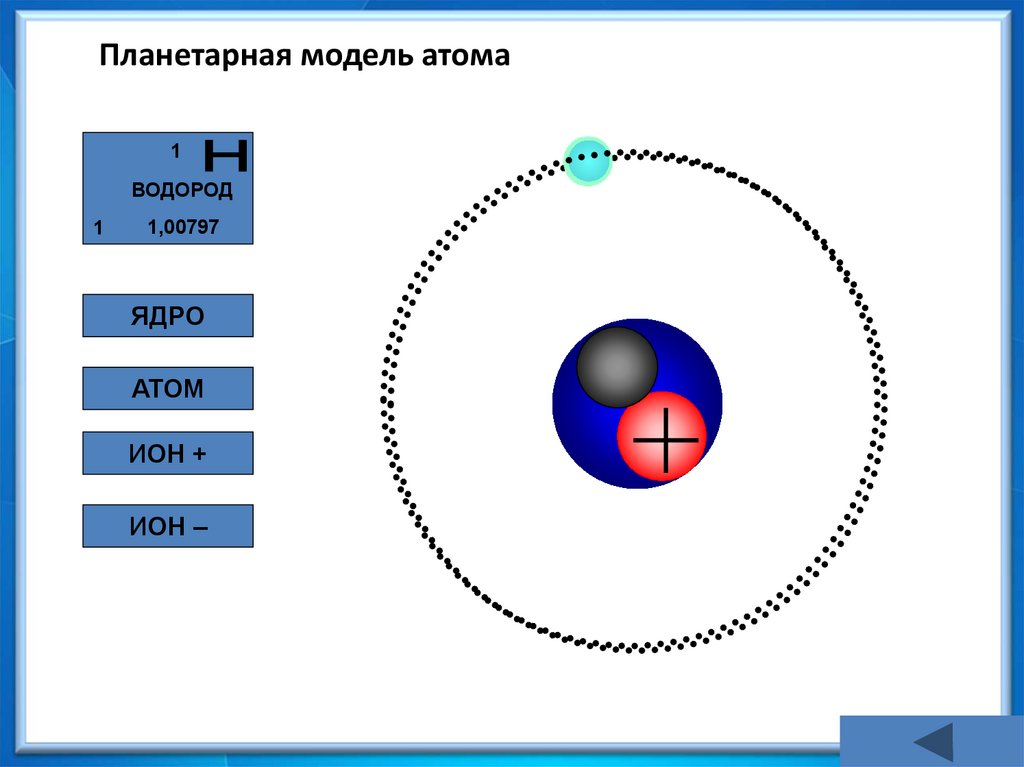
18. Планетарная модель атома
1ВОДОРОД
1
1,00797
ЯДРО
АТОМ
ИОН +
ИОН –
19. Планетарная модель атома
31
2
ЛИТИЙ
6,939
ЯДРО
АТОМ
ИОН +
ИОН –
20. Что происходит с веществом при радиоактивном излучении?
Необычные факты:• Радиоактивное
излучение постоянно
на протяжении
большого интервала
времени.
• Радиоактивное
излучение
сопровождается
выделением энергии.
Гипотеза: при радиоактивном
излучении превращения
претерпевают сами атомы.
21.
Открытие радиоактивных превращенийатомных ядер
Фредерик Содди
1877 - 1956
Эрнест Резерфорд
1871–1937
В 1903 г. обнаружили, что радий
превращается в радон в
результате альфа-распада.
Изменяются ядра атомов.
21
22.
Обозначение ядер химическихэлементов
X химический символ элемента
Зарядовое
число
- Массовое число
А
Z
X
- Зарядовое число
- Номер химического элемента
- Заряд ядра в элементарных
электрических зарядах
Массовое
число
226
88
Ra
22
23.
Обозначение ядер химических элементови частиц
Примеры:
Частицы:
222
86
4
2
Rn
He
0
1
e электрон
1
1
р протон
1
0
n нейтрон
23
24.
Правила смещенияА) Альфа – распад: зарядовое число (порядковый
номер) элемента уменьшается на две единицы, а
массовое число – на четыре единицы
А
Z
X
226
88
А 4
Z 2
Y He
4
2
Ra Rn He
222
86
4
2
А
Z
X исходный
радиоактив ный элемент
Y химический элемент,
А- 4
Z -2
получивший ся в результате
a - распада
239
94
Pu U He
235
92
4
2
24
25.
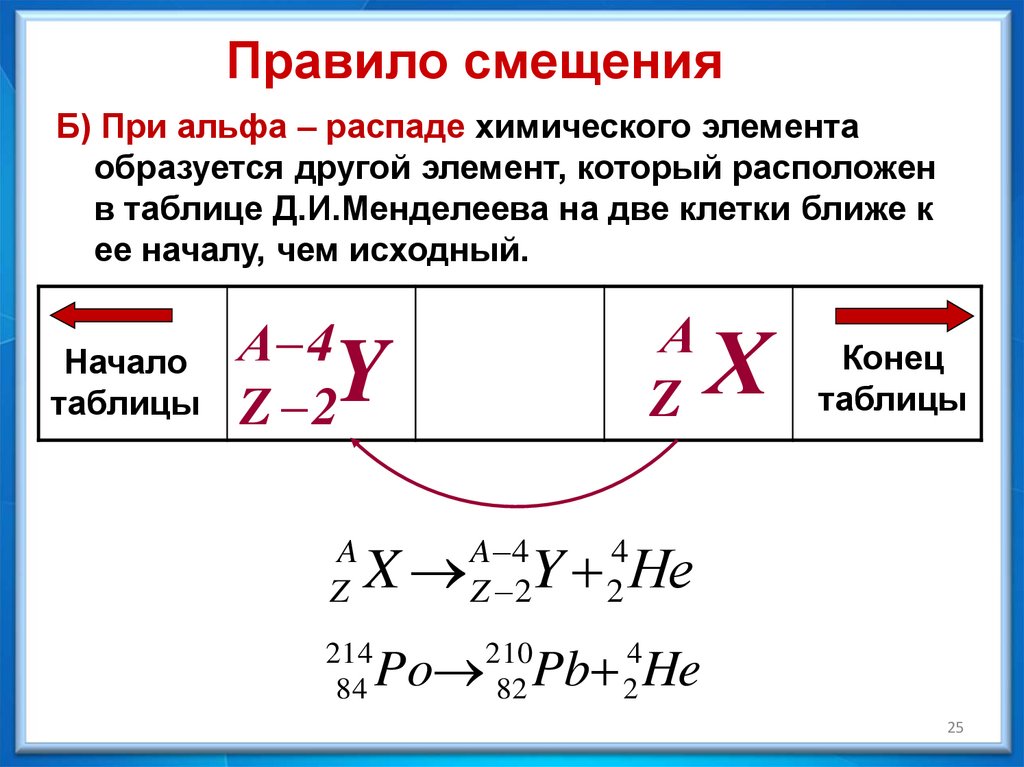
Правило смещенияБ) При альфа – распаде химического элемента
образуется другой элемент, который расположен
в таблице Д.И.Менделеева на две клетки ближе к
ее началу, чем исходный.
Начало
таблицы
А
Z
А 4
Z 2
Y
A
Z
X
214
84
A 4
Z 2
Х
Конец
таблицы
Y Не
4
2
Po Pb He
210
82
4
2
25
26.
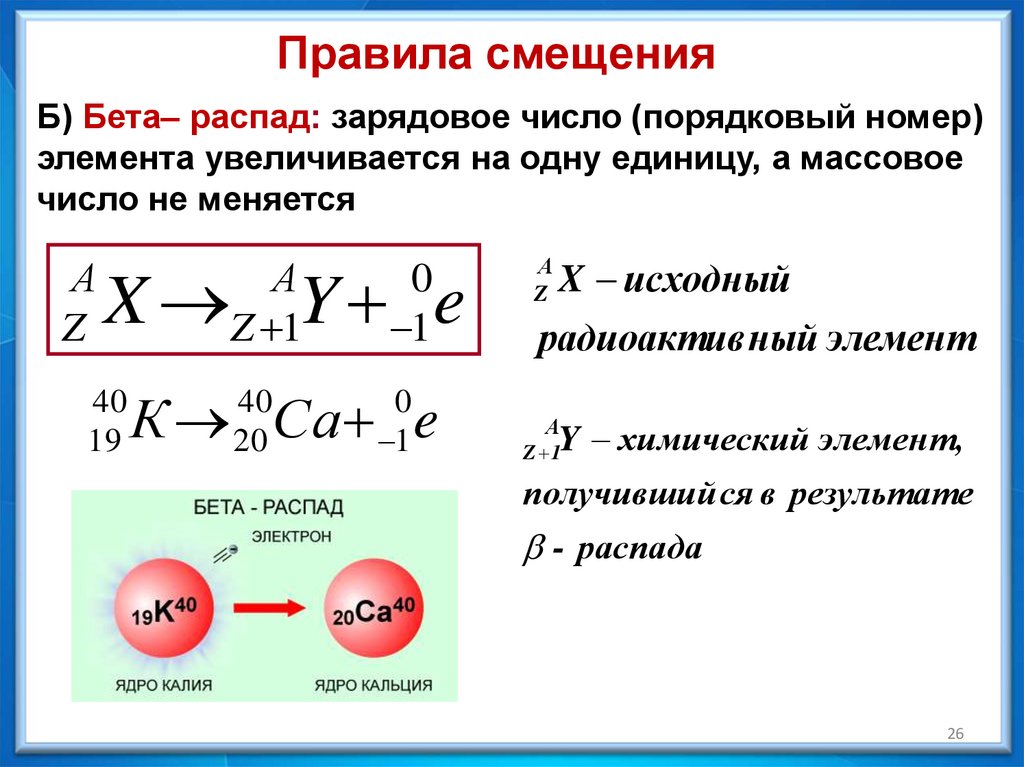
Правила смещенияБ) Бета– распад: зарядовое число (порядковый номер)
элемента увеличивается на одну единицу, а массовое
число не меняется
А
Z
X Y e
40
19
А
Z 1
0
1
К Са e
40
20
0
1
А
Z
X исходный
радиоактив ный элемент
Y химический элемент,
А
Z 1
получивший ся в результате
- распада
26
27. Правило смещения
Б) При бета – распаде одного химического элементаобразуется другой элемент, который расположен в
таблице Д.И.Менделеева в следующей клетке за
исходным (т.е. на одну клетку ближе к концу таблицы).
А
Z
Начало
таблицы
A
z
А
Z 1
Х
Y
Конец
таблицы
~
X Y e
239
93
A
z 1
0
1
0
0
Np Pu e ~
239
94
0
1
0
0
27
28.
Законы сохранения массового числа изаряда при радиоактивных превращениях
226
88
40
19
Ra Rn He
222
86
4
2
К Са e
40
20
0
1
28
29.
Упражнения6. Сколько альфа- и бета-распадов
происходит в результате превращения
радия-226 в свинец-206?
226
88
Ra
Серебристoбелый металл
Решение :
206
82
Рв
226 206
Na
5
4
6 2 5 N
Cеребристо-серый
металл
N 10 6 4
Ответ : Na 5, N 4
29























 Физика
Физика








