Похожие презентации:
Окислительно-восстановительные реакции. Урок 15
1.
Окислительновосстановительныереакции
2.
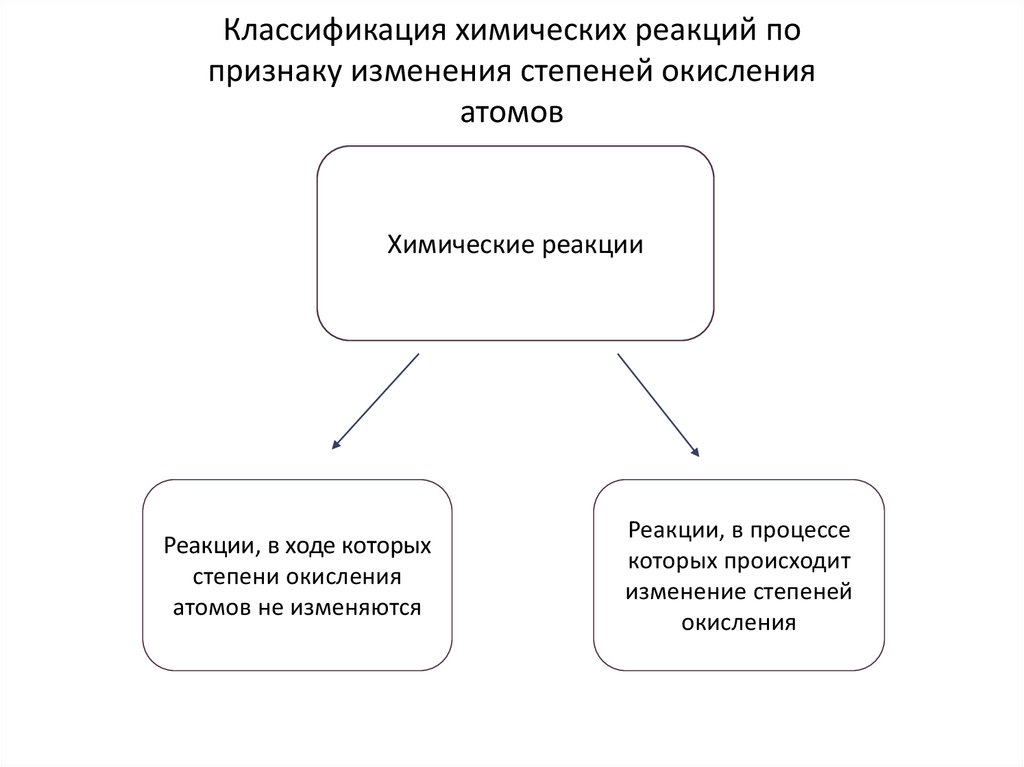
Классификация химических реакций попризнаку изменения степеней окисления
атомов
Химические реакции
Реакции, в ходе которых
степени окисления
атомов не изменяются
Реакции, в процессе
которых происходит
изменение степеней
окисления
3.
-30
+1
+2
+3
+4
+5
NH3 N2 N2O NO HNO2 NO2 HNO3
Степень окисления — это условный заряд атомов химического
элемента в соединении, если предположить, что вещество
состоит только из простых ионов.
4.
Правила расчета степеней окисления:степень окисления кислорода в соединениях -2
(исключения, O-2F2, а также пероксиды, в которых
степень окисления кислорода -1);
степень окисления водорода в соединениях +1
(исключения, гидриды, в которых степень окисления
водорода -1);
металлы в соединениях всегда имеют положительную
степень окисления, при чем максимальная, как
правило, равна номеру группы;
степень окисления в простых веществах и свободных
атомах всегда равна нулю;
в соединении сумма всех степеней окисления атомов
элементов равна нулю.
5.
+53e-
+2
N+
→N
+2
+3
Fe + 1e- → Fe
Восстановление — процесс присоединения электронов
атомами, ионами или молекулами. Степень окисления при
этом понижается.
0
+2
Mg – 2е- → Mg
Окисление — процесс отдачи электронов атомами,
ионами или молекулами. Степень окисления при этом
всегда повышается.
6.
Восстановители — атомы, ионы или молекулы, отдающиеэлектроны.
Основные восстановители: активные металлы, водород, уголь,
оксид углерода (II) (CO), сероводород (H2S), аммиак (NH3).
Окислители — атомы, ионы или молекулы, принимающие
электроны.
Основные окислители: кислород, галогены, азотная и
серная кислоты, перманганат калия (KMnO4) и т.д.
7.
e–0
0
A
+
A
-
+
B
B
A*
+
B*
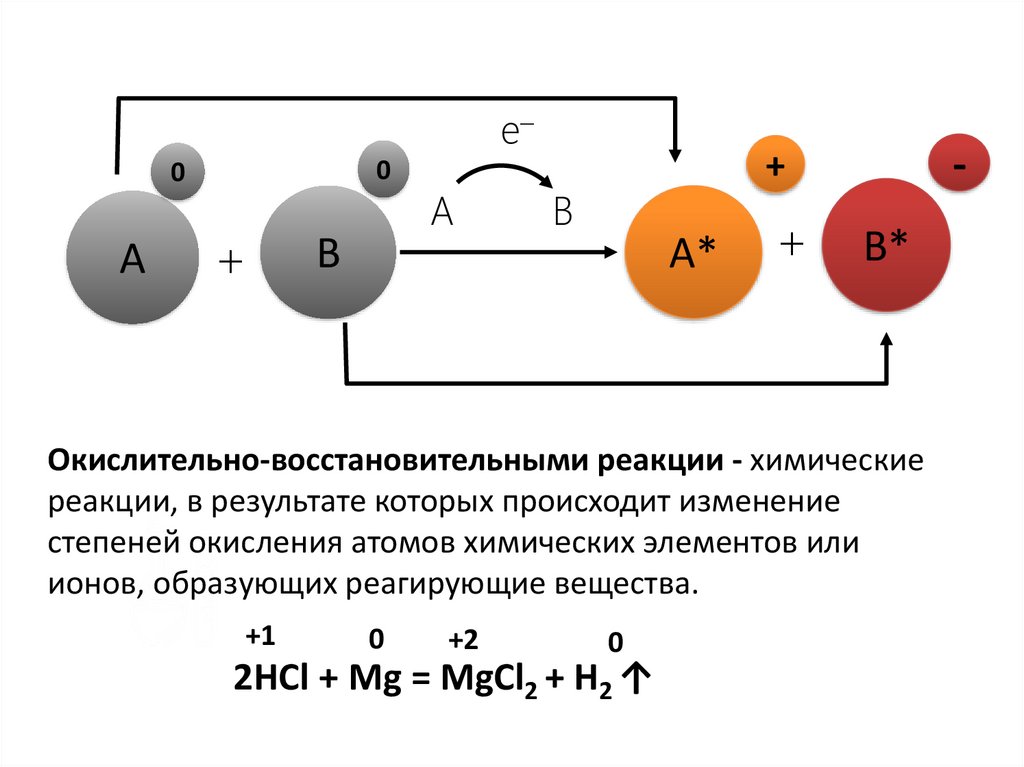
Окислительно-восстановительными реакции - химические
реакции, в результате которых происходит изменение
степеней окисления атомов химических элементов или
ионов, образующих реагирующие вещества.
+1
0
+2
0
2HCl + Mg = MgCl2 + H2 ↑
8.
Лабораторный способ получения водорода+1
0
-1
+2 -1
0
Zn + 2HCl = ZnCl2 + H2
0
+2
Восстановитель
+1
Окислитель
0
9.
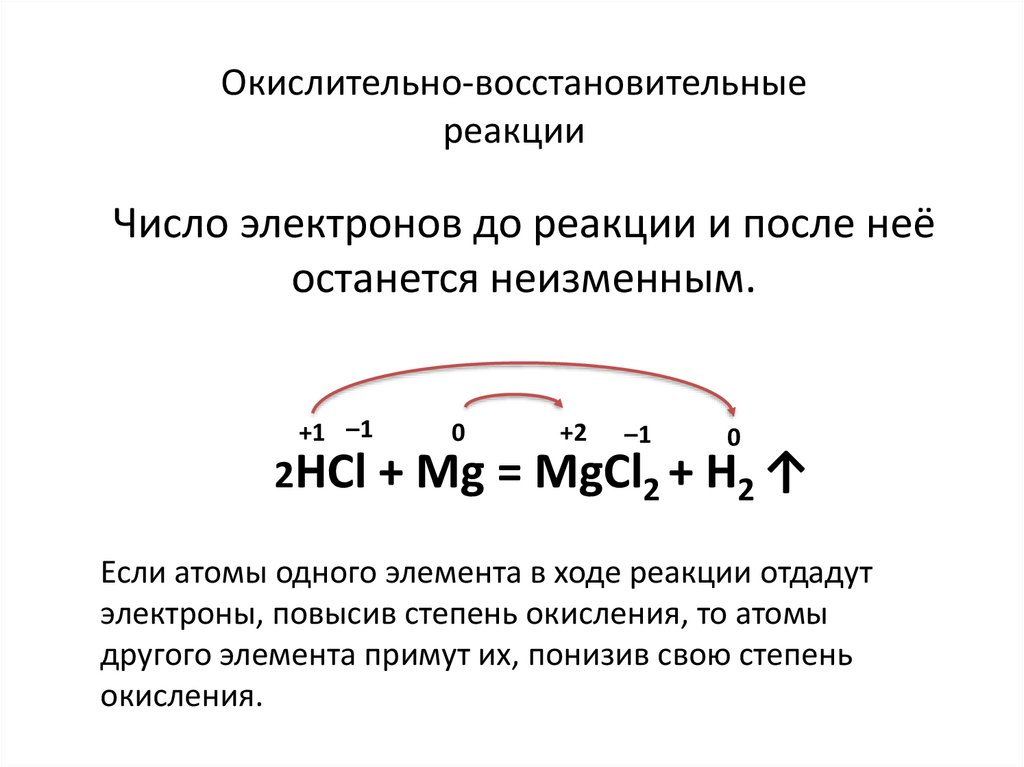
Окислительно-восстановительныереакции
Число электронов до реакции и после неё
останется неизменным.
+1 –1
0
+2
–1
0
2HCl + Mg = MgCl2 + H2 ↑
Если атомы одного элемента в ходе реакции отдадут
электроны, повысив степень окисления, то атомы
другого элемента примут их, понизив свою степень
окисления.
10.
Окислительно-восстановительныереакции
окисление
– 2e-
+1
–1
0
+2
–1
0
2 HCl + Mg = MgCl2 + H2
окислитель
восстановитель
+ e-
восстановление
электронный баланс реакции
11.
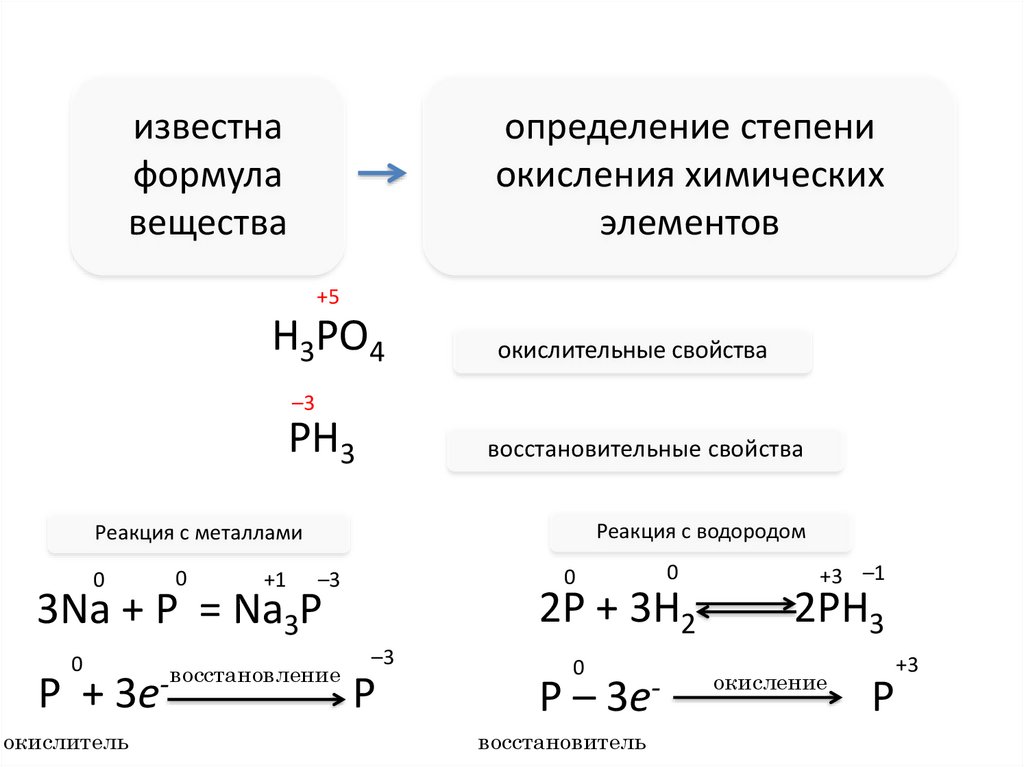
известнаформула
вещества
определение степени
окисления химических
элементов
+5
H3PO4
окислительные свойства
–3
PH3
восстановительные свойства
Реакция с водородом
Реакция с металлами
0
0
+1
0
–3
2P + 3H2
3Na + P = Na3P
0
P + 3eокислитель
восстановление
0
–3
P
0
P – 3eвосстановитель
+3 –1
2PH3
окисление
P
+3







 Химия
Химия








