Похожие презентации:
Кислоты в свете ТЭД их классификация и свойства
1. Кислоты в свете ТЭД их классификация и свойства
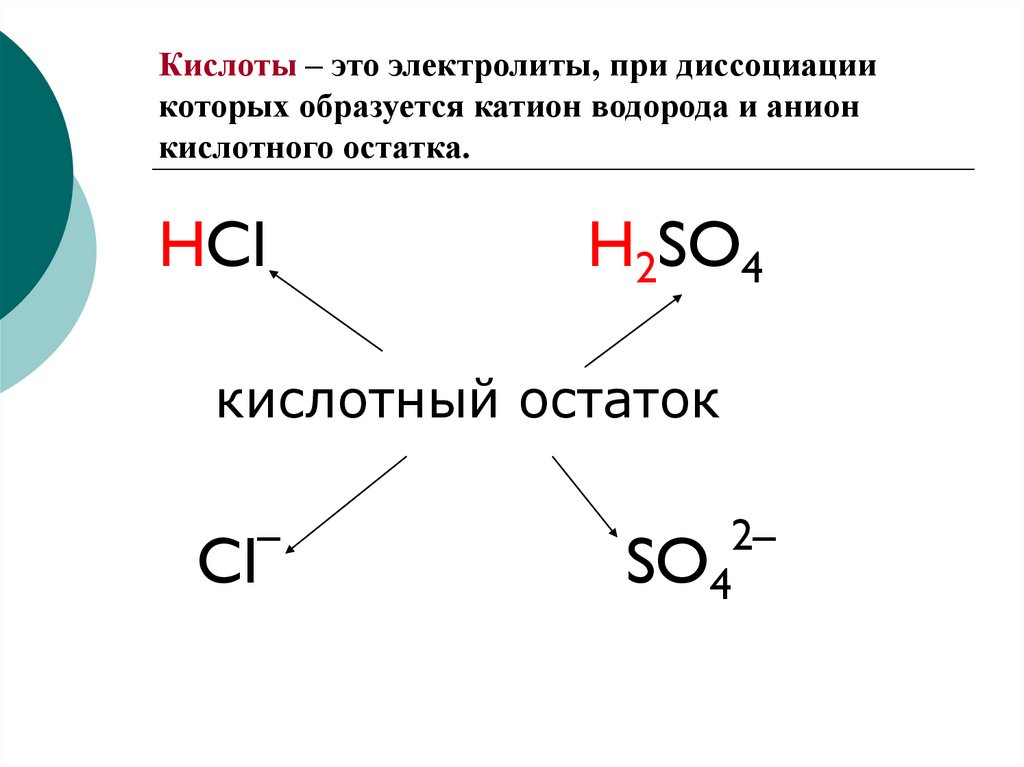
2. Кислоты – это электролиты, при диссоциации которых образуется катион водорода и анион кислотного остатка.
HClH2SO4
кислотный остаток
Cl
–
SO4
2–
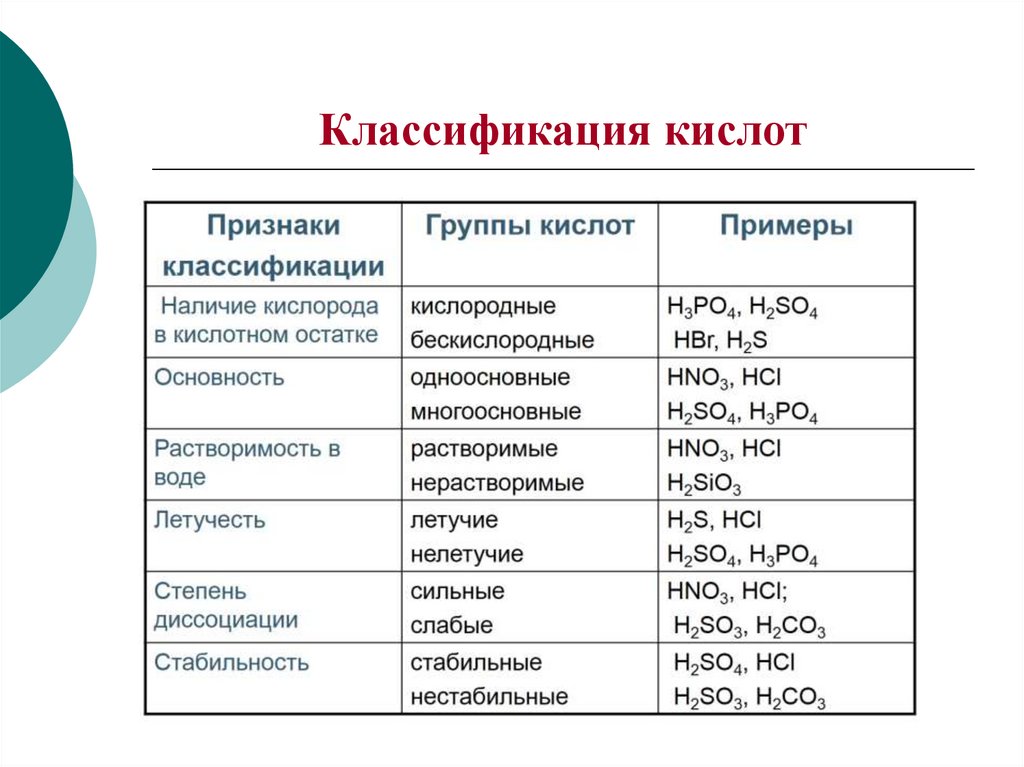
3. Классификация кислот
4. Техника безопасности
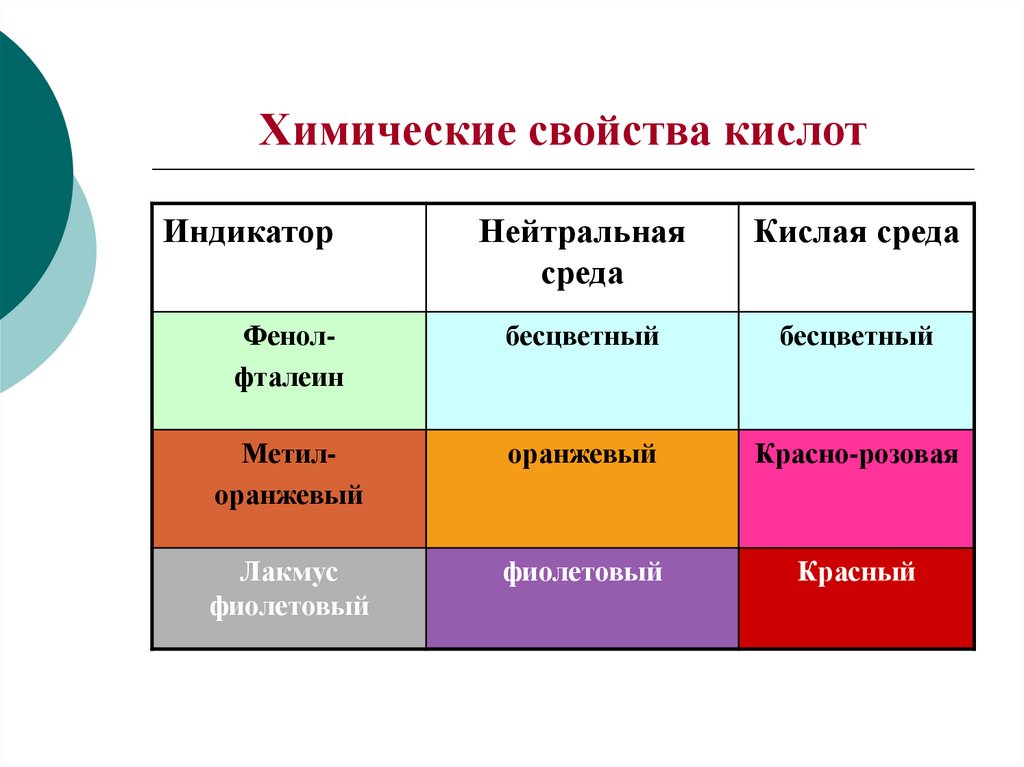
5. Химические свойства кислот
ИндикаторНейтральная
среда
Кислая среда
Фенолфталеин
бесцветный
бесцветный
Метилоранжевый
оранжевый
Красно-розовая
Лакмус
фиолетовый
фиолетовый
Красный
6. ТИПИЧНЫЕ РЕАКЦИИ КИСЛОТ
Кислота + металл = соль + водород(реакция замещения)
Условия протекания:
металл должен находиться до водорода
должна образовываться растворимая соль
2HCl + Zn = ZnCl2 + H2↑
7. ТИПИЧНЫЕ РЕАКЦИИ КИСЛОТ
Кислота + оксид металла = соль + водаH2SO4 + CuO = CuSO4 + H2O
8. ТИПИЧНЫЕ РЕАКЦИИ КИСЛОТ
Кислота + основание → соль + вода(реакция обмена, нейтрализации)
HCl + NaOH = NaCl + H2O
2HCl + Zn(OH)2 = ZnCl2 + 2H2O
9. ТИПИЧНЫЕ РЕАКЦИИ КИСЛОТ
Кислота + соль = новая соль + новая кислотаУсловия протекания:
Образование осадка
Выделение газа
2HCl + Na2CO3 = 2NaCl + CO2↑ + H2O
HCl + AgNO3 = AgCl↓ + HNO3
10. Применение кислот
11. Домашнее задание
§38, учить. Выучить классификацию кислот итипичные реакции на кислоты. Составить свои
варианты уравнений по схемам, помня правила
составления реакций:
1) Кислота + Основание =
2) Кислота + оксид металла =
3) Кислота + металл =
4) Кислота + соль =
Для первой реакции написать полное ионное и
сокращенное ионное уравнение!








 Химия
Химия








