Похожие презентации:
Периодический закон Д.И. Менделеева (8 класс)
1. Титова В.М. школа 1293
2.
3. Периодический закон Д.И. Менделеева
4.
Случилось в Петербурге это.Профессор университета
Писал учебник для студентов… .
Задумался невольно он:
«Как рассказать про элементы?
Нельзя ли тут найти закон?»
Искали многие решенье,
Но проходя лишь полпути,
Бросали. Мучило сомненье:
«А можно ли закон найти?»
5.
Мир состоит из элементов.( в то время знали 60).
А сколько их всего? На это
Нельзя ответить наугад.
Но не гадал, а верил он:
«Тут должен, должен быть закон!»
Упрямо он искал решенье.
Был Труд, Надежда и Терпенье,
И вера в то, что он найдёт!
Он так работал целый год.
6. Д. И. Менделеев (1834 – 1907) 17 февраля (1марта по новому стилю) 1869 г. – открытие периодического закона
7.
Периодичность– это
повторяемость явления через
определенные промежутки
времени
8. Группы сходных элементов
Щелочные металлы: Li, Na, K, Rb, Csгидроксид ROH
Щелочноземельные мtталлы: Ca, Sr, Ba
гидроксид R(OH)2
9. Группы сходных элементов
Щелочные металлы: Li, Na, K, Rb, Csгидроксид ROH
Щелочноземельные металлы: Ca, Sr, Ba
гидроксид R(OH)2
Галогены: F, Cl, Br, I водородное соединение HR
Благородные (инертные) газы: He, Ne, Ar, Kr, Xe
10.
11. С возрастанием атомных масс периодически:
ослабевают металлические свойства иусиливаются неметаллические свойства
в соединениях с кислородом высшая валентность
увеличивается от 1 до 8
в водородных соединениях валентность
увеличивается от 1 до 4, а затем уменьшается от
4 до 1
наблюдается (начиная с натрия) повторяемость
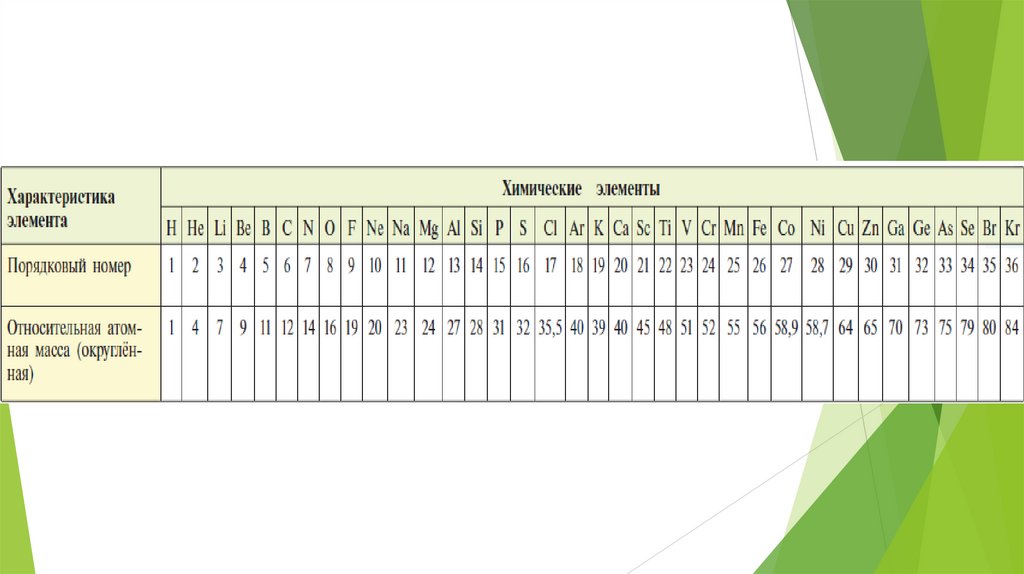
свойств элементов предыдущего ряда (см.
таблицу 15 на стр 171 учебника)
12. Формулировка периодического закона
Свойства простых тел, а также формы исвойства соединений элементов находятся
в периодической зависимости от величины
атомных весов элементов
13. Домашнее задание
Параграф 50, тест. зад. на стр 172, 180Знать понятия презентации и уметь их
комментировать












 Химия
Химия








